Dilauroylperoxid
Dilauroylperoxid ist eine chemische Verbindung aus der Gruppe der organischen Peroxide.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
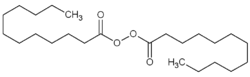 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dilauroylperoxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C24H46O4 | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 398,63 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
0,91 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (1,1–2,5 mg·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Dilauroylperoxid kann durch Reaktion von Lauroylchlorid mit Wasserstoffperoxid oder Natriumperoxid gewonnen werden.[2][4]
Eigenschaften
Dilauroylperoxid ist ein brennbarer weißer geruch- und geschmackloser[5] Feststoff, der praktisch unlöslich in Wasser ist. Er beginnt sich bei Erhitzung über 50 °C zu zersetzen.[1] Kalorimetrisch wurde ein Zersetzungswärme von −355 kJ·mol−1 bestimmt. Unterhalb des Schmelzpunktes verläuft die Zersetzung wesentlich langsamer als in der Schmelze.[6] Es kann mit brennbaren oder reduzierend wirkenden Substanzen explosionsartig reagieren.[5]
Verwendung
Dilauroylperoxid wird als Bleichmittel und Trocknungsmittel für Fette, Öle und Wachse sowie als Polymerisationskatalysator für Vinylchlorid und andere Verbindungen[7] verwendet.[4] Es kann auch als Reduktionsmittel bei der Barton-McCombie-Reaktion (Desoxygenierung von Alkoholen) eingesetzt werden.[5]
Einzelnachweise
- Eintrag zu Dilauroylperoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. November 2021. (JavaScript erforderlich)
- Silbert, L.S.; Swern, D.: Peroxides. VI. Preparation of t-Butyl Peresters and Diacyl Peroxides of Aliphatic Monobasic Acids in J. Am. Chem. Soc. 81 (1959) 2364–2367, doi:10.1021/ja01519a023.
- Eintrag zu Dilauroyl peroxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu DILAUROYL PEROXIDE in der Hazardous Substances Data Bank, abgerufen am 21. April 2015 (online auf PubChem).
- Eintrag zu Dilauroylperoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. April 2015.
- Jian-Ming Wie; Mei-Li You; Yung-Chuan Chu, Chi-Min Shu: Evaluation of thermal hazard for lauroyl peroxide by VSP2 and TAM III. In: J. Therm. Anal. Calorim. 109 (2012) 1237–1243, doi:10.1007/s10973-012-2350-2.
- Birgit Janza: Neue Methoden in der radikalischen Heterocyclensynthese. Cuvillier Verlag, 2006, ISBN 978-3-86727-140-0, S. 20 (eingeschränkte Vorschau in der Google-Buchsuche).
