Kaliumperoxodisulfat
Kaliumperoxodisulfat, häufig auch kurz Kaliumpersulfat, oft abgekürzt als KPS, ist das Kaliumsalz der Peroxodischwefelsäure. Das Persulfat-Ion enthält Sauerstoff in der instabilen Oxidationsstufe −1. Deswegen ist Kaliumpersulfat ein Radikalbildner und ein sehr starkes Oxidations- beziehungsweise Bleichmittel.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
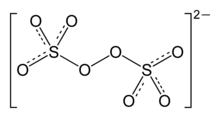 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumperoxodisulfat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | K2S2O8 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose Kristalle[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 270,32 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
2,48 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
Zersetzung[2] | ||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (50 g·l−1 bei 20 °C)[2], unlöslich in Alkohol[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Kaliumperoxodisulfat wird technisch durch Elektrolyse von konzentrierten Kaliumsulfat- oder Kaliumhydrogensulfat-Lösungen bei hohen Stromdichten (~1A/dm²) hergestellt. An der Anode werden Sulfationen zu Peroxodisulfationen oxidiert, an der Kathode wird Wasser zu Wasserstoff reduziert. Das relativ schwerlösliche Kaliumperoxodisulfat kristallisiert aus.[5]
Im technischen Prozess werden für die anodische Reaktion Platin- oder Glaskohlenstoff-Elektroden, die eine hohe Überspannung für Sauerstoffentwicklung haben, verwendet. Für die kathodische Reaktion werden Blei- oder Graphit-Elektroden eingesetzt. Bei kleinen Stromdichten und in verdünnten Lösungen reagieren die als Zwischenprodukt gebildeten Sulfat-Radikalanionen nicht miteinander zum Persulfation, sondern mit Wasser unter Sauerstoffentwicklung.
Eigenschaften
Werden Kaliumperoxodisulfatlösungen erwärmt (70–100 °C) oder UV-Strahlung ausgesetzt zerfällt das Persulfation in Sulfat-Radikalanionen. Diese Reaktion kann durch geeignete Katalysatoren beschleunigt werden, so dass sie bereits bei tieferer Temperatur (20–50 °C) nennenswert abläuft. Beispiele für Katalysatoren sind metallisches Platin, Silber(I)- und Kupfer(II)-Ionen.
Persulfate zählen zu den stärksten Oxidationsmitteln und werden in ihrer Oxidationskraft nur von Fluor, Ozon und Sauerstofffluoriden übertroffen. Allerdings verläuft die Oxidation relativ langsam. Sie sind in der Lage, nahezu alle organischen Verbindungen zu oxidieren. Aus Iodid-Lösungen wird langsam Iod abgeschieden, Mangan(II)-Salz-Lösungen werden zu Mangandioxid oxidiert, in Gegenwart katalytisch wirkender Silber(I)-Ionen sogar bis zum Permanganat.
Kaliumperoxodisulfat ist als kristalliner Feststoff stabil, zersetzt sich aber bei höheren Temperaturen unter Sauerstoffentwicklung. Bei ~100 °C ist der Zerfall vollständig. In feuchtem oder unreinen Zustand neigt es bereits bei wesentlich tieferen Temperaturen zur Zersetzung. Deshalb muss die Verbindung bei der Lagerung vor direktem Sonnenlicht und anderen Hitzequellen geschützt werden.
Lösungen von Kaliumperoxodisulfat reagieren sauer und zerfallen bei Raumtemperatur langsam und bei erhöhter Temperatur schnell. In stark saurem Medium (pH-Wert < 4) erfolgt die Zersetzung autokatalytisch. Die entstehende Säure katalysiert die weitere Zersetzung der Persulfationen.
Kaliumperoxodisulfat kann heftig mit Reduktionsmitteln reagieren. Mischungen von Kaliumperoxodisulfat und brennbaren Stoffen können auch unter Luftabschluss brennen.
Verwendung
Kaliumperoxodisulfat ist ein weit verbreiteter Initiator für die Polymerisation in Emulsion oder in Lösung, beispielsweise bei der Herstellung von Polyacrylaten, Polyvinylacetat und Polyvinylchlorid und bei der Copolymerisation in Emulsion von Acrylnitril, 1,3-Butadien, Styrol und anderen Monomeren. Diese Reaktionen mit einer Einsatzmenge von üblicherweise 0,1–0,5 % Kaliumperoxodisulfat werden meist bei 75 bis 95 °C durchgeführt. In Kombination mit Redoxsystemen sind auch Polymerisationen bei niedrigeren Temperaturen möglich. In der Kosmetik findet Kaliumperoxodisulfat als wesentlicher Bestandteil von Blondierzubereitungen zum Bleichen von Haaren und als bleichende Komponente in Haarfärbemitteln Verwendung. Kaliumperoxodisulfat wird in der Textilveredelung als Entschlichtungsmittel sowie als Bleichaktivator, vor allem für Kaltbleichverfahren, benutzt. Ferner wird es als Oxidationsmittel in chemischen Synthesen (Beispiel Elbs-Oxidation von Phenolen zu p-Diphenolen in alkalischer Lösung) und in der Analytik, beispielsweise als Aufschlussmittel, gebraucht.
Weitere Verwendungen findet Kaliumperoxodisulfat in Laboren zur Reinigung von Glasgeräten, in der Papierherstellung zur Modifizierung von Stärke, als Desinfektionsmittel und zur oxidativen Entfernung von Schadstoffen (beispielsweise Quecksilber in Abluftbehandlungssystemen).
In der Metall- und Elektronikindustrie wird Kaliumperoxodisulfat in geringem Umfang zum Schwarzfärben von Messing (Verfahren nach Erich Groschuff)[6] und zum Ätzen gedruckter Schaltungen (Leiterplatten) verwendet. Bei Letzterem wird entweder die Oberfläche oxidativ gereinigt (Anätzen) oder Kupfer oxidativ entfernt (Ätzen). Aufgrund der höheren Löslichkeit in Wasser wird jedoch Natriumpersulfat für diese Anwendung bevorzugt.
In der Analogfotografie kann Kaliumpersulfat als Abschwächer verwendet werden, um bei der Filmentwicklung Spuren von Thiosulfat von den Negativen zu entfernen. Früher wurde Kaliumperoxodisulfat auch als Mehlbehandlungsmittel zur „Mehlverbesserung“ verwendet. In Deutschland ist dies seit 1956/57 verboten.
Einzelnachweise
- Eintrag zu POTASSIUM PERSULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 4. März 2020.
- Eintrag zu Kaliumperoxodisulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Eintrag zu Kaliumperoxodisulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- Eintrag zu Dipotassium peroxodisulphate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 392–3.
- Thomas Walter Jelinek: Praktische Galvanotechnik: Ein Lehr- und Handbuch. Leuze, Bad Saulgau 2005, ISBN 3-87480-207-8.
Literatur
- Pradyot Patnaik: Handbook of Inorganic Chemicals. McGraw-Hill, New York 2002 ISBN 0-07-049439-8 (englisch)


