Kettenpolymerisation
Kettenpolymerisation (engl. nach IUPAC chain polymerization,[1] im deutschen Sprachraum oft und nicht IUPAC-konform als Polymerisation bezeichnet[2]) ist eine Sammelbezeichnung für Kettenreaktionen, bei denen sich fortlaufend und ausschließlich gleiche oder unterschiedliche Monomere an eine wachsende Polymerkette angliedern.[3] Die wachsende Kette verfügt über mindestens ein aktives Zentrum, an dem die Addition der Monomere stattfindet. Je nach Struktur der aktiven Zentren lassen sich die Polymerisationen in radikalische, kationische, anionische und koordinative Kettenpolymerisationen unterteilen. Bei Kettenpolymerisationen findet bei der Addition keine Abspaltung von Nebenprodukten statt.
Keine Kettenpolymerisationen sind Polyadditionen und Polykondensationen, bei denen die Polymerisation im Stufenwachstum erfolgen und damit Reaktionen zwischen Molekülen aller Polymerisationsgrade stattfinden.
Mechanismen
Radikalische Kettenpolymerisation
Die radikalische Polymerisation umfasst im Wesentlichen vier Teilschritte:
- Zerfall eines Initiators
- Startreaktion, bei der das aktive Zentrum gebildet wird.
- Wachstumsreaktion, bei der die makromolekulare Kette in einer Kettenreaktion wächst (wiederholte Anlagerung der Monomere), und
- Abbruchreaktion, bei der das Wachstum der Kette durch Disproportionierungsreaktionen oder Kombinierung irreversibel beendet wird.
Mechanismus
Ein zugesetzter Initiator zerfällt unter Bildung von zwei Radikalen R•. Der Zerfall wird in der Regel durch erhöhte Temperatur (40–90 °C) gefördert. Mit geeigneten Initiatoren kann der Zerfall beispielsweise auch photochemisch eingeleitet werden.
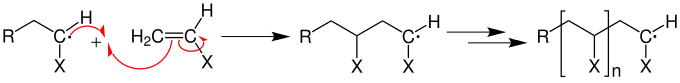
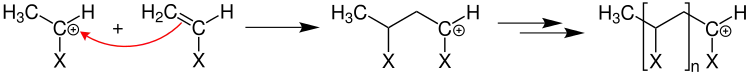
Zum Kettenstart bricht das Radikal die Mehrfachbindung (beispielsweise eine C=C-Doppelbindung einer Vinylgruppe) auf und erzeugt ein wachstumsfähiges Primärradikal:
An das Primärradikal lagern sich nun in einer Wachstumsreaktion mit geringer Aktivierungsenergie ständig Monomere an.
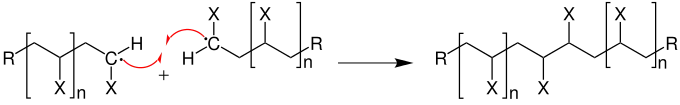
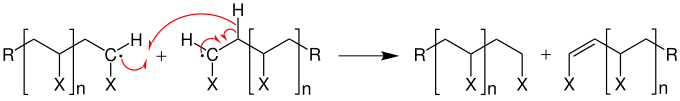
Durch das Zusammentreffen zweier Radikale, also durch Kombination, wird ein Kettenabbruch hervorgerufen.
Des Weiteren kann ein Kettenabbruch durch Disproportionierung herbeigeführt werden.
Daneben kann eine gewisse Kontrolle über die molare Masse erreicht werden, indem man der Polymerisation Kettenüberträger hinzufügt.
Kinetik der radikalischen Kettenpolymerisation
Für jede der Teilreaktionen der radikalischen Polymerisation lassen sich Gleichungen für die Reaktionsgeschwindigkeiten formulieren. Die Kenntnis dieser Zusammenhänge ermöglicht es, den mittleren Polymerisationsgrad eines entstehenden Polymers zu steuern, sowie einige bei der Polymerisation auftretende Effekte zu deuten.
Initiation
Die Geschwindigkeit der Initiation hängt von der Konzentration des Initiators und von dem entsprechenden Geschwindigkeitskoeffizienten ab:
Der Initiator-Zerfall liefert aber nicht unbedingt vollständig wirksame Radikale R*, da manche davon nicht einen Kettenstart verursachen, sondern anderweitig abreagieren oder rekombinieren. Dementsprechend wird ein Faktor eingeführt, der die Wirksamkeit des Initiatorzerfalls für den Kettenstart wiedergibt:
Kettenwachstum
Die Geschwindigkeit des Kettenwachstums, also des Monomerverbrauchs, ist abhängig von der Monomerkonzentration , der Konzentration der Polymerradikale und dem entsprechenden Geschwindigkeitskoeffizienten :
Rekombination
Die Geschwindigkeit der Rekombination, also des Verbrauchs an Polymerradikalen P*, hängt quadratisch von deren Konzentration ab und natürlich vom Koeffizienten :
Übertragung
Die Geschwindigkeit der Übertragung , hängt von der Konzentration des Überträgers , der Konzentration der Polymerradikale und dem Koeffizienten ab:
Wurzel-I-Gesetz
Aus den gegebenen Geschwindigkeitsgesetzen kann man eine Formel für die Wachstumsgeschwindigkeit herleiten. Diese gilt nur bei mittleren Umsätzen, gibt aber dann im Grunde die Bruttoreaktionsgeschwindigkeit an:
Mayo-Gleichung
Ebenso kann man das Zahlenmittel des Polymerisationsgrades bestimmen. Es ergibt sich aus dem Verhältnis der Wachstumsgeschwindigkeit zu den Geschwindigkeiten aller Reaktionen, bei denen das Wachstum abbricht:
Der amerikanische Chemiker Frank R. Mayo hat daraus eine Formel abgeleitet, mit der man entweder die Übertragungskonstante für ein Gemisch von Monomer und Überträger berechnen kann, oder den mittleren Polymerisationsgrad des entstehenden Polymers, wenn man konkrete Mengen Monomer und Überträger mischt:
Darin ist das Zahlenmittel des Polymerisationsgrades bei Abwesenheit eines Überträgers.
Syntheseverlauf
Der Verlauf einer Synthese über radikalische Polymerisation wird im einfachsten Fall nur über den Verbrauch der Monomere (als Bruttoreaktionsgeschwindigkeit) beobachtet und wird durch mehrere Faktoren bestimmt:
- Die Addition der Monomere an eine aktive Kette erfolgt sehr schnell und wird hauptsächlich von der Diffusion der Monomere zum aktiven Zentrum der wachsenden Kette bestimmt.
- Die Lebensdauer einer wachsenden Kette bis zur Abbruchreaktion ist im Vergleich zum Zeitraum der gesamten Synthese kurz.
- Über den gesamten Zeitraum der Synthese erfolgt fortwährend neue Startreaktionen durch fortwährenden Zerfall des Initiators. Die Zerfallsreaktion hat eine recht hohe Aktivierungsenergie und ist damit temperaturabhängig.
- Eine radikalische Polymerisation ist exotherm, da die schwächeren π-Bindungen der Doppelbindung des Monomers in stärkere σ-Bindungen des Makromoleküls überführt werden.
Die Umsetzung einer Mischung aus Monomer und Initiator (Substanzpolymerisation, auch Masse-Verfahren genannt) in einem geschlossenen Reaktor (Batch-Prozess) scheint der einfachste Fall zu sein:
Bei sehr kleinen Umsatz (< 0,01 %) entstehen zunehmend Initiator-Radikale und oligomere Radikale. Die Bruttoreaktionsgeschwindigkeit steigt rasant an und geht in einen kontinuierlichen Reaktionsverlauf über: Die Bruttoreaktionsgeschwindigkeit sinkt dabei kontinuierlich ab, da die Konzentration der Monomere durch die steigende Konzentration der Makromoleküle fällt. Die Konzentration der wachsenden Ketten (Kettenradikale) ist jedoch nahezu konstant (quasistationärer Zustand nach dem Bodenstein’sches Quasistationaritätsprinzip).
Ab dem Bereich von 20 bis 40 % Umsatz der Monomere ändern sich die Eigenschaften des Reaktionsgemisches deutlich, da die Monomere auch als Lösemittel für die Makromoleküle wirken. Die Viskosität des Reaktionsgemisches nimmt zu und die Polymerradikale sind wegen ihrer Größe diffusionsgehindert. Das hat zur Folge, dass weniger Abbruchreaktionen durch Kombination zweier wachsender Ketten stattfinden. Der Initiator zerfällt weiterhin und bildet neue wachsende Ketten, die mit den weiterhin mobilen Monomeren reagieren. Die Polymerisation unterliegt einer Selbstbeschleunigung, die auch als Gel- oder Trommsdorff-Norrish-Effekt bezeichnet wird. Da die Polymerisation exotherm ist und eine höhere Temperatur die Initiierung fördert, droht Explosionsgefahr, besonders wenn die Abführung der Wärme aus dem Reaktor nicht gelingt. Ab etwa 80 % Umsatz tritt der Glas-Effekt ein: Die Polymere und Kettenradikale sind mittlerweile unbeweglich, dass das Reaktionsgemisch langsam erstarrt (Glaszustand). Die übrigen Monomere sind im Reaktionsgemisch zunehmend unbeweglich, weswegen die Bruttoreaktionsgeschwindigkeit immer langsamer fortschreitet. Ein vollständiger Umsatz der Monomere wird i. d. R. nicht erreicht. Wegen des Gel-Effekts werden Substanzpolymerisationen im technischen Masstab nur begrenzt weit geführt und abgebrochen, da nur ungenügend Wärme abgeführt werden kann. Alternativen bieten andere technische Verfahren, im einfachsten Fall die Verwendung von Lösemitteln, um den Gel-Effekt zu vermindern und den Glaszustand zu vermeiden.
Ein Spezialfall der radikalischen Polymerisation ist die Popcorn-Polymerisation.
Kontrollierte radikalische Polymerisation
Durch Zusatz von 'Kontrollreagenzien' ist es möglich, Abbruchreaktionen der radikalischen Polymerisation zu unterdrücken, indem die wachsenden Ketten in einem dynamisches Gleichgewicht mit einem „schlafenden“ Zustand der aktiven Zentren gebracht werden.
Während sich bei konventionellen radikalischen Polymerisationen Molekulargewicht und Polydispersität kaum kontrollieren lassen, erlaubt eine Kontrollierte radikalische Polymerisation (CRP) die Herstellung von Polymeren mit kleiner Polydispersität (enge Molmassenverteilung) und beispielsweise niedrigem Molekulargewicht.
Bei einer kontrollierten radikalischen Polymerisation finden am Anfang der Synthese alle Initiierungen statt, da die Wachstumsreaktionen im Mittel nur langsam erfolgen. Zu jedem Zeitpunkt der Synthese liegt nur eine sehr geringe Konzentration von Teilchen mit reaktiver Kettenenden vor, da die meisten initiierten Ketten im „schlafenden“ Zustand sind. Die meisten initiierten Teilchen durchleben mit zeitweiligen „wachsen“ und zeitweiligem „schlafen“ den gesamten Syntheseverlauf, d. h. bis die Monomere aufgebraucht sind. Dies erlaubt beispielsweise einen anschließenden Zusatz eines Comonomers B, was zur Bildung von Blockcopolymeren (AAAABBB) führt.
Einige Kontrollreagenzien werden Inifer-Reagenzien (engl.: iniator transfer agent) genannt und zerfallen in ein aktives Radikal (dem Initiator der Polymerisation) und ein recht stabiles, persistentes Radikal, das nicht initiieren kann, aber durch Addition an ein aktives Zentrum die Kette reversibel in eine „schlafenden“ Zustand überführt. Beispiele für ein solches Verfahren ist die Atom Transfer Radical Polymerization (ATRP) und die Nitroxid-vermittelte radikalische Polymerisation (NMRP). Eine weitere Methode ist die RAFT-Polymerisation (engl.: Reversible addition-fragmentation chain transfer), bei der ein herkömmlicher Initiator verwendet wird und sich als „schlafender“ Zustand ein Adduktradikal bildet.
Kationische Kettenpolymerisation
Als Starter fungiert hier beispielsweise eine Säure wie Fluorborsäure, welche in der Startreaktion eine Monomereinheit an der Doppelbindung protoniert.
Bei der Wachstumsreaktion wird das aus der Startreaktion resultierende Kation an ein weiteres Monomer addiert, wobei wiederum ein Kation entsteht.
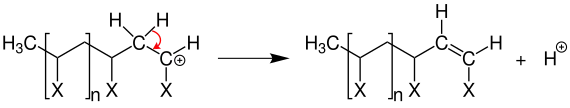
Eine Abbruchreaktion, wie bei der radikalischen Polymerisation, tritt nicht auf. Allerdings kann durch eine Eliminierungsreaktion ein Proton auf eine neue Monomereinheit übertragen werden.
Somit wird das Wachsen der Kette abgebrochen und ein Proton steht für eine weitere Startreaktion zur Verfügung.
Anionische Kettenpolymerisation
Hier stellt die wachsende Kette ein Anion dar, gestartet wird eine solche Reaktion durch Lithiumorganyle oder Grignard-Verbindungen. Häufig kann dabei keine Übertragungs- oder Abbruchreaktion formuliert werden, man spricht dann von einer lebenden Polymerisation. Dadurch können häufig Polymere mit sehr einheitlicher Kettenlänge (Polydispersität nahe eins) gewonnen werden. Anionische Polymerisationsreaktionen sind im Allgemeinen empfindlich gegen geringste Wasserspuren und erfordern daher sehr gründlich absolutierte Ausgangsstoffe.
Die Herstellung von Polyoxymethylen (POM) kann über eine anionischen Kettenpolymerisation von Formaldehyd erfolgen:
Initiierung der Polymerisation erfolgt durch eine Base, wie Natriummethanolat.
Das Wachstum erfolgt als Kettenpolymerisation:
Abbruch tritt durch Spuren von Wasser oder Methanol auf:
Koordinative Kettenpolymerisation
Die Katalysatoren sind Übergangsmetallverbindungen, deren Struktur so zu charakterisieren ist, dass ein Zentralatom (das Metall-Ion) derart von Liganden umgeben ist, dass ein Monomer und die Polymerkette daran anlagern (koordinieren) können. Das Prinzip beruht auf einer Aktivierung der Monomere aufgrund der Wechselwirkung des Monomers mit dem Metall. Die Doppelbindung im Monomer wird hierdurch geschwächt und die Anlagerung eines zweiten Monomers initiiert. Zur Stabilisierung der so entstandenen Komplexverbindung schiebt sich das Monomer in die bereits vorhandene Polymerkette ein und ein weiteres Monomer wird angelagert usw. Die Polymerisationsreaktion wird so in die Wege geleitet. Das Verfahren wird auch Insertionspolymerisation genannt.
Der Vorteil der Koordinationspolymerisation liegt darin, dass je nach Wahl von Katalysator und Monomeren die Taktizität des entstehenden Polymers gesteuert werden kann, die wesentlichen Einfluss auf die Polymereigenschaft haben kann.
Es gibt verschiedene Arten von Koordinationspolymerisationen mit unterschiedlichen Mechanismen. Die wichtigste ist die nach ihren Entdeckern benannte Ziegler-Natta-Polymerisation, die es erlaubt, bei niedrigen Temperaturen und niedrigen Drücken zum Beispiel Ethen zu linearem Polyethylen hoher Dichte (PE-HD) umzusetzen. Von großer Bedeutung ist zudem die Polymerisation mit Metallocen-Katalysatoren.
Speziellere Arten der Koordinationspolymerisation wie die ringöffnende Metathesepolymerisation (Ring-opening metathesis polymerisation, ROMP) finden ihre Anwendung bei der Herstellung von Spezialpolymeren, die mittels Ringöffnung und Verknüpfung cyclischer Monomere durch Übergangsmetallkatalysatoren produziert werden.
Technische Verfahren
- Substanzpolymerisation (auch Massen- oder Blockpolymerisation genannt): Monomer reagiert mit Initiator in reiner Form ohne Lösemittel
- Lösungspolymerisation: Monomer und Polymer in Lösungsmittel gelöst[4]
- Fällungspolymerisation: Monomer in Lösungsmittel gelöst, Polymer fällt aus[4][5]
- Emulsionspolymerisation: Monomer durch Emulgator in Wasser gelöst, Polymer fällt aus[4]
- Suspensionspolymerisation: Monomer durch Rühren und Stabilisatoren in Wasser suspendiert (kleine Tropfen), Polymer fällt aus
- Gasphasenpolymerisation: gasförmiges Monomer hält Polymerkörner in Wirbelbett[4]
- Polymerisation monomolekularer Schichten nach Langmuir-Blodgett[4]
Literatur
- J. M. G. Cowie: Chemie und Physik der synthetischen Polymeren., Vieweg, 2 Ed., 1991.
- K. Matyjaszewski, T.P. Davis: Handbook of Radical Polymerization., Wiley, 2002.
- B. Tieke: Makromolekulare Chemie, Wiley-VCH, 2002.
- H. G. Elias: Makromoleküle, Wiley-VCH, 2002.
Weblinks
- Polymerisationsverfahren in der Chemgapedia
- 2-Dimensionale Animation einer Radikalischen Kettenpolymerisation anhand von Polyvinylchlorid (PVC)
Einzelnachweise
- Eintrag zu chain polymerization. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C00958 – Version: 2.3.2.
- Eintrag zu Polymerisation. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- Bernd Tieke, Makromolekulare Chemie, 3. Auflage, Wiley-VCH, Weinheim, 2014, S. 60ff.
- Lechner, Manfred D.; Gehrke, Klaus; Nordmeier, Eckhard: Makromolekulare Chemie: ein Lehrbuch für Chemiker, Physiker, Materialwissenschaftler und Verfahrenstechniker. 4. Auflage. Birkhäuser, Basel; Boston, Mass.; Berlin 2010, ISBN 978-3-7643-8890-4, S. 160–170 (eingeschränkte Vorschau in der Google-Buchsuche).
- Karlheinz Biederbick: Kunststoffe, 4. Auflage, Vogel-Verlag, Würzburg, 1977, S. 60, ISBN 3-8023-0010-6.