Evolution der Säugetiere
Die Evolution der Säugetiere ist ein graduell verlaufender Prozess, der mit der Trennung der Sauropsiden- und Synapsiden-Linie irgendwann im Oberkarbon vor mehr als 300 Millionen Jahren begann und bis heute andauert. Bereits in der mittleren Trias existierten Vertreter, die Säugetieren sehr ähnlich sahen. Die ersten „echten“ Säugetiere traten jedoch erst in der Oberen Trias oder im Unteren Jura auf.
Sinodelphys, der früheste bekannte Beutelsäuger, lebte vor 125 Millionen Jahren in der Unterkreide ungefähr zeitgleich mit Eomaia, dem ersten bekannten Höheren Säugetier. Nur zwei Millionen Jahre später erschien dann auch das erste Kloakentier Teinolophos. Nachdem die nichtvogelartigen Dinosaurier dem großen Massenaussterben an der Kreide-Tertiär-Grenze zum Opfer gefallen waren (die Vögel gelten gemeinhin als Nachfahren der Dinosaurier), konnten sich die Beutelsäuger und die Höheren Säuger im Verlauf des Tertiärs in viele neue Taxa aufspalten und neue ökologische Nischen einnehmen. Bis zum Ende des Tertiärs hatten sich dann sämtliche modernen Ordnungen herausgebildet.
Unter dem Blickwinkel der stammesgeschichtlichen Entwicklung betrachtet sind Säugetiere die einzigen überlebenden Synapsiden. Die entwicklungsgeschichtliche Linie der Synapsiden hatte sich spätestens vor 306 Millionen Jahren im Oberkarbon von den Sauropsida (heutige Reptilien und Vögel) getrennt.[1] Während des Perms waren die Synapsiden die häufigsten und gleichzeitig größten Landwirbeltiere.[2] In der Trias jedoch wurden die Archosaurier, eine zuvor relativ unbedeutende Überordnung der Sauropsiden, zur vorherrschenden Wirbeltiergruppe. Eine Archosauriergruppe – die Dinosaurier – sollte dann für den gesamten Rest des Mesozoikums die dominierende Landwirbeltiergruppe stellen. Durch diese faunistischen Veränderungen waren die mesozoischen Säugerartigen gezwungen, in nachtaktive Lebensweisen auszuweichen. Dieser Nischenwechsel dürfte ausschlaggebend bei der Herausbildung typischer Säugetiereigenschaften wie Endothermie, Behaarung und großes Gehirnvolumen gewesen sein. Erst im späteren Mesozoikum gelang es einigen Säugetiergattungen, auch in andere ökologische Nischen vorzudringen. Beispiele hierfür sind Castorocauda, der im Wasser lebte, Volaticotherium, ein Gleitflieger, und Repenomamus, der sogar kleinen Dinosauriern nachstellte.
Der größte Teil unseres Wissens beruht auf Fossilfunden. Lange Zeit waren mesozoische Fossilien von Säugetieren und derer unmittelbarer Vorfahren sehr selten und bruchstückhaft, aber seit Mitte der neunziger Jahre wurden viele wichtige Neufunde gemacht, insbesondere in China. Relativ neue Techniken der Molekularphylogenetik konnten ihrerseits einige Aspekte der Säugetierevolution aufklären, indem sie Schätzalter für bedeutende Divergenzpunkte moderner Arten beisteuerten. Bei vorsichtiger Anwendung stimmen diese Techniken auch meist mit dem Fossilbericht überein.
Obwohl Milchdrüsen das kennzeichnende Merkmal der Säugetiere sind, ist das Wissen über die Evolution der Laktation noch gering. Auch über die Evolution eines anderen Wesensmerkmals, des Neokortex, ist praktisch so gut wie nichts bekannt. Ein großer Teil der Forschungen auf dem Gebiet der Säugetierevolution konzentriert sich auf die Entwicklung des Mittelohrs, welches sich aus dem Kiefergelenk vorhergehender Amnioten gebildet hat. Andere Forschungsrichtungen sind die Plazenta, aufrechte Gliedmaßen, verknöcherter sekundärer Gaumen, Behaarung und gleichwarme Körpertemperatur.
Definition von „Säugetier“
Lebende Säugetierarten lassen sich bei den Weibchen anhand der milchabsondernden Milchdrüse erkennen.
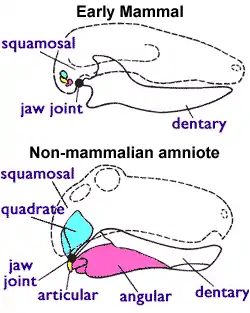
Zur Klassifizierung von Fossilien müssen jedoch andere Kriterien herangezogen werden, da Milchdrüsen und andere Weichkörpermerkmale in Fossilien meist nicht erhalten sind. Paläontologen bedienen sich deswegen eines Unterscheidungsmerkmales, das allen lebenden Säugetierarten (einschließlich der Beutelsäuger) gleichermaßen zu eigen ist, aber bei den Therapsiden («säugetierähnlichen Reptilien») aus der Untertrias nicht vorkommt: des Mittelohrs. Zwei Kieferknochen der Amnioten sind bei den Säugetieren ins Mittelohr gewandert, um eine bessere Übertragung des akustischen Signals zu erreichen. Die frühesten Amnioten besaßen ein Kiefergelenk, das aus dem Articulare (einem kleinen Knochen am Hinterende des Unterkiefers) und dem Quadratum (einem kleinen Knochen am Hinterende des Oberkiefers) zusammengesetzt war. Sämtliche nichtsäugetierartigen Amnioten (Echsen, Krokodile, Dinosaurier mit ihren Nachfahren, den Vögeln, und Therapsiden) zeichnen sich durch dieses Kiefergelenk aus. Die Säugetiere benutzen jedoch ein anderes Kiefergelenksystem, welches nur aus den Deckknochen Dentale (dem zahntragenden Unterkieferknochen) und Squamosum (kleiner Schädelknochen) aufgebaut ist. Bei den Säugetieren wurden das Quadratum und das Articulare zum Amboss (Incus) beziehungsweise zum Hammer (Malleus) im Mittelohr.[3][4]
Im Gegensatz zu den anderen Wirbeltieren mit einem einfachen Condylus occipitalis besitzen Säugetiere einen doppelten: An ihrer Schädelbasis befinden sich zwei Zapfen, die in den obersten Nackenwirbel passen.[3] Zur eindeutigen Identifizierung eines Säugers bedienen sich Paläontologen aber nur des Kiefergelenks in Verbindung mit dem Mittelohr als Kriterien. Denkbare Mischformen (z. B. ein säugerartiges Kiefergelenk und Mittelohr bei gleichzeitigem nichtsäugerartigen Condylus occipitalis) würden den Entscheidungsprozess nur unnötig erschweren.
Wegen meist nur geringfügigen, schrittweise erfolgenden Veränderungen bei so genannten Übergangsformen ist es oft schwierig, eine genaue Grenzlinie zwischen Reptilien und Säugetieren zu ziehen.
Die Abstammung der Säugetiere
Anschließend wird ein etwas vereinfachtes Kladogramm der Landwirbeltiere aufgezeigt, gefolgt von ausführlicheren Darstellungen über eventuelle Unsicherheiten und Streitpunkte.
| Landwirbeltiere (Tetrapoda) |
| |||||||||||||||||||||
Amnioten
Die ersten dauerhaften landbewohnenden Wirbeltiere waren die Amnioten. Ihre Eier besaßen interne Membranen, die dem heranwachsenden Embryo das Atmen möglich machten, aber gleichzeitig noch Feuchtigkeit zurückbehielten. Amnioten konnten daher ihre Eier auf dem Land ablegen, wohingegen Amphibien gewöhnlich ihre Eier im Wasser laichen (einige Amphibien wie z. B. die Wabenkröten haben andere Wege gefunden, diese Einschränkung zu umgehen). Wie es scheint, hatten sich die ersten Amnioten bereits im Oberkarbon aus ihren Vorfahren, den Reptiliomorpha, abgespalten.
Innerhalb nur weniger Millionen Jahre bestanden innerhalb der Amnioten bereits zwei deutlich voneinander abgegrenzte Evolutionslinien: die der Synapsiden, aus der die Vorläufer der Säugetiere und schließlich die Säugetiere hervorgingen, und die der Sauropsiden, aus der Echsen, Schlangen, Krokodile, Dinosaurier und Vögel hervorgingen.[1] Die ersten bekannten Fossilfunde von Synapsiden (beispielsweise Archaeothyris) und Sauropsiden (beispielsweise Hylonomus) sind zwischen 320 und 315 Millionen Jahre alt. Es ist schwierig, ihren genauen Evolutionszeitraum festzulegen, da Wirbeltierfunde aus dem Oberkarbon äußerst selten sind und ihr Erstauftreten womöglich bereits sehr viel früher erfolgte (Signor-Lipps-Effekt).[5]
Synapsiden
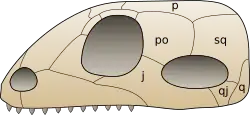
Synapsidenschädel werden anhand ihrer charakteristischen Anordnung der Temporalfenster bestimmt. Die Temporalfenster leisteten Folgendes:
- Sie machten den Schädel leichter, ohne dessen Stabilität preiszugeben.
- Sie waren energiesparend, da nicht so viel Knochenmaterial abgeschieden werden musste.
- Wahrscheinlich dienten sie als Ansatzstellen für die Kiefermuskulatur.
Ansatzstellen mit größerer Entfernung zum Kiefer bedeuteten längere Kiefermuskeln, die beim Bewegen des Kiefers einen starken Zug ausüben konnten, ohne dabei überdehnt oder allzu sehr kontrahiert zu werden.
Fossilfunde von Landbewohnern aus dem Unterperm legen nahe, dass die Pelycosauria, eine Ordnung der Synapsiden, zu ihrer Zeit die häufigsten und größten Landwirbeltiere stellten.[2]
Therapsiden
Die Therapsiden gingen im Mittleren Perm aus den Pelycosauria hervor und wurden nun ihrerseits zu den dominierenden Landbewohnern. Sie unterscheiden sich von den Pelycosauria anhand mehrerer Merkmale am Schädel und am Kiefer, so z. B. der größeren Temporalfenster und der gleich langen Schneidezähne.[6] Die Therapsiden durchliefen mehrere Entwicklungsstadien, wobei die ursprünglichen Formen den Pelycosauria noch sehr ähnlich waren, ihre Endglieder jedoch durchaus bereits mit Säugetieren verwechselt werden können. Sie zeichnen sich durch folgende Merkmale aus:[7]
- Ein verknöchertes sekundäres Gaumendach wird allmählich ausgebildet.
Meist wird diese Tatsache dahin interpretiert, dass sie eine Vorbedingung für einen hohen Stoffwechselumsatz darstellt, da die Tiere jetzt gleichzeitig fressen und atmen konnten. Einige Wissenschaftler weisen jedoch darauf hin, dass moderne wechselwarme Tiere zur Trennung von Mund und Atemweg einen sekundären Gaumen aus Bindegewebe besitzen und dass ein Gaumen aus Knochenmaterial für die Zunge ein Widerlager zum Bewegen der Nahrung darstellt und somit wesentlich mehr den Kauprozess als die unabhängige Atmung unterstützt.[8] Die Interpretation des verknöcherten sekundären Gaumendaches als Erleichterung des Kauvorgangs legt jedoch ebenfalls einen erhöhten Stoffwechsel nahe, da Kauen die Nahrung schneller verdauen lässt. Bei Säugern besteht der Gaumen aus zwei ganz spezifischen Knochen. Die permischen Therapsiden besaßen für die Gaumenfunktion nur eine etwas andersartige Knochenanordnung.
- Das Dentale wird allmählich zum Hauptknochen des Unterkiefers.
- Mit der allmählichen Aufrichtung der Gliedmaßen geht die Erhöhung der Ausdauer einher (Vermeidung der Carrier-Restriktion). Dies war ein sehr langsamer und erratischer Umwandlungsprozess. So haben sämtliche herbivor lebenden Therapsiden noch gebeugte Gliedmaßen. (Manche Spätformen hatten auch schon mehr geradlinig verlaufende Extremitäten.) Bei den fleischfressenden Therapsiden aus dem Perm waren die vorderen Extremitäten noch gebeugt und selbst im Oberen Perm waren bei ihnen die Hinterbeine immer noch halb gekrümmt. Selbst bei den modernen Beutelsäugern finden sich immer noch leicht gekrümmte Gliedmaßen.
- In der Trias findet der Übergang zum Säugetierkiefer und zum Mittelohr statt.
- Die Behaarung bei triassischen Therapsiden ist durchaus plausibel, bei den permischen Therapsiden gibt es hierfür jedoch noch keinerlei Indiz (siehe unten).
- Von einigen Wissenschaftlern werden gar Anzeichen für Laktation bei permischen Therapsiden ins Spiel gebracht (siehe unten).
Stammbaum der Therapsiden
Kladogramm vereinfacht übernommen von Palaeos;[6] aufgeführt sind nur für die Evolution der Säugetiere relevante Taxa:
| Therapsiden |
| ||||||||||||||||||||||||||||||
Nur Dicynodontier, Therocephalia und Cynodontier lebten noch in der Trias, alle anderen Taxa waren zuvor ausgestorben (Perm-Trias-Grenze).
Biarmosuchia
Die Biarmosuchia waren die ursprünglichsten Therapsiden und besaßen noch eine große Ähnlichkeit mit den Pelycosauria.
Dinocephalia
Die Dinocephalia («Furchtbare Köpfe») konnten die Größe eines Nashorns erreichen, unter ihnen befanden sich sowohl Herbivoren als auch Karnivoren. Einige unter den Karnivoren hatten halbwegs aufrechte Hinterbeine, die vorderen Gliedmaßen waren aber bei allen Vertretern der Dinocephalia noch gekrümmt. Sie waren in vieler Hinsicht sehr ursprüngliche Therapsiden, es fehlte ihnen beispielsweise ein sekundäres Gaumendach und ihr Kieferaufbau war noch sehr «reptilartig».[9]
Anomodontia
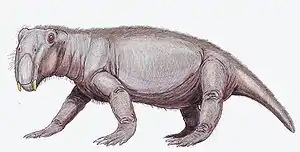
Die Anomodontia («Anomale Zähne») waren unter den herbivoren Therapsiden am erfolgreichsten. Die Dicynodontier, eine ihrer Unterordnungen, überlebten fast bis zum Ende der Trias. Anomodontia unterschieden sich in ihrem Äußeren jedoch sehr von modernen herbivoren Säugetieren. Ihre einzigen Zähne waren zwei große Hauer am Oberkiefer, außerdem besaßen sie einen hornartigen Schnabel, der dem der Vögel oder der Ceratopsiden nicht unähnlich war.[10]
Theriodontia
Die Theriodontia («Tierische Zähne») und ihre Nachkommen zeichneten sich durch Kiefergelenke aus, bei denen das Articulare des Unterkiefers das kleine Quadratum des Schädels sehr eng umschloss. Dadurch konnte der Kiefer weiter geöffnet werden. Dies ermöglichte z. B. den Gorgonopsia («Gorgonengesichter»), einer fleischfressenden Unterordnung der Theriodontia, «Säbelzähne» zu entwickeln. Aber das Kiefergelenk der Theriodontia hatte noch eine wesentlich weitreichendere Bedeutung – die starke Größenreduzierung des Quadratums war ein wichtiger Schritt in der Entwicklung zum Kiefergelenk und zum Mittelohr der Säugetiere. Auch die Gorgonopsia hatten immer noch primitive Merkmale:
- kein verknöchertes sekundäres Gaumendach (an seiner Stelle befanden sich andere Knochen mit gleicher Funktion),
- gekrümmte Vorderbeine,
- Hinterbeine, die sowohl gekrümmt als auch aufrecht eingesetzt werden konnten.
Die etwa zur gleichen Zeit erscheinenden Therocephalia («Tierköpfe») hatten jedoch schon mehr säugerähnliche Merkmale, beispielsweise waren ihre Finger- und Zehenknochen bereits aus derselben Gliederanzahl wie bei Säugetieren zusammengesetzt (dieselbe Gliederformel findet sich auch heute noch bei Primaten und folglich auch bei Hominiden).[11]
Cynodontia
Die Cynodontier sind eine Unterordnung der Theriodontia, die gleichfalls im Oberen Perm erschien. Sie schließt die Vorfahren sämtlicher Säugetiere und die Säugetiere mit ein. Die Familie der Trithelodontia wird allgemein als die Tiergruppe angesehen, unter der sich die Vorfahren der Säugetiere befanden. Zu den sehr säugerähnlichen Merkmalen der Cynodontier zählen:
- voranschreitende Reduzierung in der Anzahl der Unterkieferknochen,
- eine sekundäre verknöcherte Gaumenplatte,
- Backenzähne mit komplexem Zahnkronenmuster,
- vollständiges Ausfüllen der Schädelhöhlung durch das Gehirn.[12]
Es wurden mehrkammerige Tierbaue entdeckt, die bis zu 20 Skelette des untertriassischen Cynodontias Trirachodon enthielten. Vermutlich kamen die Tiere während einer Sturzflut ums Leben. Die recht komplex aufgebauten Kammern, die von mehreren Individuen geteilt wurden, lassen bereits auf ein recht ausgeprägtes Sozialverhalten der Tiere schließen.[13]
Triassischer Faunenwechsel
Das katastrophale Massenaussterben an der Perm-Trias-Grenze vernichtete etwa 70 Prozent aller terrestrischen Wirbeltierarten sowie den größten Teil der Landpflanzen. Unmittelbare Folge[14] war der Zusammenbruch der Ökosysteme und Nahrungsketten. Der Erholungsprozess dauerte immerhin 6 Millionen Jahre. Überlebende Tiergruppen waren gezwungen, erneut einen Behauptungskampf um ihre angestammten ökologischen Nischen auszutragen. Dies betraf auch die Cynodontier, die sehr wahrscheinlich gegen Ende des Perms die dominierende Tiergruppe gestellt hatten.
Den Behauptungskampf verloren die Cynodontier zugunsten einer bislang unscheinbar wirkenden sauropsiden Tiergruppe, den Archosauria (umfasst Krokodile, Dinosaurier und Vögel und deren Vorfahren). Der jähe Faunenumschwung wird oft als «Triassischer Faunenwechsel» bezeichnet. Als Erklärung wurden mehrere Hypothesen in Betracht gezogen. Am wahrscheinlichsten dürfte sein, dass in der überwiegend ariden Untertrias die Archosaurier besser gegen Verdunstungsprobleme gerüstet waren und somit einen entscheidenden Vorteil gegenüber ihren Konkurrenten davontrugen (sämtliche bekannten Sauropsiden besitzen eine Haut ohne Drüsen und scheiden Harnsäure aus, Säugetiere und vermutlich auch Therapsiden hingegen Harn – um Harnsäure flüssig zu halten, wird weniger Wasser benötigt als bei Harn).[7][15] Der triassische Faunenwechsel ging nur langsam vonstatten. Noch ganz zu Beginn der Trias waren die Cynodontier die hauptsächlichen Karnivoren und Lystrosauria die wichtigsten Herbivoren, jedoch bereits in der Mittleren Trias hatten die Archosaurier alle bedeutenden Nischen von Fleisch- und Pflanzenfressern besetzt.
Möglicherweise war jedoch gerade der triassische Faunenwechsel ein ausschlaggebender Faktor in der evolutionären Entwicklung von den Cynodontiern zu den Säugetieren. Die Nachfahren der Cynodontier konnten nur noch als kleine nachtaktive Insektenfresser weiterbestehen.[12] Dies hatte folgende Auswirkungen:
- Der bei den Therapsiden begonnene Entwicklungsprozess zu differenzierten Zähnen mit präzisem Kieferschluss beschleunigte sich, da erbeutete Arthropoden festgehalten und ihre Panzer aufgebrochen werden mussten.
- Eine nachtaktive Lebensweise verlangte nach verbesserter Wärmedämmung und Thermoregulation, da die Vorläufer der Säugetiere jetzt während der kühlen Nacht auf Beutefang gingen.[16]
- Überlebenswichtig wurden daher ein verbesserter Gehör- und Geruchssinn.
- Die Entwicklung zum säugerartigen Mittelohr beschleunigte sich und als Folge natürlich auch die des Kiefergelenks, da Knochen aus dem Kiefer ins Ohr abwanderten.
- Die größer gewordenen Gehirnloben für den Gehör- und Geruchssinn bedingten ihrerseits insgesamt eine prozentuale Gewichtszunahme des Gehirns im Vergleich zum Gesamtkörpergewicht. Gehirngewebe hat überdies einen überdurchschnittlichen Energiebedarf.[17][18] Der wegen des größeren Gehirns gestiegene Nahrungsbedarf erhöhte den evolutionären Druck in Richtung verbesserte Wärmeisolation, Temperaturregelung und Nahrungsverwertung.
- Eine Nebenwirkung des nachtaktiven Lebensstils war eine Einbuße in der Qualität des farblichen Sehens. Es gingen zwei der vier Opsine verloren – die meisten Säuger haben deshalb auch nur ein relativ schlechtes Farbsehen, darunter Halbaffen wie z. B. die Lemuren.[19]
Von Cynodontiern zu echten Säugetieren
Viele Unsicherheiten
Auch wenn der triassische Faunenwechsel die Evolution der Säugetiere beschleunigt haben mag, so machte er dennoch die Arbeit für Paläontologen nicht unbedingt leichter. Gute Fossilfunde von Säugerähnlichen sind extrem selten, da sie meist nicht viel größer als Ratten waren. Weitere Gründe sind:
- Säugerähnliche waren an Ökotope gebunden, die selten gute Fossilien hinterlassen. Unter terrestrischen Ökotopen sind Flussauen am besten zur fossilen Erhaltung geeignet, da jahreszeitlich bedingte Hochwasser tote Tierkörper sehr rasch in einer schützenden Siltlage einbetten, welche sich dann später zu Sedimentgestein verdichtet. Auenlandschaften werden aber meist von mittelgroßen bis großen Tieren dominiert – eine Größenordnung, in welcher die triassischen Therapsiden und Säugerähnlichen nicht mit den Archosauria konkurrieren konnten.
- Vor einer eventuellen Fossilisation fiel ihr zierlicher Knochenbau meist der Zerstörung anheim – verursacht durch Pilze und Bakterien oder durch rein physische Einwirkungen.
- Kleine Fossilien sind schwieriger zu finden und sind vor ihrer Entdeckung außerdem anfälliger gegenüber Verwitterung und anderen natürlichen Vorgängen. Noch in den frühen Achtzigern herrschte unter Paläontologen die Ansicht, dass sämtliche mesozoischen Säugetiere und Säugerähnlichen in ein paar Schuhschachteln Platz fänden, da es sich im Wesentlichen um Zahnmaterial handelte, die dauerhafteste aller Gewebearten.[20] Seitdem hat jedoch die Zahl der mesozoischen Säugerfunde stark zugenommen, von 116 Gattungen im Jahr 1979 auf 310 Gattungen im Jahr 2007. Gleichzeitig hat sich auch die Qualität der Funde erhöht, bei 18 mesozoischen Säugetierfunden ist nämlich nahezu ihr vollständiges Skelett erhalten geblieben.[21]
Daraus folgt:
- Oft ist es schwierig, ein mesozoisches Säuge- oder säugerähnliches Tier einer Gattung zuzuordnen.
- Sämtliche Fossilfunde einer einzigen Gattung ergeben nur selten ein vollständiges Skelett. Es ist daher meist nur selten möglich, den Grad der Verwandtschaft der einzelnen Gattungen abzuwägen, geschweige denn eine kladistische Einordnung vorzunehmen.
Die Evolution der Säugetiere im Mesozoikum steckt daher noch voller Unsicherheiten. Unbezweifelbar bleibt nur die Tatsache, dass die eigentlichen Säugetiere zum ersten Mal im Mesozoikum erschienen.
Säugetiere oder Säugerartige (Mammaliaformes)?
Ein Resultat dieser Unsicherheiten war die Neudefinition des Begriffs «Säugetier» in der Paläontologie. Über lange Zeit wurde ein Fossil einem Säugetier zugeordnet, wenn es das Kriterium Kiefergelenk/Mittelohr erfüllte. Neuerdings jedoch definieren Paläontologen ein «Säugetier» als den letzten gemeinsamen Vorfahren von Kloakentieren, Beutelsäugern und Höheren Säugetieren sowie all seine Nachkommen. Sie waren daher gezwungen, eine weitere Klade Mammaliaformes einzuführen, welche all die Tiergruppen aufnahm, die den Säugern näher standen als den ursprünglicheren Cynodontiern, aber dennoch von den Kloakentieren, Beutelsäugern und Höheren Säugetieren verschieden waren.[22] Auch wenn die Mehrheit der Paläontologen diesen kladistischen Neuansatz vertritt, so gibt es Querdenker; ihrer Meinung nach werden die meisten Probleme nämlich nur in eine neue Klade verlagert, ohne dabei einer Lösung näher zu kommen. So enthält die Klade Mammaliaformes jetzt Tiergruppen mit typischem Säugetierkiefergelenk und Tiergruppen mit typischem Reptilkiefergelenk. Außerdem hängt die Neudefinition von «Säugetier» und «Säugerartigen» von den letzten gemeinsamen Vorfahren beider Gruppen ab, die aber bisher noch nicht gefunden worden sind.[20] Trotz dieser Einwände folgt dieser Beitrag der vorherrschenden Ansicht und betrachtet die meisten mesozoischen Nachfahren der Cynodontier als Säugerartige (Mammaliaformes).
Kladogramm – Von den Cynodontiern zu echten Säugetieren
(beruht auf dem Beitrag Mammaliformes – Palaeos)[23]
| Mammaliaformes |
| ||||||||||||||||||||||||||||||
Multituberculata
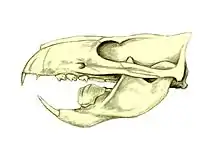
Die Multituberculata (Namensgebung anhand der vielen Tuberkel auf ihren Backenzähnen) werden oft als die «Nagetiere des Mesozoikums» bezeichnet. Es handelt sich hier aber vielmehr um ein Beispiel konvergenter Evolution als um eine tatsächliche Verwandtschaftsbeziehung. Auf den ersten Blick sehen die Multituberculata auch den Säugetieren durchaus sehr ähnlich: Ihr Kiefergelenk besteht aus dem Dentale und dem Squamosum, Quadratum und Articulare sind Bestandteile des Mittelohrs. Ihre Zähne sind differenziert, zeigen Okklusion und tragen säugetierartige Höcker. Sie besitzen einen Jochbogen. Die Form ihres Beckens legt den Schluss nahe, dass sie ähnlich wie die Beutelsäuger nur winzige Junge zur Welt brachten. Die Multituberkulaten waren eine sehr langlebige Tiergruppe, die 120 Millionen Jahre überdauerte (vom Mittleren Jura vor rund 160 Millionen Jahren bis ins Untere Oligozän vor rund 35 Millionen Jahren). Sie dürften somit die erfolgreichste Säugergruppe gewesen sein.
Bei eingehenderer Betrachtung zeigen sich jedoch bedeutsame Unterschiede zu modernen Säugetieren:[22]
- Ihre «Backenzähne» tragen zwei parallel verlaufende Reihen von Tuberkeln, nicht zu vergleichen mit den tribosphenischen (dreihöckrigen) Backenzähnen früher Säugetiere.
- Ihre Kauweise erfolgt auf gänzlich andere Art. Säugetiere kauen mit einer seitwärts verlaufenden mahlenden Bewegung, wobei die Backenzähne nur jeweils auf einer Backenseite dicht schließen. Die Multituberkulaten konnten keine seitliche Kaubewegung ausführen, sie mussten vielmehr beim Kauen die Zähne des Unterkiefers in einer Rückwärtsbewegung gegen die Zähne des Oberkiefers führen.
- Der vorwärts gerichtete Teil des Jochbogens besteht aus der Maxilla (Oberkieferknochen) und nicht aus dem Jochbein; das Jochbein ist vielmehr nur ein kleiner Knochen, der in eine kleine Einbuchtung in einer Ausstülpung des Oberkieferknochens eingreift.
- Das Squamosum gehört nicht zum Hirnschädel.
- Das Rostrum (Schnauze) erscheint völlig anders, es ähnelt mehr dem Rostrum von Pelycosauria wie beispielsweise Dimetrodon. Die Schnauze der Multituberculata ist schachtelförmig aufgebaut – die beiden breiten, abgeflachten Oberkieferknochen bilden die Seiten, das Nasale den Deckel und die große Prämaxilla die Vorderabdeckung.
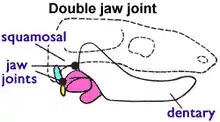
Morganucodontidae
Die Morganucodontidae treten im Fossilbericht zum ersten Mal in der Oberen Trias vor 205 Millionen Jahren auf. Sie sind ein Paradebeispiel einer Übergangsform, da bei ihnen gleichzeitig das Dentale-Squamosum-Kiefergelenk und das Articulare-Quadratum-Kiefergelenk ausgebildet sind.[24] Unter den Mammaliaformes gehören sie zu den frühesten Funden. Sie wurden ausführlich untersucht, da von ihnen zahlreiche Individuen entdeckt wurden.
Docodonta

Das herausragendste Mitglied der Docodonta ist Castorocauda («Biberschwanz»), der im Mittleren Jura vor ungefähr 164 Millionen Jahren lebte. Castorocauda wurde im Jahr 2004 entdeckt und 2006 erstmals wissenschaftlich beschrieben. Er war weder ein typischer Docodonta noch ein echtes Säugetier, dennoch stellt er für die Erforschung der Säugetierevolution einen äußerst wichtigen Fund dar, da der Schädel vollständig erhalten war und außerdem das stereotype Bild der Säugetiere als «kleine nachtaktive Insektivoren» durchbrochen wurde:[25]
- Castorocauda ist wesentlich größer als bisher bekannte Säugerähnliche – etwa 43 Zentimeter von der Nase bis zur Schwanzspitze (bei einer Schwanzlänge von 13 Zentimetern) und dürfte etwa 500 bis 800 Gramm gewogen haben.
- Er liefert den ersten unwiderruflichen Beweis für Behaarung und Fell. Zuvor war dies Eomaia, ein etwa 125 Millionen Jahre altes echtes Säugetier.
- Er zeigt Anpassungen ans aquatische Milieu wie beispielsweise abgeflachte Schwanzwirbel und Gewebeüberreste zwischen den Zehen der Hinterbeine, die als Schwimmhäute interpretiert werden können. Vor Auffinden Castorocaudas stammten die ersten Säugerähnlichen mit semiaquatischer Lebensweise aus dem Eozän, waren also rund 110 Millionen Jahre jünger.
- Die kräftigen Vorderbeine scheinen für eine grabende Tätigkeit prädisponiert zu sein. Dieses Merkmal zusammen mit den Fortsätzen an den Knöcheln erinnern an Platypus, der ebenfalls eine schwimmende und grabende Lebensweise ausübt.
- Die Zähne sind offensichtlich an Fischnahrung angepasst: die ersten beiden Backenzähne trugen geradlinig angeordnete Höcker, eine Anordnung, die eher fürs Zupacken und Auftrennen als fürs Kauen taugte; außerdem sind sie nach rückwärts gebogen, um schlüpfrige Beute besser festhalten zu können.
Hadrocodium
Das oben abgebildete Kladogramm zeigt Hadrocodium nur als «Tante» der echten Säugetiere, wohingegen Symmetrodonta und Kuehneotheriidae als Schwestergruppen der echten Säugetiere dargestellt sind. Von den Symmetrodonta und den Kuehneotheriidae besitzen wir aber nur wenige und sehr bruchstückhafte Fossilien, die beiden Gruppen sind daher noch nicht genau bekannt und vielleicht auch paraphyletisch.[26] Von Hadrocodium jedoch gibt es gutes Fossilmaterial (zirka 195 Millionen Jahre alt aus dem Unteren Jura), das einige sehr wichtige Wesensmerkmale aufweist:[27]
- Das Kiefergelenk setzt sich aus dem Squamosum und dem Dentale zusammen. Im Unterschied zu den Therapsiden besitzt das Hinterende des Unterkiefers keine weiteren kleinen Knochen mehr.
- Bei Therapsiden und bei den meisten Mammaliaformes spannt sich das Trommelfell über eine Vertiefung des Unterkiefers. Hadrocodium besaß diese Anordnung nicht mehr, was darauf schließen lässt, dass sein Ohr wie bei den echten Säugetieren vollständig zum Schädel gehörte und dass das Articulare und das Quadratum ins Mittelohr gewandert waren und zu Hammer und Amboss wurden. Der Unterkiefer besitzt aber dennoch eine «Einbuchtung» an seinem Hinterende, die bei echten Säugetieren verloren gegangen ist. Dies deutet darauf hin, dass der Unterkiefer von Hadrocodium trotz fehlendem Articulare und Quadratums dieselbe Form beibehielt und Hadrocodium oder ein sehr enger Verwandter deswegen die ersten Tiere mit einem vollausgebildeten, säugertypischen Mittelohr waren.
- Bei Therapsiden und den frühen Mammaliaformes saß das Kiefergelenk sehr weit hinten am Schädel. Auch das Ohr lag am Hinterende des Kiefers, musste aber auch gleichzeitig in Gehirnnähe verbleiben. Diese Anordnung behinderte eine Erweiterung des Gehirnschädels. Außerdem war die Kiefermuskulatur gezwungen, über den Gehirnschädel hinweg zu verlaufen. Da bei Hadrocodium die unterstützende Funktion für das Ohr wegfiel, waren Gehirnschädel und Kiefer nicht mehr aneinander gebunden und das Kiefergelenk konnte weiter nach vorne rücken. Bei den Nachfolgern von Hadrocodium oder bei Taxa mit ähnlichem Aufbau konnte sich der Gehirnschädel dann weiter ausdehnen, ohne vom Kiefer behindert zu werden. Der Kiefer war jetzt seinerseits zu Veränderungen fähig, da er keine Tragefunktion für das Ohr mehr hatte – Fazit: der Weg für die Säugerähnlichen war frei geworden, ein größeres Gehirn zu entwickeln und Kiefer und Zähne rein für eine spezialisierte, effizientere Fressfunktion umzugestalten.
Die ersten echten Säugetiere
Dieser Entwicklungsabschnitt bringt weitere Komplikationen mit sich, da die echten Säugetiere die einzige Tiergruppe mit noch lebenden Taxa sind:
- Es muss daher zwischen ausgestorbenen Gruppen und Gruppen mit noch lebenden Taxa unterschieden werden.
- Es wird oft versucht, die Evolution von nicht fossilisierbaren Charakteristika zu erklären. Dieses Unterfangen bedient sich der Molekularphylogenese, einer Technik, die seit den Mittachtzigern an Popularität gewann aber nach wie vor wegen ihrer Prämissen nicht unumstritten ist, insbesondere was die Verlässlichkeit der molekularen Uhr anbelangt.
Kladogramm der frühen echten Säugetiere
(basiert auf Mammalia: Overview – Palaeo[28]; ein † kennzeichnet ausgestorbene Taxa)
| Säugetiere |
| ||||||||||||||||||||||||||||||||||||
Australosphenida und Ausktribosphenidae
Mit dem Taxon Ausktribosphenidae wurde eine Gruppe merkwürdiger Fossilien belegt, die sich wie folgt auszeichnet:[29]
- Die Gruppe besitzt offensichtlich tribosphenische Molaren, die sonst nur bei Höheren Säugetieren und Beutelsäugern bekannt sind.[30]
- Diese Fossilien wurden in Fundstellen aus der Mittleren Kreide Australiens entdeckt.
Australien hing zum damaligen Zeitpunkt nur noch an der Antarktis. Die Höheren Säugetiere hatten ihren Ursprung auf der Nordhemisphäre und waren an diese so lange gebunden, bis es durch die Kontinentaldrift zur Bildung von Landbrücken zwischen Nord- und Südamerika, zwischen Asien und Afrika und zwischen Asien und Indien kam.[31]
- Es liegen nur Schädel- und Kieferfragmente vor.
Das Taxon Australosphenida wurde eingeführt, um gleichzeitig die Ausktribosphenidae und die Kloakentiere aufzunehmen. Asfaltomylos aus dem Mittleren bis Oberen Jura Patagoniens wird als ein ursprünglicher Australosphenida angesehen, der über große Teile Gondwanas, des einstigen Südhemisphären-Superkontinents, verbreitet gewesen sein soll.[32] (Basale Australosphenida besitzen Merkmale, die sowohl von den Ausktriboshenidae als auch den Kloakentieren geteilt werden. Die An- oder Abwesenheit taxonspezifischer Charaktermerkmale der Ausktribosphenidae oder der Kloakentiere teilen sie jedoch nicht.)
Eine erst kürzlich vorgenommene Untersuchung des 115 Millionen Jahre alten Teinolophos kommt zu dem Schluss, dass es sich hier um ein fortgeschrittenes und relativ spezialisiertes Kloakentier handelt und die ursprünglichen Kloakentiere daher wesentlich älter sein müssen. Außerdem dürften einige angebliche Australosphenida (beispielsweise Steropodon) ebenfalls fortgeschrittene Kloakentiere gewesen sein. Andere angebliche Australosphenida (wie z. B. Ausktribosphenos, Bishops, Ambondro und Asfaltomylos) sind wahrscheinlich näher mit den Theria (siehe weiter unten) verwandt oder gehören womöglich zu ihnen.[33]
Kloakentiere
Das älteste bekannte Kloakentier ist Teinolophos, der vor rund 123 Millionen Jahren in Australien lebte. Neuere Studien kommen jedoch zu dem Ergebnis, dass es sich hier nicht um ein urtümliches Kloakentier, sondern um ein bereits voll entwickeltes Schnabeltier handelt. Die Evolutionslinien der Schnabeltiere und Ameisenigel mussten sich demzufolge früher abgespalten haben und die ursprünglichen Kloakentiere sind sogar noch wesentlich älter.[33]
Kloakentiere zeichnen sich durch Merkmale aus, die eventuell von den ursprünglichen Amnioten geerbt wurden:
- Dieselbe Körperöffnung dient wie bei Echsen und Vögeln zur Ausscheidung von Urin und Kot sowie zur geschlechtlichen Fortpflanzung. (Der lateinische Begriff «Monotremata» bedeutet «alleinige Öffnung».)[34][35]
- Wie Echsen, Schildkröten und Krokodile legen sie ledrige und nichtkalzifizierte Eier.
Im Unterschied zu anderen Säugetieren besitzen weibliche Kloakentiere keine Zitzen. Sie stillen ihre Jungen, indem sie Milch an mehreren Stellen in ihrer Bauchgegend «ausschwitzen».
Diese Merkmale sind bei Fossilien gegenstandslos und Paläontologen bedienen sich folglich anderer Charakteristika:[29]
- Der Unterkiefer mit kleinem oder nicht vorhandenem Kronenfortsatz ist schlank.
- Die Außenöffnung des Ohrs liegt an der hinteren Kieferbasis.
- Das Jochbein ist klein oder nicht vorhanden.
- Der Schultergürtel ist ursprünglich mit verstärkten Rabenbeinen, Schlüsselbeinen und Interclaviculae. Diese kommen bei den Theria nicht vor.
- Die Vorderbeine sind gebeugt oder halb gebeugt.
Theria
Die Theria («Wilde Tiere») sind eine hypothetische Tiergruppe, aus der sowohl die Metatheria (inklusive Beutelsäuger) als auch die Eutheria (inklusive Höhere Säugetiere) hervorgingen. Auch wenn bisher noch keine eindeutigen Fossilfunde ursprünglicher Theria gemacht wurden (nur wenige Zähne und Kieferfragmente wurden entdeckt), so teilen Metatheria und Eutheria dennoch einige Wesensmerkmale, die auf eine gemeinsame anzestrale Tiergruppe schließen lassen:[36]
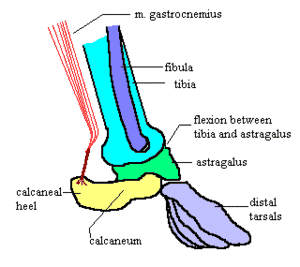
- Sie besitzen keine Interclaviculae.
- Rabenbeine fehlen oder sind mit dem Schulterblatt verschmolzen und bilden Rabenschnabelfortsätze.
- Beim Sprunggelenk liegt das Hauptgelenk zwischen Schienbein und Sprungbein. Das Fersenbein hat keinen Kontakt mit dem Schienbein, es bildet jedoch einen fersenartigen Vorsprung mit Muskelansätzen. (Der andere Sprunggelenkstypus lässt sich gut bei Krokodilen erkennen. Bei ihm liegt das Hauptgelenk zwischen Fersenbein und Sprungbein.)
- Die Molaren sind tribosphenisch.[30]
Tribosphenische Molaren kommen bei Fossilfunden aus Madagaskar vor, die auf ein Alter der Theria von mindestens 167 Millionen Jahren BP schließen lassen.[37]
Metatheria
Die lebenden Metatheria gehören alle zu den Beutelsäugern. Einige fossile Gattungen wie beispielsweise Asiatherium aus der Oberkreide der Mongolei sind entweder Beutelsäuger oder Mitglieder anderer Tiergruppen unter den Metatheria.[38][39]
Der älteste bekannte Beutelsäuger ist Sinodelphys, der in 125 Millionen Jahre alten Schiefertonen aus der Unterkreide im nordöstlichen Liaoning (Volksrepublik China) gefunden wurde. Das Fossil ist nahezu vollständig erhalten und mit Resten des Fells und Gewebeabdrücken versehen.[40]
Die Didelphimorphia (gewöhnliche Opossums der westlichen Hemisphäre) erschienen zum ersten Mal in der Oberkreide und haben noch lebende Nachkommen, der Grund hierfür dürfte in ihrer wenig spezialisierten Lebensweise liegen – sie sind Allesfresser und teils baumbewohnend.[41]
Das wohl am besten bekannte Merkmal der Beutelsäuger ist ihre Fortpflanzungsweise:
- Das Muttertier entwickelt in seinem Unterleib eine Art Dottersack, der den Embryo mit Nährstoffen versorgt. Australische Nasenbeutler, Koalas und Wombats bilden darüber hinaus ein plazentaähnliches Organ aus, das den Keim mit der Gebärmutterwand in Verbindung hält; dieses Organ ist jedoch kleiner als bei den Höheren Säugetieren (eigentlichen Plazentatieren) und es steht noch nicht fest, ob es überhaupt Nährstoffe von der Mutter zum Embryo überträgt.[42]
- Die Schwangerschaft ist sehr kurz, meist zwischen 4 und 5 Wochen. Der Keim kommt in einem sehr frühen Entwicklungsstadium zur Welt und ist gewöhnlich kleiner als 5 Zentimeter. Die kurze Schwangerschaft soll möglicherweise eine einsetzende Immunabwehrreaktion beim Muttertier unterlaufen.
- Das Neugeborene klettert mithilfe seiner relativ gut ausgebildeten Vordergliedmaßen (mit starken Greifhänden) zu einer der Zitzen, die gewöhnlich in einem Beutel am Bauch des Muttertiers verborgen sind. Durch Muskelkontraktionen an ihren Milchdrüsen füttert die Mutter das Neugeborene, das zum eigenständigen Saugen noch zu schwach ist. Dieser Klettervorgang des Neugeborenen soll die Beutelsäuger daran gehindert haben, Schwimmflossen oder Flügel auszubilden – was die Abwesenheit schwimm- oder aktiv flugfähiger Beutelsäuger erklären würde (einige Beutelsäuger beherrschen aber durchaus den Gleitflug).
Auch wenn einige Beutelsäuger Höheren Säugetieren manchmal sehr ähnlich sehen (ein gutes Beispiel ist der Beutelwolf), so unterscheiden sie sich doch in einigen Details ihres Skeletts von den Höheren Säugetieren:[43]
- Manche Beutelsäuger (wie z. B. der Beutelwolf) besitzen vier Molare, kein Höheres Säugetier hat mehr als drei.
- Sämtliche Beutelsäuger haben (neben Nasenöffnungen) paarig angeordnete Gaumenfenster im unteren Abschnitt des Schädels.
Beutelsäuger weisen außerdem paarig angeordnete Beutelknochen auf, welche den Beutel der weiblichen Tiere stützen. Beutelknochen sind jedoch nicht für Beutelsäuger charakteristisch, sie kommen nämlich auch bei Multituberculata, Kloakentieren und sogar einigen Eutheria vor. Beutelknochen dürften ein ursprüngliches Merkmal sein, das nach dem Zeitpunkt verschwunden war, nachdem die Vorfahren heute lebender Höherer Säugetiere sich von den Beutelsäugern abgezweigt hatten.[44] Einige Forscher sind der Ansicht, dass die ursprüngliche Funktion der Beutelknochen in einer Unterstützung der Vorwärtsbewegung liegt, indem sie ein Widerlager für die kontrahierende Muskulatur des Oberschenkels darstellen.[45]
Eutheria
Sämtliche lebenden Eutheria («Echte Tiere») sind Höhere Säugetiere (Plazentatiere). Das mit 125 Millionen Jahren älteste bekannte Eutheriafossil Eomaia, welches in der Volksrepublik China gefunden wurde, trägt aber durchaus noch Merkmalszüge, die den Beutelsäugern (den überlebenden Metatheria) wesentlich näher kommen:[46]
- Vom Becken aus nach vorne gerichtete Beutelknochen. Bei modernen Höheren Säugetieren kommen diese nicht mehr vor, werden aber bei sämtlichen anderen Säugetieren angetroffen – bei den übrigen Eutheria, bei Beutelsäugern, Kloakentieren und Mammaliaformes. Ja selbst bei säugetiernahen Therapsiden wie z. B. den Cynodontia treten sie auf. Aufgabe der Beutelknochen ist eine Stabilisierung des Körpers bei der Fortbewegung.[47] Diese Versteifung wäre bei schwangeren Plazentatieren schädlich, deren Unterleiber sich ausdehnen können müssen.[48]
- Ein enger Beckenausgang. Dies lässt darauf schließen, dass die Jungen bei der Geburt noch sehr klein gewesen sein müssen. Die Schwangerschaft war wahrscheinlich nur von kurzer Dauer. Die Ausbildung einer Plazenta ist folglich ein späterer Evolutionsschritt.
- Fünf Schneidezähne auf jeder Seite des Oberkiefers. Diese Anzahl ist typisch für Metatheria, moderne Säugetiere haben maximal 3 mit Ausnahme der Homodonten wie das Gürteltier. Das Verhältnis der Molaren zu den Prämolaren (Eomaia hat mehr Prämolaren als Molaren) ist wiederum eher typisch für Eutheria (inklusive Plazentatiere) als für Beutelsäuger.
Ferner besaß Eomaia eine Meckelsche Grube, ein ursprüngliches Unterkiefermerkmal, das bei Höheren Säugetieren nicht mehr vorkommt.
Alle diese Übergangsmerkmale stehen im Einklang mit der Molekularphylogenese, deren Abschätzungen die Ausbreitung der Höheren Säugetiere vor rund 110 Millionen Jahren beginnen lässt – 15 Millionen Jahre nach Eomaia.
Mehrere Merkmale in Eomaia, insbesondere an Füßen und Zehen, deuten auf eine kletternde Lebensweise. Beispielsweise waren die Ansatzstellen für die zum Klettern benötigte Muskulatur gut ausgebildet und der Schwanz war doppelt so lang wie die restliche Wirbelsäule.
Am charakteristischsten für Höhere Säugetiere ist ihre Fortpflanzungsweise:
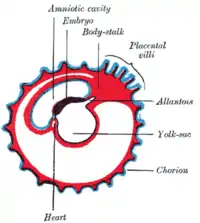
- Der Embryo ist über eine große Plazenta, deren Aufgabe es ist, Nahrung und Sauerstoff zu liefern und Abfallstoffe zu beseitigen, mit der Gebärmutter verbunden.
- Die Schwangerschaft dauert verhältnismäßig lange, so dass die Jungen bei Geburt schon relativ weit entwickelt sind. Bei manchen Arten (insbesondere bei steppenbewohnenden Herbivoren) können die Jungen oft schon eine Stunde nach der Geburt aufstehen und zu laufen beginnen.
Es wurde die Ansicht vertreten, dass der Schritt hin zur Fortpflanzungsweise der Höheren Säugetiere erst durch Retroviren ermöglicht wurde:[50]
- Retroviren gestalten die Grenzschicht zwischen Plazenta und Gebärmutter zu einem Synzytium, d. h. einer dünnen Zelllage mit einer gemeinsamen Außenmembran. Dadurch wird der Durchtritt von Sauerstoff, Nahrung und Abfallprodukten ermöglicht, Blutkörperchen und andere Zellen aber, die eine Aktivierung des Immunsystems der Mutter und einen Angriff auf den Fötus zur Folge hätten, werden gestoppt.
- Retroviren reduzieren die Aggressivität des Immunsystems der Mutter – ein Vorteil für den Fötus, aber durch die erhöhte Infektionsgefahr ein Nachteil für die Mutter.
Von paläontologischer Warte aus lassen sich Eutheria hauptsächlich durch verschiedene Merkmale an Zähnen,[51] Gelenken und Füßen charakterisieren.[52]
Erweiterung der ökologischen Nischen im Mesozoikum
Das stereotype Bild der Säugetiere als «kleine, nachtaktive Insektivoren» hat nach wie vor eine gewisse Berechtigung, aber rezente Funde (hauptsächlich in der Volksrepublik China) zeigen, dass so manche Mammaliaformes und auch einige echte Säugetiere wesentlich größer waren und unterschiedliche Lebensweisen führten. Als Beispiele mögen dienen:
- Castorocauda aus dem Mittleren Jura vor rund 164 Millionen Jahren war 42,5 Zentimeter groß und wog 500 bis 800 Gramm. Seine Gliedmaßen waren zum Schwimmen und Graben geeignet, die Zähne zeigten Anpassungen zum Verzehr von Fischen.[25]
- Multituberculata überlebten mehr als 125 Millionen Jahre (vom Mittleren Jura vor rund 160 Millionen Jahren bis ins Untere Oligozän vor ungefähr 35 Millionen Jahren). Sie werden oft als «Nagetiere des Mesozoikums» bezeichnet, da sie wie die modernen Nagetiere ständig nachwachsende Schneidezähne hatten.[22]

- Fruitafossor aus dem Oberen Jura vor rund 150 Millionen Jahren hatte ungefähr die Größe eines Streifenhörnchens. Bezahnung, Vorderbeine und Rückenpartie deuten auf einen Insektenfresser, der die Nester von Insektenkolonien aufbrach (sehr wahrscheinlich Termiten, Ameisen traten erst später auf).[53]
- Volaticotherium aus der Unterkreide vor rund 125 Millionen Jahren ist das erste zum Gleitflug fähige Säugetier. Seine Flugmembran spannte sich zwischen den Gliedmaßen auf, in etwa vergleichbar mit dem Gleithörnchen. Volaticotherium war sehr wahrscheinlich tagaktiv.[54]
- Repenomamus, ebenfalls aus der Unterkreide vor zirka 130 Millionen Jahren, war ein untersetzter, dachsähnlicher Räuber, der auch auf junge Dinosaurier Jagd machte. Zwei Arten sind bekannt, die eine etwas mehr als einen Meter groß mit einem Gewicht von 12 bis 14 Kilogramm, die andere kleiner als 50 Zentimeter mit einem Gewicht von nur 4 bis 6 Kilogramm.[55][56]
Evolution wichtiger existierender Säugetiergruppen
Gegenwärtig liefern sich traditionelle Paläontologen und Molekulargenetiker Streitgespräche über den Zeitpunkt und die Art der Diversifizierung bei den echten Säugetieren und insbesondere bei den Höheren Säugetieren. Gewöhnlich datieren Paläontologen das Erscheinen einer bestimmten Tiergruppe anhand des ältesten Fossilfundes, welcher alle Charaktermerkmale der in Frage kommenden Tiergruppe besitzt. Molekularphylogenetiker wenden jedoch ein, dass die einzelnen evolutionären Linien sich wesentlich früher trennten und dass die ältesten Vertreter einer bestimmten Tiergruppe den ältesten Vertretern der anderen Tiergruppen anatomisch sehr ähnlich sahen und sich nur im Geninhalt unterschieden. Diese Debatten erstrecken sich auch auf Definitionen und Beziehungen unter den Hauptgruppen der Höheren Säugetiere – als gutes Beispiel hierfür soll die Kontroverse um Afrotheria dienen.
Kladogramm der Höheren Säugetiere
Zur Etablierung eines Kladogramms bedient sich die Molekulargenetik artspezifischer Gene, in etwa vergleichbar mit der in der Paläontologie angewandten Methodik, die auf Charaktermerkmalen von Fossilien beruht: zeigen die Gene zweier Organismen untereinander mehr Übereinstimmung als mit denen eines Dritten, so müssen diese beiden Organismen folglich auch näher miteinander verwandt sein.
Das folgende Kladogramm gibt die innere Systematik der Höheren Säugetiere wieder:[57]
Anmerkung: Das Kladogramm enthält keine ausgestorbenen Zweige, da es nicht möglich ist, aus Fossilien DNS zu extrahieren.
| Höhere Säugetiere (Eutheria) |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Das Kladogramm wartet mit einigen Überraschungen auf:
- Die Hauptunterteilung der echten Säugetiere ist eine Dichotomie aus Afrotheria einerseits und Xenarthra und Boreoeutheria andererseits.
- Die engsten lebenden Verwandten der Elefanten sind die im Wasser lebenden Seekühe und die Schliefer, die mehr Meerschweinchen ähneln.
- Von den Insektenfressern werden zwei Gruppen abgetrennt, die heute zu den Afrotheria gehören, die Tenrekartigen und die Rüsselspringer.
- Die engsten lebenden Verwandten der Cetacea (Wale, Delfine, Schweinswale) sind die Paarhufer, fast alle reine Vegetarier.
- Schwestergruppe der Raubtiere sind die Schuppentiere.
Das Zusammenlegen der Afrotheria hat geografische Rechtfertigungen. Sämtliche rezenten Mitglieder der Afrotheria stammen entweder aus südamerikanischen oder aus größtenteils afrikanischen Evolutionslinien – selbst der Indische Elefant stammt von einer afrikanischen Evolutionslinie ab, die er jedoch vor zirka 7,6 Millionen Jahren verließ.[58] Beim Auseinanderbrechen Pangaeas trennten sich Afrika und Südamerika von den anderen Kontinenten vor weniger als 150 Millionen Jahren, der endgültige Bruch zwischen Afrika und Südamerika erfolgte sogar erst vor 100 bis 80 Millionen Jahren.[59][60] Das älteste bekannte Fossil der Eutheria ist Eomaia, das auf 125 Millionen Jahre BP datiert wurde. Es wäre daher nicht weiter verwunderlich, wenn die ältesten Einwanderer der Eutheria nach Afrika oder Südamerika dort isoliert wurden und sich mittels adaptiver Radiation dort dann in sämtliche verfügbaren ökologischen Nischen ausbreiteten.
Nichtsdestoweniger bleiben diese Vorschläge weiterhin kontrovers. Verständlicherweise bestehen Paläontologen darauf, dass Fossilbelege Vorrang vor Schlussfolgerungen haben, die aus der DNS rezenter Tiergruppen stammen. Selbst Molekularphylogenetiker haben die neuen Kladogramme, zum Teil sehr vehement, unter Verweis auf folgende Punkte angegriffen:[61]
- Die Mutationsrate der aus den Mitochondrien stammenden DNS von Säugetieren verläuft nicht gleichförmig. Gewisse Abschnitte in der Sequenz verändern sich kaum, wohingegen andere Regionen extrem schnellen Veränderungen ausgesetzt sind. Selbst zwischen Mitgliedern derselben Art können durchaus Unterschiede auftreten.[62][63]
- DNS aus den Mitochondrien von Säugetieren kann derart rasch mutieren, dass es zu dem Problem der «Sättigung» kommt und statistisches Hintergrundrauschen eventuell vorhandene Informationen überdeckt. Angenommen ein bestimmtes Segment der DNS aus den Mitochondrien mutiert wahllos alle paar Millionen Jahre, dann hat es seit dem Aufspalten der evolutionären Hauptlinien unter den Säugetieren vor 60 bis 75 Millionen Jahren bereits zahllose Veränderungen erfahren.[64]
Altersbestimmung der Evolutionsschritte Höherer Säugetiere
Neue molekularphylogenetische Studien kommen zu dem Ergebnis, dass sich die meisten Säugetierordnungen vor rund 100 bis 85 Millionen Jahren BP auseinanderentwickelten, die ersten rezenten Familien aber wesentlich später im Oberen Eozän und im Unteren Miozän erschienen.[65]
Einige Paläontologen geben zu denken, dass bisher noch keine fossilen Höheren Säugetiere gefunden wurden, die älter als die K-T-Grenze sind. Der 75 Millionen Jahre alte Maelestes gobiensis gehört zwar zu den Eutheria, ist aber noch kein Höheres Säugetier.[66] Viele kreidezeitlichen Fossilfundstellen führen gut erhaltene Eidechsen, Salamander, Vögel und Säugetiere aber keine Höheren Säugetiere. Es ist gut möglich, dass es sie zu diesem Zeitpunkt einfach noch nicht gab oder dass bei größeren entwicklungsgeschichtlichen Radiationen die molekulare Uhr schneller zu laufen beginnt.[67] Dennoch sind fossile Überreste von 85 Millionen Jahre alten Huftieren bekannt, die möglicherweise die Vorfahren der rezenten Ungulata darstellen.[68]
Die frühesten Fossilien von Vertretern moderner Säugetiergruppen gehen meist auf das Paläozän zurück, einige sind etwas jünger und nur ganz wenige reichen zurück in die Kreide, also noch vor das Verschwinden der Dinosaurier. Einige durch molekularphylogenetische Arbeiten beeinflusste Paläontologen haben sich statistischer Methoden bedient, um von Fossilfunden moderner Gruppierungen aus in die Vergangenheit zurückzuinterpolieren, und sind beispielsweise zu dem Ergebnis gekommen, dass die Gruppe der Primaten in der Oberkreide entstanden ist.[69] Statistische Untersuchungen des Fossilberichts bestätigen aber, dass die Säugetiere in Größe und Diversität bis hin zum Ende der Kreide starken Restriktionen unterlagen und erst im Unteren Paläozän schnell größer wurden und dass gleichzeitig ihre Artenvielfalt rapide zunahm.[70][71]
Evolution der Säugetiermerkmale
Die Säugetiere verfügen über eine Reihe evolutionärer Innovationen, die ihre namengebende Eigenschaft erst ermöglichen. Dazu gehörten hauptsächlich die mehr oder weniger parallele Evolution der Plazenta, der Muttermilch, der Milchdrüse und der Mutter-Kind-Beziehung.
Plazenta
Die Plazenta ist eine Schlüsselinnovation und damit Evolutionssprung der Säugetiere, von ihren Anfängen bis heute. Sie stellt ein neues Organ dar, das es bei den eierlegenden Tieren davor nicht gab. Neben anderen Innovation musste eine Ernährungsverbindung vom Ei des Embryos im Mutterleib zur Mutter evolvieren, um das Wachstum des Embryos im Mutterleib zu ermöglichen. Dieses Wachstum war ein entscheidender selektiver Vorteil. Die Plazenta steigerte die Überlebenschancen des Ungeborenen in der Zeit der Dinosaurier vor etwa 160 Millionen Jahren. Der früheste bekannte Vertreter der Plazentatiere aus dieser Zeit war Juramaia sinensis.
Als wichtiges Gen für die Ausbildung der Plazenta wurde das Gen Retrotransposon-derived protein oder paternally expressed gene (Peg10) identifiziert. Dieses Gen wurde wahrscheinlich durch ein Retrovirus in die DNS der Keimzellen früher Säuger kodiert,[72] eine virale Invasion und ein Prozess vergleichbar dem, der beim rezenten Koala mit dem krankheitserregenden Gen KORV beobachtet wurde. Das Knockout von Peg10 bei der Maus im Labor führt zum Stillstand des Wachstums der Plazenta und zum frühen Tod des Embryos.[73]
Peg10 ist also dafür verantwortlich, die Plazenta zu bilden. Das Gen unterbindet die Immunabwehr der Mutter und verhindert damit, dass der Embryo beim Aufbau der physischen Mutter-Kind-Verbindung wieder abgestoßen wird. Erst für den weiteren Verlauf der Evolution wird angenommen, dass die Nahrungsversorgung des Embryos mittels der Plazenta zum Immunabwehrschutz hinzukam. Im Verlauf der Evolution wurde die Plazenta größer, die Tragezeit des Embryos konnte verlängert werden. Eine längere Schwangerschaft war hilfreich für die Unabhängigkeit der Mutter vor Fressfeinden, und Tiere begannen, lebende Säuger auszutragen.
Milchabsonderung (Laktation)
Die ursprüngliche Aufgabe der Milchabsonderung bestand einerseits im Feuchthalten des Geleges bei Kloakentieren (Eier legenden Säugetieren), andererseits in der bakterientötenden Schutzfunktion der Milch. Für die Funktion des Feuchthaltens spricht:[74][75][76]
- Kloakentiere besitzen keine Zitzen, die Milch wird mittels Drüsen an einer behaarten Stelle an ihrem Bauch abgesondert.
- Während der Brutzeit werden die Eier von einer klebrigen Substanz bedeckt, deren Herkunft unbekannt ist. Vor dem Legen bestehen die Eierschalen aus einer dreilagigen Schicht. Danach tritt eine vierte Lage von unterschiedlicher Zusammensetzung hinzu. Möglicherweise werden die klebrige Substanz und die vierte Eierlage von den Milchdrüsen erzeugt.
- Sollte dies der Fall sein, dann ließe sich die Behaarung der milchabsondernden Region erklären: es dürfte leichter fallen, feuchte Substanzen über das Ei von einer breiten, behaarten Stelle aus zu verteilen als von einer kleinen, nackten Zitze.
Für die Schutzfunktion der Milchabsonderung, noch bevor evolutionär die Funktion der Ernährung auftrat, spricht die Entdeckung des Proteins Lysozym als Bestandteil der Milch.[77] Lysozym hat eine bakterienabtötende Wirkung. Der Embryo nimmt das Protein außerhalb des Mutterleibs zu sich und wird dadurch geschützt. Für diese These spricht die fast identische Molekularstruktur von Lysozym und Lactalbumin, einem entscheidenden Protein der Muttermilch, das für die Biosynthese von Milchzucker verantwortlich ist. Es wird demnach angenommen, dass es einfach war, dass Lysozym evolutionär in Lactalbumin umgebaut wurde und so auch die wichtige Ernährungsfunktion der Milch ermöglicht wurde.
Kiefer und Mittelohr
Hadrocodium, dessen Fossilien aus dem Unteren Jura stammen, liefert den ersten eindeutigen Beweis für ein voll ausgebildetes säugertypisches Kiefergelenk mit Dentale und Squamosum und einem säugertypischen Mittelohr, bei welchem Articulare und Quadratum aus dem Kiefer abgewandert waren und dort zum Amboss und Hammer umgeformt wurden. Seltsamerweise wird Hadrocodium dennoch als Mitglied der Mammaliaformes angesehen und nicht als ein echtes Säugetier.
Eine Untersuchung des Kloakentiers Teinolophos kam zu dem Schluss, dass sein Kiefergelenk bestehend aus Angulare und Quadratum eine Vorstufe zum Säugetierkiefergelenk war und dass sich das für Säugetiere typische Mittelohr in Kloakentieren und in Säugetieren gleich zweimal unabhängig voneinander entwickelt hat. Diese Ansicht wird jedoch in Frage gestellt.[78] In einer Folgestudie wurden dieselben Fakten dahin interpretiert, dass Teinolophos ein richtiger Schnabeligel gewesen sein soll mit säugertypischem Kiefergelenk und Mittelohr.[33]
Haare und Fell
Der erste eindeutige Befund von Behaarung oder einem Fell stammt von dem 164 Millionen Jahre alten Fossil Castorocauda aus dem mittleren Jura.
Bereits seit 1955 interpretieren einige Wissenschaftler bei Cynodontiern die Durchtrittsstellen (Foramina) im Oberkiefer und in der Prämaxillare als Kanäle für Blutgefäße und Nervenbahnen, die mit Vibrissen (Schnurrhaaren) in Verbindung standen. Sie sehen darin den Nachweis für Haare bzw. Fell.[79][80] Das Vorhandensein von Foramina lässt aber nicht automatisch auf Schnurrhaare rückschließen – bestes Gegenbeispiel ist die rezente Schienenechse Tupinambis, deren Foramina nahezu identisch mit den Foramina des nichtsäugetierartigen Cynodontiers Thrinaxodon sind, die jedoch keine Schnurrhaare besitzt.[8][81]
Aufrechte Gliedmaßen
Die Entwicklung zu aufrechten Gliedmaßen ist bei Säugetieren noch nicht abgeschlossen, da fossile und rezente Kloakentiere gebeugte Extremitäten haben. Manche Wissenschaftler sind sogar der Meinung, dass die parasagittale (nichtgebeugte) Postur eine Synapomorphie (charakteristisches Merkmal) bei den Boreosphenida (diese Gruppe enthält die Theria und somit den letzten gemeinsamen Vorfahren der rezenten Beutelsäuger und Höheren Säugetiere) darstellt und dass folglich sämtliche älteren Säugetiere ebenfalls gebeugte Gliedmaßen besaßen.[82]
Sinodelphys (der erste bekannte Beutelsäuger) und Eomaia (das älteste Eutheria) lebten vor rund 125 Millionen Jahren, die Entwicklung zu aufrechten Gliedmaßen muss also bereits zuvor eingesetzt haben.
Wärmehaushalt
Der Begriff «Warmblütigkeit» ist mehrdeutig, er sollte vielmehr in folgende konkretere Unterbegriffe unterteilt werden:
- Endothermie oder die Fähigkeit eines Organismus, intern Wärme durch Stoffwechselaktivität zu erzeugen, ohne dabei auf externe Quellen (wie beispielsweise Sonnenbaden) oder Muskelbewegungen (Mikrovibration) angewiesen zu sein.
- Homoiothermie oder die Fähigkeit, eine konstante Körpertemperatur aufrechtzuerhalten (siehe auch Gleichwarmes Tier).
- Tachymetabolismus oder die Fähigkeit, in Ruhephasen einen hohen Stoffwechselumsatz zu gewährleisten. Dies bedingt eine recht hohe und stabile Körpertemperatur, da biochemische Prozesse bereits bei einem Absinken der Körpertemperatur um 10 °C nur noch halb so schnell ablaufen. Die meisten Enzyme sind nur in einem optimalen Temperaturbereich reaktionsfähig, außerhalb dessen ihre Effizienz rapide absinkt.
Da wir bei ausgestorbenen Tiergruppen nichts oder nur sehr wenig über interne Prozesse wissen, können in der Diskussion um den Wärmehaushalt nur Homoiothermie und Tachymetabolismus berücksichtigt werden.
Rezente Kloakentiere besitzen eine etwas niedrigere Körpertemperatur als Beutelsäuger und Höhere Säugetiere, ihre Stoffwechselaktivität ist außerdem größeren Schwankungen ausgesetzt.[83] Es stellt sich daher die Frage, wann sich bei den Säugetieren dieser kloakentierartige Stoffwechsel etabliert hatte. Dass selbst Cynodontier bereits einen ziemlich hohen Stoffwechselumsatz besaßen, ist aber noch umstritten.
Nasenmuscheln
Rezente Säugetiergruppen besitzen Nasenmuscheln, verdrehte, aus dünnen Knochen aufgebaute Strukturen in der Nasenhöhle. Sie sind von einer Schleimhaut überzogen, deren Aufgabe es ist, eingeatmete Luft zu erwärmen und anzufeuchten und im Gegenzug aus der ausgeatmeten Luft Wärme und Feuchtigkeit wieder zu entziehen. Tiere mit Nasenmuscheln können eine erhöhte Atemtätigkeit aufrechterhalten, ohne Gefahr laufen zu müssen, dass ihre Lungen austrocknen. Sie können folglich auch einen hohen Stoffwechselumsatz erzielen. Nasenmuschelknochen sind sehr zerbrechlich und werden selbst nicht fossil erhalten. Rudimentäre Leisten- und Stützknochen der Nasenmuscheln wurden jedoch bei triassischen Therapsiden wie z. B. Thrinaxodon und Diademodon entdeckt, ihr Stoffwechselumsatz dürfte daher schon erhöht gewesen sein.[79][84][85]
Verknöcherter sekundärer Gaumen
Säugetiere haben einen verknöcherten sekundären Gaumen, der die Atemwege vom Mundraum trennt, sie können daher gleichzeitig fressen und atmen. Sekundäre verknöcherte Gaumen werden schon bei den fortgeschritteneren Cynodontiern angetroffen und sind ebenfalls als Indiz für einen erhöhten Stoffwechselumsatz interpretiert worden.[79][80][86] Aber einige wechselwarme Wirbeltiere wie beispielsweise Krokodile und manche Echsen sind ebenfalls mit sekundären verknöcherten Gaumen ausgestattet. Die gleichwarmen Vögel besitzen sie aber nicht.[8]
Zwerchfell
Ein muskulöses Zwerchfell unterstützt die Säugetiere bei ihrer Atmung, insbesondere während anstrengender körperlicher Tätigkeiten. Es kann nur sinnvoll arbeiten, wenn der Unterleib frei von behindernden Rippen bleibt und somit das blasebalgartige Wechselspiel zwischen Brustkorb und Unterleib voll zur Entfaltung kommen kann. Fortgeschrittene Cynodontier hatten bereits einen sehr säugetierähnlichen Brustkorb mit stark reduzierten Lendenwirbeln. Daraus folgt, dass diese Tiere ein Zwerchfell besaßen, körperliche Anstrengungen über einen längeren Zeitraum aufrechterhalten konnten und folglich auch einen erhöhten Stoffwechselumsatz hatten.[79][80] Möglicherweise hat der säugetierartige Brustkorb gleichzeitig eine größere Beweglichkeit mit sich gebracht.[8] Die Fortbewegungsweise selbst fortgeschrittener Therapsiden dürfte dennoch «schubkarrenartig» erfolgt sein, wobei die Hinterbeine den gesamten Vorschub leisteten und die Vorderbeine nur eine Steuerfunktion ausübten. Fortgeschrittene Therapsiden dürften daher weit weniger agil gewesen sein als rezente Säugetiere oder selbst frühe Dinosaurier.[87] Dass die Hauptfunktion des säugetierartigen Brustkorbes in einer Erhöhung der Agilität lag, ist somit anzuzweifeln.
Stellung der Gliedmaßen
Die Therapsiden hatten gebeugte Vorderbeine und halbaufrechte Hinterbeine.[80][88] Dies bedeutet, dass es ihnen wegen der Carrier-Restriktion relativ schwergefallen sein dürfte, während der Fortbewegung zu atmen. Noch schwerer tun sich die Echsen, deren Gliedmaßen vollends durchgebeugt sind und die nach körperlichen Anstrengungen zu längeren Ruhepausen gezwungen sind.[89] Die Cynodontier trugen Rippenplatten zur Versteifung des Brustkorbes, wodurch möglicherweise ein seitliches Verbiegen des Rumpfes während der Fortbewegung eingeschränkt wurde und ihnen das Atmen dadurch eventuell etwas leichter fiel.[90] Alles deutet darauf hin, dass fortgeschrittene Therapsiden in ihrer Bewegungsfreiheit wesentlich eingeschränkter waren als rezente Säugetiergruppen vergleichbarer Größenordnung und dass auch ihr Stoffwechsel wesentlich langsamer ablief.
Wärmedämmung (Haare und Fell)
Wärmedämmung ist die einfachste Lösung, um eine einigermaßen konstante Körpertemperatur zu gewährleisten. Haare und Fell sind ein gutes Indiz für Homoiothermie, weniger jedoch für eine hohe Stoffwechselrate.[91][92]
Der erste fossile Nachweis von Haaren oder Fell stammt von dem 164 Millionen Jahre alten Castorocauda aus dem Mittleren Jura.[25] Hinweise auf Behaarung bei fortgeschrittenen Therapsiden sind nicht stichhaltig.
Siehe auch
- Säugetiere – Systematik und Entwicklungsgeschichte
- Therapsiden
- Synapsiden
Quellen
- Robert L. Carroll: Vertebrate Paleontology and Evolution. W. H. Freeman and Company, New York 1988, ISBN 0-7167-1822-7, Kapitel XVII bis XXI
- Nicholas Hotton III, Paul D. MacLean, Jan J. Roth, E. Carol Roth (Hrsg.): The Ecology and Biology of Mammal-like Reptiles. Smithsonian Institution Press, Washington/ London 1986, ISBN 0-87474-524-1.
- T. S. Kemp: The Origin and Evolution of Mammals. Oxford University Press, New York 2005, ISBN 0-19-850760-7.
- Zofia Kielan-Jaworowska, Richard L. Cifelli, Zhe-Xi Luo: Mammals from the Age of Dinosaurs: Origins, Evolution, and Structure. Columbia University Press, New York 2004, ISBN 0-231-11918-6. (Umfassende Darstellung von den ersten Säugetieren bis zum Massenaussterben an der K-T-Grenze)
- Zhe-Xi Luo: Transformation and diversification in early mammal evolution. In: Nature. volume 450, number 7172, 13. Dezember 2007, S. 1011–1019. doi:10.1038/nature06277. (Eine Rundschau mit 98 Einzelnachweisen zu wissenschaftlicher Literatur)
Weblinks
- The Cynodontia behandelt verschiedene Aspekte des entwicklungsgeschichtlichen Übergangs Cynodontier/Säugetiere – mit vielen Einzelnachweisen.
- Springer Link: Relationships of the Liassic Mammals Sinoconodon, Morganucodon oehleri, and Dinnetherium
Einzelnachweise
- Amniota - Palaeos. Abgerufen am 27. Dezember 2010.
- Synapsida overview - Palaeos. (Memento vom 15. März 2008 im Internet Archive)
- Mammalia: Overview - Palaeos
- R. Cowen: History of Life. Blackwell Science, Oxford 2000, S. 432.
- Synapsida: Varanopseidae - Palaeos. Abgerufen am 27. Dezember 2010.
- Therapsida - Palaeos. Abgerufen am 28. August 2013.
- D. M. Kermack, K. A. Kermack: The evolution of mammalian characters. Croom Helm, 1984, ISBN 0-916845-01-X.
- A. F. Bennett, J. A. Ruben: The metabolic and thermoregulatory status of therapsids. In: N. Hotton, P. D. MacLean, J. J. Roth u. a.: The ecology and biology of mammal-like reptiles. Smithsonian Institution Press, Washington 1986, S. 207–218.
- Dinocephalia - Palaeos. Abgerufen am 28. August 2013.
- Neotherapsida – Palaeos. Abgerufen am 29. August 2013.
- Theriodontia - Paleos. Abgerufen am 29. August 2013.
- Cynodontia Overview - Palaeos. Abgerufen am 25. August 2013.
- G. H. Groenewald, J. Welman, J. A. MacEachern: Vertebrate Burrow Complexes from the Early Triassic Cynognathus Zone (Driekoppen Formation, Beaufort Group) of the Karoo Basin, South Africa. In: Palaios. Band 16, Nr. 2, April 2001, S. 148–160, doi:10.1669/0883-1351(2001)016<0148:VBCFTE>2.0.CO;2 (sepmonline.org [abgerufen am 7. Juli 2008]).
- Olenekian Age of the Triassic - Palaeos. Abgerufen am 28. August 2013.
- The Triassic Period - Palaeos. Archiviert vom Original am 4. Januar 2010; abgerufen am 28. August 2013.
- J. A. Ruben, T. D. Jones: Selective Factors Associated with the Origin of Fur and Feathers. In: American Zoologist. Band 40, Nr. 4, 2000, S. 585–596, doi:10.1093/icb/40.4.585 (oxfordjournals.org).
- M. E. Raichle, D. A. Gusnard: Appraising the brain's energy budget. In: PNAS. Band 99, Nr. 16, 6. August 2002, S. 10237–10239, doi:10.1073/pnas.172399499 (pnas.org).
- Brain power. In: New Scientist. 2006, abgerufen am 27. Dezember 2010.
- J. Travis: Visionary research: scientists delve into the evolution of color vision in primates. In: Science News. Band 164, Nr. 15, Oktober 2003 (findarticles.com).
- R. L. Cifelli: Early mammalian radiations. In: Journal of Paleontology. Band 75, November 2001, S. 1214, doi:10.1666/0022-3360(2001)075<1214:EMR>2.0.CO;2 (findarticles.com).
- Z.-X. Luo: Transformation and diversification in early mammal evolution. In: Nature. Band 450, Nr. 7172, 2007, S. 1011–1019, doi:10.1038/nature06277.
- Mammaliformes - Palaeos. Abgerufen am 25. August 2013.
- Mammaliformes (englisch) palaeos.com. Archiviert vom Original am 8. Februar 2007. Abgerufen am 2. April 2019.
- Morganucodontids & Docodonts - Palaeos. Abgerufen am 30. August 2013.
- Q. Ji, Z.-X. Luo, C.-X. Yuan, A. R. Tabrum: A Swimming Mammaliaform from the Middle Jurassic and Ecomorphological Diversification of Early Mammals. In: Science. Band 311, Nr. 5764, Februar 2006, S. 1123, doi:10.1126/science.1123026, PMID 16497926 (sciencemag.org). Siehe auch die Nachrichtenüberschrift Jurassic "Beaver" Found; Rewrites History of Mammals. Abgerufen am 27. Dezember 2010.
- Symmetrodonta - Palaeos. Abgerufen am 30. August 2013.
- Z.-X. Luo, A. W. Crompton, A.-L. Sun: A New Mammaliaform from the Early Jurassic and Evolution of Mammalian Characteristics. In: Science. Band 292, Nr. 5521, Mai 2001, S. 1535–1540, doi:10.1126/science.1058476 (sciencemag.org [abgerufen am 8. September 2008]).
- Mammalia: Overview (englisch) palaeos.com. Abgerufen am 2. April 2019.
- Mammalia - Palaeos. Abgerufen am 25. August 2013.
- L. L. Jacobs, D. A. Winkler, P. A. Murry: Modern Mammal Origins: Evolutionary Grades in the Early Cretaceous of North America. In: Proceedings of the National Academy of Sciences of the USA. Band 86, Nr. 13, 1. Juli 1989, S. 4992–4995, doi:10.1073/pnas.86.13.4992 (jstor.org).
- Die Karte aus der Oberkreide bei scotese.com zeigt sehr anschaulich die Trennung der Südkontinente.
- O. W. M. Rauhut, T. Martin, E. Ortiz-Jaureguizar, P. Puerta: A Jurassic mammal from South America. In: Nature. Band 416, 14. März 2002, S. 165–168, doi:10.1038/416165a (nature.com).
- T. Rowe, T. H. Rich, P. Vickers-Rich, M. Springer, M. O. Woodburne: The oldest platypus and its bearing on divergence timing of the platypus and echidna clades. In: Proceedings of the National Academy of Sciences. Band 105, Nr. 4, Januar 2008, S. 1238–1242, doi:10.1073/pnas.0706385105 (pnas.org).
- Zeichnung der anatomischen Verhältnisse der Reproduktionsorgane bei Monotremata nach David Peters: From the Beginning: The Story of Human Evolution. William Morrow & Co (1876)
- Zum Vergleich die Zeichnung der anatomischen Verhältnisse der Reproduktionsorgane bei Marsupialia und den Placentalia.
- Mammalia: Spalacotheroidea & Cladotheria - Palaeos. Abgerufen am 29. August 2013.
- J. J. Flynn, J. M. Parrish, B. Rakotosamimanana, W. F. Simpson, A. R. Wyss: A Middle Jurassic mammal from Madagascar. In: Nature. Band 401, September 1999, S. 57–60, doi:10.1038/43420 (nature.com [abgerufen am 8. September 2008]).
- Metatheria - Palaeos. Abgerufen am 30. August 2013.
- F. S. Szalay, B. A. Trofimov: The Mongolian Late Cretaceous Asiatherium, and the early phylogeny and paleobiogeography of Metatheria. In: Journal of Vertebrate Paleontology. 16 (3), 1996, S. 474–509.
- Oldest Marsupial Fossil Found in China. In: National Geographic News. 15. Dezember 2003, abgerufen am 27. Dezember 2010.
- Didelphimorphia - Palaeos. Abgerufen am 30. August 2012.
- Family Peramelidae (bandicoots and echymiperas). Abgerufen am 27. Dezember 2010.
- Species is as species does... Part II. Abgerufen am 27. Dezember 2010.
- M. J. Novacek, G. W. Rougier, J. R. Wible, M. C. McKenna, D. Dashzeveg, I. Horovitz: Epipubic bones in eutherian mammals from the late Cretaceous of Mongolia. In: Nature. 389 (6650), 1997, S. 440–441. doi:10.1038/39020
- T. D. White: An analysis of epipubic bone function in mammals using scaling theory. In: Journal of Theoretical Biology. Band 139, Nr. 3, 9. August 1989, S. 343–357, doi:10.1016/S0022-5193(89)80213-9 (ncbi.nlm.nih.gov).
- Eomaia scansoria: discovery of oldest known placental mammal. Abgerufen am 27. Dezember 2010.
- S. M. Reilly, T. D. White: Hypaxial Motor Patterns and the Function of Epipubic Bones in Primitive Mammals. In: Science. Band 299, Nr. 5605, Januar 2003, S. 400–402, doi:10.1126/science.1074905 (sciencemag.org [abgerufen am 24. September 2008]).
- M. J. Novacek, G. W. Rougier, J. R. Wible, M. C. McKenna, D. Dashzeveg, I. Horovitz: Epipubic bones in eutherian mammals from the Late Cretaceous of Mongolia. In: Nature. Band 389, Oktober 1997, S. 483–486, doi:10.1038/39020 (nature.com [abgerufen am 24. September 2008]).
- Während bei den höheren Säugetieren die Chorionzotten sich in die Gebärmutterschleimhaut (Dezidua als Teil der „Archimetra“) einsenken und so den fetalen Teil der Plazenta bilden, über die der Stoff- und Gasaustausch zwischen kindlichem und mütterlichen Organismus erfolgt.
- D. Fox: Why we don't lay eggs. In: New Scientist. 1999. (online)
- Eutheria - Palaeos (Memento vom 11. September 2010 im Webarchiv archive.today)
- Q. Ji, Z.-X. Luo, C.-X. Yuan, J. R. Wible, J.-P. Zhang, J. A. Georgi: The earliest known eutherian mammal. In: Nature. Band 416, April 2002, S. 816–822, doi:10.1038/416816a (nature.com [abgerufen am 24. September 2008]).
- Z.-X. Luo, J.R. Wible: A Late Jurassic Digging Mammal and Early Mammal Diversification. In: Science. Band 308, 2005, S. 103–107, doi:10.1126/science.1108875.
- J. Meng, Y. Hu, Y. Wang, X. Wang, C. Li: A Mesozoic gliding mammal from northeastern China. In: Nature. Band 444, Nr. 7121, Dezember 2006, S. 889–893, doi:10.1038/nature05234 (nature.com).
- J. Li, Y. Wang, Y. Wang, C. Li: A new family of primitive mammal from the Mesozoic of western Liaoning, China. In: Chinese Science Bulletin. Band 46, Nr. 9, 2000, S. 782–785. abstract, in English
- Y. Hu, J. Meng, Y. Wang, C. Li: Large Mesozoic mammals fed on young dinosaurs. In: Nature. Band 433, 2005, S. 149–152, doi:10.1038/nature03102 (nature.com).
- Thomas S. Kemp: The Origin & Evolution of Mammals. Oxford University Press, Oxford 2005, ISBN 0-19-850761-5, S. 276.
- Scientists map elephant evolution. Abgerufen am 11. August 2008.
- Historical perspective (the Dynamic Earth, USGS)
- Cretaceous map
- Insectivora and Molecular phylogeny
- M. S. Springer, E. Douzery: Secondary Structure and patterns of evolution among mammalian mitochondrial 12S rRNA molecules. In: J. Mol. Evol. Band 43, 1996, S. 357–373, doi:10.1007/BF02339010.
- M. S. Springer, L. J. Hollar, A. Burk: Compensatory substitutions and the evolution of the mitochondrial 12S rRNA gene in mammals. In: Mol. Biol. Evol. Band 12, 1995, S. 1138–1150.
- W.-H. Li: Molecular Evolution. Sinauer Associates, 1997.
- O. R. P. Bininda-Emonds, M. Cardillo, K. E. Jones u. a.: The delayed rise of present-day mammals. In: Nature. Band 446, Nr. 446, 2007, S. 507–511, doi:10.1038/nature05634 (scienceblogs.com). The delayed rise of present-day mammals (Memento vom 25. Januar 2008 im Internet Archive)
- Dinosaur Extinction Spurred Rise of Modern Mammals
- M.J. Benton: Early origins of modern birds and mammals: molecules vs. morphology. In: BioEssays. Band 21, Dezember 1999, S. 1043–1051, doi:10.1002/(SICI)1521-1878(199912)22:1<1043::AID-BIES8>3.0.CO;2-B.
- J. D. Archibald: Fossil Evidence for a Late Cretaceous Origin of "Hoofed" Mammals. In: Science. Band 272, Nr. 5265, Mai 1996, S. 1150–1153, doi:10.1126/science.272.5265.1150 (sciencemag.org [abgerufen am 8. September 2008]).
- R. D. Martin, C. Soligo, S. Tavaré: Primate Origins: Implications of a Cretaceous Ancestry. In: Folia Primatologica. Band 78, Nr. 78, 2007, S. 277–296, doi:10.1159/000105145 (karger.com [PDF]). — Ein ähnliches Papier derselben Autoren ist kostenlos im Netz verfügbar: New light on the dates of primate origins and divergence. (Memento vom 6. Januar 2005 im Internet Archive)
- J. Alroy: The fossil record of North American mammals: evidence for a Paleocene evolutionary radiation. In: Systematic biology. Band 48, Nr. 1, März 1999, S. 107–118, doi:10.1080/106351599260472, PMID 12078635.
- J. D. Archibald, D. H. Deutschman: Quantitative Analysis of the Timing of the Origin and Diversification of Extant Placental Orders. In: Journal of Mammalian Evolution. Band 8, Nr. 2, Juni 2001, S. 107–124, doi:10.1023/A:1011317930838 (online (Memento vom 13. April 2013 im Webarchiv archive.today) [abgerufen am 24. September 2008]).
- Ryuichi Onoa, Shin Kobayashi, Hirotaka Wagatsuma, Kohzo Aisaka, Takashi Kohda, Tomoko Kaneko-Ishino, Fumitoshi Ishino. A Retrotransposon-Derived Gene, Peg10, Is a Novel Imprinted Gene Located on Human Chromosome 7q21. Genomics. Volume 73, Issue 2, 15 April 2001, Pages 232–237
- Ryuichi Ono, Kenji Nakamura, Kimiko Inoue, Mie Naruse, Takako Usami, Noriko Wakisaka-Saito, Toshiaki Hino, Rika Suzuki-Migishima, Narumi Ogonuki, Hiromi Miki, Takashi Kohda, Atsuo Ogura, Minesuke Yokoyama, Tomoko Kaneko-Ishino & Fumitoshi Ishino. Deletion of Peg10, an imprinted gene acquired from a retrotransposon, causes early embryonic lethality. Nature Genetics 38, 101 - 106 (2006)
- O. T. Oftedal: The mammary gland and its origin during synapsid evolution. In: Journal of Mammary Gland Biology and Neoplasia. Band 7, Nr. 3, 2002, S. 225–252, doi:10.1023/A:1022896515287.
- O. T. Oftedal: The origin of lactation as a water source for parchment-shelled eggs. In: Journal of Mammary Gland Biology and Neoplasia. Band 7, Nr. 3, 2002, S. 253–266.
- Lactating on Eggs. (Memento vom 7. Juni 2011 im Webarchiv archive.today)
- O. T. Oftedal. The evolution of milk secretion and its ancient origins : an international journal of animal bioscience. Animal 2012 v.6 no.3 pp. 355-368pp. 14
- T. H. Rich, J. A. Hopson, A. M. Musser, T. G. Flannery, P. Vickers-Rich: Independent Origins of Middle Ear Bones in Monotremes and Therians. In: Science. Band 307, Nr. 5711, 11. Februar 2005, S. 910–914, doi:10.1126/science.1105717 (sciencemag.org). Für andere Meinungen siehe die auf derselben Internetseite verzeichneten "Technical comments".
- A. S. Brink: A study on the skeleton of Diademodon. In: Palaeontologia Africana. Band 3, 1955, S. 3–39.
- T. S. Kemp: Mammal-like reptiles and the origin of mammals. Academic Press, London 1982, S. 363.
- R. Estes: Cranial anatomy of the cynodont reptile Thrinaxodon liorhinus. In: Bulletin of the Museum of Comparative Zoology. Nr. 1253, 1961, S. 165–180.
- Z. Kielan-Jaworowska, J. H. Hurum: Limb posture in early mammals: Sprawling or parasagittal. In: Acta Palaeontologica Polonica. Band 51, Nr. 3, 2006, S. 10237–10239 (pan.pl [PDF; abgerufen am 24. September 2008]).
- G. S. Paul: Predatory Dinosaurs of the World. Simon and Schuster, New York 1988, S. 464.
- W. H. Hillenius: The evolution of nasal turbinates and mammalian endothermy. In: Paleobiology. Band 18, Nr. 1, 1992, S. 17–29.
- J. Ruben: The evolution of endothermy in mammals and birds: from physiology to fossils. In: Annual Review of Physiology. Band 57, 1995, S. 69–95, doi:10.1146/annurev.ph.57.030195.000441.
- B. K. McNab: The evolution of endothermy in the phylogeny of mammals. In: American Naturalist. Band 112, 1978, S. 1–21, doi:10.1086/283249.
- R. Cowen: History of Life. Blackwell Science, Oxford 2000, S. 432.
- F. A. Jenkins Jr: The postcranial skeleton of African cynodonts. In: Bulletin of the Peabody Museum of Natural History. Nr. 36, 1971, S. 1–216.
- F. H. Pough, J. B. Heiser, W. N. McFarland: Vertebrate Life. Prentice-Hall, New Jersey 1996, S. 798.
- C. A. Sidor, J. A. Hopson: Ghost lineages and "mammalness": assessing the temporal pattern of character acquisition in the Synapsida. In: Paleobiology. Nr. 24, 1998, S. 254–273.
- K. Schmidt-Nielsen: Animal physiology: Adaptation and environment. Cambridge University Press, Cambridge 1975, S. 699.
- P. C. Withers: Comparative Animal Physiology. Saunders College, Fort Worth 1992, S. 949.