Dapagliflozin
Dapagliflozin ist ein oral zu applizierendes Antidiabetikum zur Behandlung des Typ-2-Diabetes. Dapagliflozin wurde von dem US-amerikanischen Pharmaunternehmen Bristol-Myers Squibb in Partnerschaft mit dem schwedisch-britischen Pharmaunternehmen AstraZeneca entwickelt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
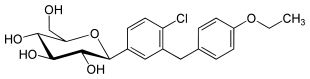 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dapagliflozin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C21H25ClO6 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 408,87 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkmechanismus
Dapagliflozin ist ein selektiver SGLT-2-Hemmer (sodium dependent glucose transporter). SGLT2 ist ein Protein, das im proximalen Tubulus der Niere Natrium und Glucose aus dem Primärharn resorbiert und damit für den größten Teil der Glucose-Resorption der Niere verantwortlich ist. Die Hemmung des SGLT2 bewirkt bei bestehender Hyperglykämie eine verstärkte Ausscheidung von Glucose über den Urin, und diese Glucosurie unterstützt in geringem Ausmaß eine Gewichtsabnahme. Im Gegensatz zu seinen Vorgängern in der Gruppe der SGLT-2-Inhibitoren, den O-Glykosiden, ist Dapagliflozin gegenüber β-Glykosidasen stabil und hat somit eine längere Plasmahalbwertszeit.
In den bisherigen Studien traten bei mit Dapagliflozin behandelten Patienten im Vergleich zu Placebo signifikant häufiger Infektionen des Genitalbereiches sowie – mit einem schwächeren Effekt – der Harnwege auf. Es fand sich eine nicht signifikant erhöhte Anzahl von malignen Blasen- und Brusttumoren in den Studien. Die Ursache für diese Erkrankungen ist Gegenstand intensiver Nachbeobachtungen in der Phase IV.[2]
Zulassung und Vermarktung
Dapagliflozin wurde 2012 von der Europäischen Arzneimittelbehörde (EMA) unter dem Handelsnamen Forxiga zugelassen,[3] 2014 folgte das Kombinationspräparat aus Dapagliflozin und Metformin unter dem Handelsnamen Xigduo.[4]
In den USA hatte die Food and Drug Administration (FDA) 2012 die Zulassung für Dapagliflozin aufgrund von Sicherheitsbedenken zunächst verweigert. Weitere Studien sollten klären, ob das Medikament Blasenkrebs, Brustkrebs oder Leberschäden verursachen kann.[5] Nachdem Daten aus neueren Studien und Anwendungen eine entsprechende Einschätzung erlaubten, erfolgte im Januar 2014 die Zulassung für den US-amerikanischen Markt.[6] Dort wird das Präparat unter dem Handelsnamen Farxiga vertrieben.[7]
Dapagliflozin ist in der EU für den Einsatz bei erwachsenen Typ-2-Diabetespatienten laut aktueller Fachinformation zugelassen für die Monotherapie, wenn Diät und Bewegung allein den Blutzucker nicht ausreichend kontrollieren bei Patienten, bei denen die Anwendung von Metformin aufgrund einer Unverträglichkeit als ungeeignet erachtet wird oder in Kombination mit anderen blutzuckersenkenden Arzneimitteln einschließlich Insulin, wenn diese den Blutzucker, zusammen mit einer Diät und Bewegung, nicht ausreichend kontrollieren.
Forxiga ist außerdem bei erwachsenen Patienten indiziert zur Behandlung einer symptomatischen, chronischen Herzinsuffizienz mit reduzierter Ejektionsfraktion.[8]
Frühe Nutzenbewertung
In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Die G-BA-Beschlüsse der ersten vier frühen Nutzenbewertungen (2013 bis 2018) wurden aufgehoben.
2019 wurde Dapagliflozin zur Behandlung Erwachsener mit unzureichend kontrolliertem Typ-2-Diabetes mellitus in Ergänzung zu einer Diät und Bewegung (als Monotherapie, wenn Metformin aufgrund einer Unverträglichkeit als ungeeignet erachtet wird, oder zusätzlich zu anderen Arzneimitteln) erneut bewertet.[9][10] Gemäß G-BA-Beschluss hat der Wirkstoff in fünf von acht Patientengruppen keinen Zusatznutzen gegenüber der jeweiligen zweckmäßigen Vergleichstherapie. Für bestimmte Patienten mit hohem kardiovaskulärem Risiko, die weitere Medikation zur Behandlung der kardiovaskulären Risikofaktoren erhalten, gibt es dagegen einen Anhaltspunkt für einen geringen Zusatznutzen.[11]
Auch die Kombination mit Metformin wurde 2019 aufgrund neuer wissenschaftlicher Erkenntnisse neu bewertet.[12][13] Gemäß G-BA ist für Patienten ohne hohes kardiovaskuläres Risiko ein Zusatznutzen nicht belegt. Für Patienten mit hohem kardiovaskulärem Risiko, die weitere Medikation zur Behandlung der kardiovaskulären Risikofaktoren erhalten, gibt es dagegen einen Anhaltspunkt für einen geringen Zusatznutzen.[14]
Hinzu kam 2019 nach einer Zulassungserweiterung eine frühe Nutzenbewertung für Dapagliflozin zur Behandlung von Typ-1-Diabetes.[15][16] Laut G-BA-Beschluss gibt es für Dapagliflozin zur Behandlung Erwachsener mit unzureichend kontrolliertem Typ-1-Diabetes und einem BMI von mindestens 27 kg/m², deren Blutzucker trotz optimaler Insulintherapie nicht ausreichend kontrolliert ist, gegenüber der zweckmäßigen Vergleichstherapie (Humaninsulin oder Insulinanaloga) einen Anhaltspunkt für einen geringen Zusatznutzen. Aufgrund der häufig (bei mindestens 1 pro 100 Patienten) in T1DM-Studien aufgetretenen Diabetischen Ketoazidose mit Dapagliflozin ist das Medikament seit dem 25. Oktober 2021 in Deutschland nicht mehr für die Behandlung von Patienten mit Typ-1-Diabetes mellitus zugelassen und darf in dieser Population nicht mehr angewendet werden.[17]
Erstattung
Deutschland
In Deutschland ist Forxiga seit November 2012 entsprechend der Zulassung in Verwendung. Nach vorübergehendem Rückzug vom deutschen Markt im Dezember 2013 wurde das Medikament im Februar 2014 nach einer Einigung über den Preis mit dem GKV-Spitzenverband erneut in den Vertrieb gebracht.[18]
Österreich
In Österreich ist eine Erstattung von dapagliflozinhaltigen Präparaten möglich bei Patienten mit Diabetes Typ 2. Der „Erstattungskodex“ des Hauptverbandes der österreichischen Sozialversicherungsträger in der jeweils aktuellen Fassung legt die genauen Konditionen für die Erstattungsfähigkeit fest.[19]
Sonstiges
Forxiga wurde 2015 von der Zeitschrift PharmaBarometer zum „Innovativsten Produkt“ gekürt.[20]
Die randomisierte DAPA HF-Studie an 4477 Probanden ergab, dass 10 mg Dapagliflozin pro Tag bei erwachsenen Menschen „sehr wirksam und gut verträglich“ Herzinsuffizienz lindern könne.[21]
Literatur
- James F. List, Vincent Woo, Enrique Morales, Weihua Tang, Fred T. Fiedorek: Sodium-Glucose Cotransport Inhibition with Dapagliflozin in Type 2 Diabetes. Diabetes Care 32(4) 2009, S. 650–657. doi:10.2337/dc08-1863
- P. Cole, M. Vincente, R. Castaner: Dapagliflozin. In: Drugs of the Future. 33(9) 2008, S. 745.
- Ramona Steri, Manfred Schubert-Zsilavecz: Neues in der Therapie des Diabetes mellitus, Neue Wirkstoffklassen in der Pipeline. In: Pharmazie in unserer Zeit. 39(2) 2010, S. 142–147.
Weblinks
Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Dapagliflozin
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von (1S)-1,5-anhydro-1-C-[4-chloro-3-[(4-ethoxyphenyl)methyl]phenyl]-D-glucitol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 14. Januar 2020.
- Neue Arzneimittel (PDF; 141 kB) Information der Arzneimittelkommission der deutschen Ärzteschaft, Stand: 28. Februar 2013.
- Typ-2-Diabetes: Erster SGLT-2-Hemmer zugelassen. Pharmazeutische Zeitung online, 16. November 2012.
- XIGDUO (dapagliflozin and metformin hydrochloride) approved in the European Union for type 2 diabetes. astrazeneca.com
- F.D.A. Delays Approval of New Diabetes Drug. The New York Times, 19. Januar 2012.
- FDA Advisory Committee Recommends the Investigational SGLT2 Inhibitor Dapagliflozin for Treatment of Type 2 Diabetes in Adults. drugs.com
- Farxiga. drugs.com
- European public assessment report (EPAR) for Forxiga dapagliflozin (PDF; 123 kB), EMA/280091/2012, abgerufen am 20. Mai 2021.
- A19-53 Dapagliflozin (Diabetes mellitus Typ 2) – Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 27. März 2020.
- A19-92 Dapagliflozin (Diabetes mellitus Typ 2) - Addendum zum Auftrag A19-53. iqwig.de; abgerufen am 27. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Dapagliflozin (Erneute Nutzenbewertung § 14: Diabetes mellitus Typ 2). g-ba.de; abgerufen am 27. März 2020.
- A19-52 Dapagliflozin/Metformin (Diabetes mellitus Typ 2) - Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 27. März 2020.
- A19-93 Dapagliflozin/Metformin (Diabetes mellitus typ 2) - Addendum zum Auftrag A19-52. iqwig.de; abgerufen am 27. März 2020.
- Arzneimittel-Richtlinie/Anlage XII: Dapagliflozin/Metformin (Neubewertung aufgrund neuer Wissenschaftlicher Erkenntnisse: Diabetes mellitus Typ 2). g-ba.de; abgerufen am 27. März 2020
- A19-37 Dapagliflozin (Diabetes mellitus Typ 1) - Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 27. März 2020.
- A19-79 Dapagliflozin (Diabetes mellitus Typ 1) - Addendum zum Auftrag A19-37. iqwig.de; abgerufen am 27. März 2020.
- (Rote Hand-Brief der Arzneimittelkommission der deutschen Ärzteschaft) ; abgerufen am 3. November 2021.
- Kerstin Sucker-Szet: Erstattungsbetrag vereinbart – Forxiga kehrt auf den Markt zurück. In: Deutsche Apotheker Zeitung, 26. Februar 2014
- Erstattungskodex – EKO 1/2019. des Hauptverbandes der österreichischen Sozialversicherungsträger, Stand 1. Jänner 2019.
- Forxiga ist „das innovativste Produkt“ 2015 der Allgemeinärzte, Praktiker und Internisten, abgerufen am 25. April 2017.
- Michael Böhm: Antidiabetikum erweist sich als hochwirksames Herzinsuffizienz-Medikament. Deutsche Gesellschaft für Kardiologie - Herz- und Kreislaufforschung e. V.; dgk.org (PDF; 306 kB) abgerufen am 5. September 2019.