Ferritin
Ferritin (FT) (lat. ferrum, ‚Eisen‘), auch Depot-Eisen, ist ein Proteinkomplex, der in Tieren, Pflanzen und Bakterien vorkommt, wo er als Speicherstoff für Eisen dient. Im Menschen findet sich Ferritin hauptsächlich in der Leber, Milz und im Knochenmark. Bei gesunden Menschen sind ca. 20 % des gesamten Eisens in Ferritin gespeichert. Mutationen der Gene, die für Ferritin-Untereinheiten codieren, können erbliche Stoffwechselerkrankungen verursachen (siehe Tabelle im Text).
| Ferritin | ||
|---|---|---|
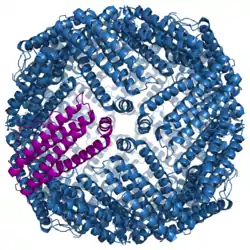 | ||
| Oberflächenmodell des Maus-Ferritins (eine einzelne Untereinheit ist violett hervorgehoben) nach PDB 1LB3 | ||
|
Vorhandene Strukturdaten: 1fha, 2cei, 2chi, 2cih, clu, cn6, cn7, 2fha, 2iu2 | ||
| Masse/Länge Primärstruktur | 174/182 Aminosäuren (L/H) | |
| Sekundär- bis Quartärstruktur | 24-mer | |
| Isoformen | L/H | |
| Enzymklassifikation | ||
| EC, Kategorie | 1.16.3.1, Oxidoreduktase | |
| Reaktionsart | Oxidation | |
| Substrat | 4 Fe2+ + 4 H+ + O2 | |
| Produkte | 4 Fe3+ + 2 H2O | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
Obwohl sich das meiste Ferritin innerhalb der Zellen befindet, ist die Ferritinkonzentration im menschlichen Blutserum ein aussagekräftiges Maß für den gesamten Eisenspeicher des Organismus. Die Bestimmung des Ferritinspiegels ist heutzutage Routine in der Labordiagnostik und hat vor allem bei den Diagnosen der Anämie und der Hämochromatose einen hohen Stellenwert. Bei der Interpretation ist aber zu beachten, dass der Wert durch die Akute-Phase-Reaktion erhöht sein kann und so eine scheinbare Erkrankung diagnostiziert wird. Gleichsam kann dadurch auch ein eventuell tatsächlich vorliegender Eisenmangel verschleiert werden.
Struktur und Vorkommen
Ferritine sind etwa 8 Nanometer große, mit Eisenhydroxid-Oxid gefüllte scheibenförmige Proteine, die aus 24 Proteinuntereinheiten aufgebaut sind (s. Bild). Die Untereinheiten haben eine Länge von etwa 150 bis 160 Aminosäuren im Bakterioferritin, 170 bis 180 Aminosäuren im tierischen und bis über 200 Aminosäuren im pflanzlichen Ferritin. Die Proteinhülle ohne Eisenatome im Kern wird Apoferritin genannt und hat eine Masse von 400 kDa. Zusammen mit den etwa 4500 Eisenatomen hat ein Ferritinkomplex beim Menschen damit etwa eine Masse von 900 kDa.[1]
Pflanzliches Apoferritin findet sich in zwei Isoformen in den Chloroplasten. Das menschliche Ferritin besteht aus zwei verschiedenen Untereinheiten, der L (light) chain und der H (heavy) chain. Die heavy chain beinhaltet eine Eisenbindestelle, welche auch ein Ferrooxidasezentrum besitzt, um Eisen auf III+ zu oxidieren. Die light chain hat keine enzymatische Aktivität, ist aber für den Transport der Eisenatome in den Kern verantwortlich. Die Zusammensetzung des Ferritins ist je nach Organ verschieden. Das Ferritin im Herzen und im Hirn weist wesentlich mehr H-Ferritin auf, wohingegen in der Milz und der Leber das L-Ferritin überwiegt, da dort die Eisenlagerungsfunktion überwiegt.[2]
| Gen-Name (HGNC) | Genlocus | Länge (AA) | UniProt | OMIM | Pathologie |
|---|---|---|---|---|---|
| FTL | 19q13.3-13.4 | 174 | P02792 | 134790 | Hyperferritinämie-Katarakt-Syndrom; Neuroferritinopathie |
| FTH | 11q12-q13 | 182 | P02794 | 134770 | Eisenüberladung, autosomal dominant |
| FTMT | 5q21.3 | 193 | Q8N4E7 | 608847 |
Biosynthese und biologische Funktion
Eisenionen im Zytosol binden an dort vorliegende latente mRNA-Moleküle, die für FTL (leichte Kette) bzw. für FTH (schwere Kette) codieren, und verursachen ihre Aktivierung und Bindung an Ribosomen mit nachfolgender Translation. Bei Absinken des Eisenspiegels verliert eine bestimmte Aconitase ihre [4Fe-4S]-Cluster, agiert in der Folge als Eisenregulationsprotein (IRP) und hemmt die Ferritintranslation durch Bindung an eisenresponsive Elemente (IRE) in der Ferritin-mRNA.
Die Aufgaben des Ferritin sind Oxidation von Eisen(II), Transport von Eisen(III) in das Molekülinnere, Aufbau des Eisenminerals im Innern und Mobilisierung dieses Eisens bei Bedarf.
Um die Höhlung des Ferritin mit Eisen zu füllen, wird poly(rC) binding protein-1 (PCBP1) als Chaperon benötigt.[3][4][5]
Mitochondriales Ferritin (FTMT) kann während pathologischer Zustände als zusätzlicher Eisenspeicher in Mitochondrien dienen. Neben Ferritin sind Hämoglobin und Hämosiderin die wichtigsten Speicherformen des Eisens im Organismus (Anteil ca. 50 bzw. 30 %).[6]
Labordiagnostik
Referenzbereich
Für Ferritin gelten für den Menschen folgende Referenzwerte:[7]
Säuglinge:
- Nabelschnurblut 30-276 ng/ml
- 2.–3. Woche 90-628 ng/ml
- 1. Monat 144-399 ng/ml
- 2. Monat 87-430 ng/ml
- 4. Monat 37-223 ng/ml
Kinder:
- 6 Monate-15. Lebensjahr 7-142 ng/ml
Frauen:
- 16.–50. Lebensjahr 22-112 ng/ml
- 65.–90. Lebensjahr 13-651 ng/ml
Männer:
- 16.–50. Lebensjahr 34-310 ng/ml
- 65.–87. Lebensjahr 4-665 ng/ml
Ferritinwert zu niedrig
Ferritinwert zu hoch
Siehe auch
Weblinks
- Ferritin tutorial (englisch)
Einzelnachweise
- Richard J. Epstein: Human Molecular Biology: An Introduction to the Molecular Basis of Health and Disease. Cambridge University Press, 2003, ISBN 0-521-64481-X, S. 161.
- Andrzej Friedman, Paolo Arosio, Dario Finazzi, Dariusz Koziorowski, Jolanta Galazka-Friedman: Ferritin as an important player in neurodegeneration. In: Parkinsonism & Related Disorders. Band 17, Nr. 6, Juli 2011, ISSN 1353-8020, S. 423–430, doi:10.1016/j.parkreldis.2011.03.016 (elsevier.com [abgerufen am 3. Mai 2018]).
- Ferritin. In: Online Mendelian Inheritance in Man. (englisch).
- H. Shi u. a.: A cytosolic iron chaperone that delivers iron to ferritin. In: Science. 320, 5880, 2008, S. 1207–1210. PMID 18511687.
- P. M. Harrison, P. Arosio: The ferritins: molecular properties, iron storage function and cellular regulation. In: Biochim Biophys Acta. 31, 1275, 1996, S. 161–203. PMID 8695634.
- Ferritin. In: Online Mendelian Inheritance in Man. (englisch).
- Laborlexikon.