Hexafluorosilicate
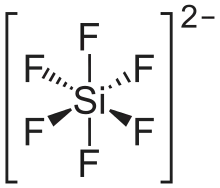
Als Hexafluorosilicate (heute auch Hexafluoridosilicate oder kurz Fluorosilicate) werden die Salze der Hexafluorokieselsäure bezeichnet. Sie besitzen die allgemeine Formel M2+[SiF6] oder M+2[SiF6].
Darstellung
Man erhält sie durch Umsetzung von Metallhydroxiden, -carbonaten oder anderen Salzen mit Hexafluorokieselsäure.[1] Natrium- und Kaliumhexafluorosilicat werden durch Umsetzung von Alkalisalzen (z. B. Chloriden) mit Hexafluorokieselsäure und anschließende Abtrennung der in Wasser schwer löslichen Alkalihexafluorosilicate hergestellt. Magnesium-, Zink- und Kupferhexafluorosilicat werden aus Hexafluorokieselsäure und den entsprechenden Oxiden hergestellt und durch Eindampfen der Lösung gewonnen.[2]
Eigenschaften
Alkalimetallfluorosilicate (mit Ausnahme von Lithiumhexafluorosilicat und Caesiumhexafluorosilicat) sind in Wasser schwer, die übrigen Metallfluorosilicate leicht löslich. Die geringste Wasserlöslichkeit der Alkalimetallfluorosilicate hat dabei das Kaliumhexafluorosilicat.[3] Sie sind meist giftig und sie ätzen Metall. Im oktaedrischen [SiF6]2−-Anion beträgt der Si-F-Abstand 170 pm.[1] Die Hexafluorosilicate von Aluminium und Blei reagieren stark sauer, Magnesium- und Zinkfluorosilicat dagegen schwach sauer.[4]
Verwendung
Das technisch wichtigste Hexafluorosilicat ist das Natriumhexafluorosilicat.[1] Kupferhexafluorosilicat und Magnesiumhexafluorosilicat dienten früher als Holzschutzmittel.[5] Sie wirken gärungshemmend und vernichten den Hausschwamm und holzschädigende Insekten.[4] Magnesiumhexafluorosilicat dient auch zur Härtung (Fluatierung) von Beton und Wasserfestmachung im Bautenschutz.[1] Im Bauwesen werden besonders Aluminium-, Magnesium-, Blei- und Zinkhexafluorosilicat eingesetzt. Hexafluorosilicate werden vor allem dort abgekürzt als Fluate bezeichnet. Mischungen von Fluaten (Misch-Fluate, Mehrfach-Fluate) können auch freie Fluorokieselsäure sowie Netzmittel enthalten. Sie bilden nach dem Auftragen (Fluatieren) auf gesäuberte und trockene Oberflächen zementgebundener Baustoffe infolge Reaktion mit den Zementbestandteilen wasserunlösliche Calciumfluorkieselsäuren. Diese verstopfen die Zementsteinporen und können auf diese Weise Fußböden, Wände und Fassaden gegen Witterungseinfluss, Säuregase, aggressive Flüssigkeiten, Öle etc. schützen. Auch Natur- und Kunststeine (z. B. Denkmäler) werden so konserviert.[4]
Einzelnachweise
- spektrum.de: Fluorosilicate – Lexikon der Chemie – Spektrum der Wissenschaft, abgerufen am 24. November 2016.
- Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg: Industrielle Anorganische Chemie. John Wiley & Sons, 2013, ISBN 978-3-527-33019-5, S. 114 (eingeschränkte Vorschau in der Google-Buchsuche).
- E. G. Rochow: The Chemistry of Silicon Pergamon International Library of Science, Technology, Engineering and Social Studies. Elsevier, 2013, ISBN 978-1-4831-8755-6, S. 1466 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Fluorosilicate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. November 2016.
- Konrad Zilch, Claus Jürgen Diederichs, Rolf Katzenbach, Klaus J. Beckmann: Handbuch für Bauingenieure Technik, Organisation und Wirtschaftlichkeit. Springer-Verlag, 2013, ISBN 978-3-642-14450-9, S. 198 (eingeschränkte Vorschau in der Google-Buchsuche).