Isoelektronisch
Als isoelektronisch bezeichnet man zwei Atome, Ionen, Moleküle oder Formeleinheiten, wenn sie identische Elektronenzahl, Elektronenkonfiguration und Atomanzahl besitzen[2], obwohl sie aus unterschiedlichen Elementen bestehen. Bei Verbindungen ergibt sich daraus auch eine übereinstimmende Bindungsgeometrie.

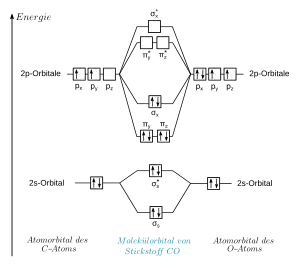
Physikalische und chemische Eigenschaften isoelektronischer Verbindungen unterscheiden sich oft recht stark. Da sich die Gesamtladung und/oder die Ladungsverteilung isoelektronischer Verbindungen oft deutlich voneinander unterscheiden, sind Eigenschaften, die hiervon besonders stark beeinflusst werden, weniger ähnlich als andere, die davon weniger beeinflusst werden (vgl. Isosterie). Einige isoelektronische Verbindungen haben z. B. sehr ähnliche Qualitäten als Ligand bzw. Lewis-Base in Komplexverbindungen, siehe die Beispiele.
Beispiele:
Etwas weiter gefasst ist der Begriff „isovalenzelektronisch“. Hier muss nur die Valenzschale analog aufgebaut und mit der gleichen Anzahl an Elektronen gefüllt sein. Darunter fallen z. B. Verbindungen, bei denen ein Partner durch das im Periodensystem über oder unter ihm stehende Element ersetzt wird.
Beispiele:
Siehe auch
- Isolobalität
- Highly Charged Ion für die Emissionslinien einer isoelektronischen Reihe
Quellen
- Eintrag zu isoelectronic. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.I03276.
Einzelnachweise
- Erwin Riedel, Christoph Janiak: "Riedel - Anorganische Chemie" (8. Auflage). Verlag: De Gruyter Studium. ISBN 978-3-11-022566-2. Seite 146f.
- Erwin Riedel / Christoph Janiak: Anorganische Chemie (8. Auflage). ISBN 978-3-11-022566-2.