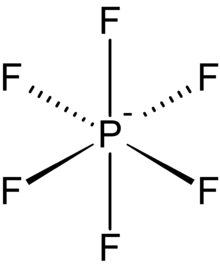
Hexafluorophosphate
Die Hexafluorophosphate bilden eine Stoffgruppe, deren Vertreter das aus einem Phosphoratom und sechs Fluoratomen bestehende, einfach negativ geladene PF6−-Anion enthalten. Dieses oktaedrische Molekül ist isoelektronisch mit Schwefelhexafluorid und dem Hexafluorosilicat-Dianion, SiF62− und ist Valenz-isoelektronisch mit dem hochstabilen Supersäuren-Anion Fluorantimonat SbF6−. Die Hexafluorophosphate sind die Salze der unbeständigen Hexafluorphosphorsäure. Wie die gewöhnlichen Phosphate enthalten sie den Phosphor in der Oxidationsstufe +V.
Eigenschaften
Als ein nicht-koordinierendes Anion ist das Hexafluorophosphat ein schlechtes Nukleophil. Es ist in ionischen Flüssigkeiten anfällig für Zersetzung unter Freisetzung von Fluorwasserstoff[1], ist jedoch in Lösung im Allgemeinen sehr stabil. Die Hydrolyse der Phosphationen erfolgt sehr langsam, auch in erwärmten konzentrierten Säuren[2] und noch langsamer unter basischen Bedingungen.[3] Sie sind etwas stabiler gegen anodische Oxidation als Tetrafluoroborate und Perchlorate.[4] Ihre Löslichkeitseigenschaften folgt denen der Perchlorate. So sind Kalium- und Tetramethylammoniumhexafluorophosphat nur mäßig löslich in Wasser, während Natrium-, Ammonium- und Erdalkalimetallhexafluorophosphate sehr gut löslich sind.[5]
In der Umwelt ist das Hexafluorophosphat-Anion persistent und mobil.[6]
Gewinnung und Darstellung
Die Darstellung von Hexafluorophosphaten von Alkalimetallen wie Natrium und Kalium sowie von Ammoniumhexafluorophosphat kann durch Reaktion von der entsprechenden Chloride oder Fluoride mit Flusssäure und Phosphorpentachlorid erfolgen.[7]
Auch die Reaktion des Metallfluorides mit Phosphortrifluorid zum Beispiel bei Kalium und Cäsium liefert das entsprechende Hexafluorophosphat.[7]
Das Ammoniumhexafluorophosphat kann auch durch Reaktion Hexachlorphosphazen mit Fluorwasserstoff hergestellt werden.[7]
Nitrosonium- und Nitrosylhexafluorophosphat können durch Reaktion mit Phosphorpentabromid und Bromtrifluorid dargestellt werden.
Lanthanoidhexafluorophosphate können durch Reaktion von Hexafluorophosphorsäure mit basischen Lanthanoidcarbonathydraten gewonnen werden.[8]
Beispiele von Hexafluorophosphaten und ihren Anwendungen
Sehr viele Hexafluorophosphate sind bekannt, und Dutzende sind für Anwendungen kommerziell erhältlich. Die einfachsten sind rein anorganische Salze mit Metallkation; Beispiele finden sich in der Tabelle. Als Ausgangsstoffe für die Synthese weiterer Hexafluorophosphate sind insbesondere das Ammoniumhexafluorophosphat NH4PF6[9] und das Silberhexafluorophosphat AgPF6 bedeutend. Das von der Produktionsmenge bedeutendste Hexafluorophosphat ist das Lithiumhexafluorophosphat LiPF6, das in den Elektrolyten der meisten Lithium-Ionen-Akkumulatoren, Lithiumbatterien und in Lithium-Ionen-Kondensatoren enthalten ist. Außerdem gibt es mehrere Verbindungsgruppen von Hexafluorophosphaten, die als Kupplungsreagenzien in der Peptidsynthese benutzt werden, siehe die Tabelle „Hexafluorophosphate mit organischen Kationen I“.
| wichtige Anorganische Hexafluorophosphate | |
|---|---|
| Hexafluorophosphate
mit Metallkation |
Hexafluorophosphate mit anderen
anorganischen Kationen |
| Lithiumhexafluorophosphat Li[PF6] | Nitrosylhexafluorophosphat NO[PF6] |
| Natriumhexafluorophosphat Na[PF6] | Nitroniumhexafluorophosphat NO2[PF6] |
| Kaliumhexafluorophosphat K[PF6] | Ammoniumhexafluorophosphat NH4[PF6] |
| Silberhexafluorophosphat Ag[PF6] | |
| Hexafluorophosphate mit organischen Kationen I :
Kupplungsreagenzien für die Peptidsynthese | |||||||
|---|---|---|---|---|---|---|---|
Phosphonium-Reagenzien
| |||||||
Uronium/Aminium/Imonium-Reagenzien
|
| Hexafluorophosphate mit organischen Kationen II: |
|---|
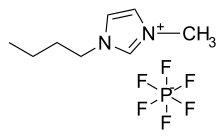
| 1-Butyl-3-methylimidazoliumhexafluorophosphat [BMIM][PF6]
|
| 1-Ethyl-3-Methylimidazoliumhexafluorophosphat [EMIM][PF6] |
| 1-Ethyl-3-Propylimidazoliumhexafluorophosphat [EPIM][PF6] |
| Hexafluorophosphate mit organischen Kationen III:
Derivate des Ammoniumhexafluorophosphats |
|---|
| Tetramethylammoniumhexafluorophosphat [TMA][PF6] |
| Tetraethylammoniumhexafluorophosphat [TEA][PF6] |
| Tetrabutylammoniumhexafluorophosphat [TBA][PF6] |
| Tetrahexylammoniumhexafluorophosphat [THA][PF6] |
Hexafluorophosphate werden außerdem für das Elektropolieren von Legierungen eingesetzt.[10] Einige werden auch in der Katalyse genutzt,[10] z. B. der Crabtree-Katalysator zur Hydrierung, der einwertiges Iridium enthält. Hexafluorophosphate werden auch als ionische Flüssigkeiten verwendet,[11] z. B. die in der Tabelle genannten Beispiele. Das Tetrabutylammoniumhexafluorophosphat zählt im Gemisch mit Acetonitril zu den besten nichtwässrigen Elektrolyten, da es einen sehr großen Potentialbereich („elektrochemisches Fenster“) von 6,3 V bietet.[12]
Bestimmung
Das Hexafluorophosphat konzentrierter wässriger Lösungen kann ausgefällt und dadurch bestimmt werden. Als Fällungsreagenz wurde bis 1963 Nitron[9] (Reagenz nach Busch, in saurer Lösung protoniert als C20H17N4+) und das gravimetrische Verfahren verwendet, bei dem der getrocknete Niederschlag gewogen wird. Seit 1963 dient vor allem Tetraphenylarsoniumchlorid als Fällungsreagenz für PF6−:[10][13][14]
Die Bestimmung kann dabei ebenfalls gravimetrisch erfolgen,[10][13] oder es wird eine amperometrische Titration durchgeführt.[14]
Einzelnachweise
- Paul J. Dyson, Tilmann J. Geldbach: Metal Catalysed Reactions in Ionic Liquids. Springer Science & Business Media, 2006, ISBN 978-1-4020-3915-7, S. 27 (eingeschränkte Vorschau in der Google-Buchsuche).
- Allen E. Gebala, Mark M. Jones: The acid catalyzed hydrolysis of hexafluorophosphate. In: Journal of Inorganic and Nuclear Chemistry. 31, 1969, S. 771, doi:10.1016/0022-1902(69)80024-2.
- In Sung Chun, Sung Jin Moon, Young Mee Na, Young-A. Lee, Kyung Ho Yoo, Ok-Sang Jung: Selective and sensitive recognition of hexafluorophosphate via an unusual equilibrium between a cationic square host and a guest. In: Inorganic Chemistry Communications. 10, 2007, S. 967, doi:10.1016/j.inoche.2007.05.008.
- Ole Hammerich, Bernd Speiser: Organic Electrochemistry, Fifth Edition Revised and Expanded. CRC Press, 2015, ISBN 978-1-4200-8402-3, S. 326 (eingeschränkte Vorschau in der Google-Buchsuche).
- Arthur D. F. Toy: The Chemistry of Phosphorus Pergamon Texts in Inorganic Chemistry. Elsevier, 1973, ISBN 978-1-4831-4741-3, S. 537 (eingeschränkte Vorschau in der Google-Buchsuche).
- Isabelle Neuwald, Matthias Muschket, Daniel Zahn, Urs Berger, Bettina Seiwert: Filling the knowledge gap: A suspect screening study for 1310 potentially persistent and mobile chemicals with SFC- and HILIC-HRMS in two German river systems. In: Water Research. Band 204, 1. Oktober 2021, ISSN 0043-1354, S. 117645, doi:10.1016/j.watres.2021.117645 (sciencedirect.com [abgerufen am 4. Dezember 2021]).
- J.H. Simons: Fluorine Chemistry. Elsevier, 2012, ISBN 0-323-14724-0, S. 56 (eingeschränkte Vorschau in der Google-Buchsuche).
- Stanley Kirschner: Inorganic Syntheses. John Wiley & Sons, 2009, ISBN 0-470-13289-2, S. 180 (eingeschränkte Vorschau in der Google-Buchsuche).
- Willy Lange, Emil Müller: Über die Salze der Phosphor-hexafluorwasserstoffsäure, HPF6. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). Band 63, Nr. 5. Wiley, 7. Mai 1930, S. 1058–1070, doi:10.1002/cber.19300630510 (wiley.com).
- William John Williams: Handbook of Anion Determination. Butterworth-Heinemann, London Boston Sydney u. a. 1979, ISBN 0-408-71306-2, Hexafluorophosphate, S. 428 (eingeschränkte Vorschau in der Google-Buchsuche).
- Antonia Perez De Los Rios, Francisco Jose Hernandez Fernandez: Ionic Liquids in Separation Technology. Elsevier, 2014, ISBN 978-0-444-63262-3, S. 62 (eingeschränkte Vorschau in der Google-Buchsuche).
- Peter Wasserscheid, Thomas Welton: Ionic Liquids in Synthesis. 2nd, completely rev. and enl. ed Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-31239-9, Electrochemical Properties of Ionic Liquids, S. 147 (eingeschränkte Vorschau in der Google-Buchsuche).
- Harold E. Affsprung, Vernon S. Archer: Gravimetric Determination of Hexafluorophosphate as Tetraphenylarsonium Hexafluorophosphate. In: ACS (Hrsg.): Analytical Chemistry. Band 35, Nr. 12, 1. November 1963, S. 1912–1913, doi:10.1021/ac60205a036 (englisch, acs.org).
- Harold E. Affsprung, Vernon S. Archer: Determination of Hexafluorophosphate by Amperometric Titration with Tetraphenylarsonium Chloride. In: ACS (Hrsg.): Analytical Chemistry. Band 35, Nr. 8, 1. Juli 1963, S. 976–978, doi:10.1021/ac60201a017 (englisch, acs.org).