Phyllosphäre
Die Phyllosphäre ist in der Ökologie der Bereich, den die Oberflächen von Blättern und Blattscheiden als Lebensraum für andere Organismen bilden. Die Phyllosphäre stellt die größte biologische Oberfläche der Erde dar und wird insbesondere von zahlreichen Mikroorganismen, in erster Linie Bakterien, Hefen und fadenförmigen Pilzen, besiedelt. In Anpassung an einen nährstoffarmen Lebensraum mit speziellem Untergrund (wasserabstoßende Cuticula der Blätter) und rasch wechselnden Bedingungen – zum Beispiel hinsichtlich Feuchte und Strahlung – entwickelten die Phyllosphärenbewohner ein breites Spektrum an Überlebensstrategien.
Zur Aufklärung der bislang nur ansatzweise bekannten Biodiversität und der komplexen Wechselbeziehungen, die bis zur Rolle der Phyllosphärengesellschaften in globalen Stoffkreisläufen reichen, bedient sich das vergleichsweise junge Feld der Phyllosphärenforschung auch molekularbiologischer Methoden. Lag anfangs das Hauptinteresse auf der Untersuchung von Krankheitserregern bei Pflanzen, wurde inzwischen auch die Bedeutung der zahlreichen neutral oder gar fördernd auf ihre Unterlage wirkenden Phyllosphärenbewohner erkannt, die beispielsweise im biologischen Pflanzenschutz eingesetzt werden können.
Begriffe

Der Begriff „Phyllosphäre“ wurde Mitte der 1950er-Jahre in Analogie zur Rhizosphäre (dem Bereich um die Pflanzenwurzeln) für die Grenzschicht zwischen Blatt und Atmosphäre geprägt.[1][2] Er leitet sich von den altgriechischen Bezeichnungen φύλλον phyllon ‚Blatt‘ und σφαῖρα sphaira ‚Kugel‘, ‚Ball‘ her.[3] Die räumliche Abgrenzung des Phyllosphärenbegriffes (im Deutschen gelegentlich auch als Blattraum[4] bezeichnet) wird in der Fachliteratur uneinheitlich gehandhabt und teilweise nicht nur auf Blätter und Blattscheiden beschränkt, sondern auf die Oberflächen sämtlicher oberirdischer Pflanzenorgane, also auch Knospen, Blüten, Früchte und Stängel ausgedehnt.[5] Zuweilen wird stattdessen oder zusätzlich der Begriff Phylloplane[6] verwendet, teils synonym zur Phyllosphäre, teils in strikter Beschränkung auf die eigentliche Blattfläche, während der Begriff „Phyllosphäre“ je nach Autor auch tieferliegende Bereiche wie den substomatären Hohlraum unterhalb der Spaltöffnungen bzw. den Apoplast mit einschließen kann.[7]
Die Phyllosphäre ist in der Regel von zahlreichen Mikroorganismen besiedelt. Diese Organismen werden begrifflich häufig den „Epiphyten“ zugeordnet.[8] Da dies jedoch allgemein „Aufsitzerpflanzen“ bezeichnet (und auch Gefäßpflanzen umfasst, während sich die Phyllosphärenforschung weitgehend auf die Mikroorganismen der unmittelbaren Blattoberflächen konzentriert), verwenden viele Autoren den für Phyllosphärenbesiedler spezifischeren Begriff „Epiphylle“, der auch im vorliegenden Artikel benutzt wird; die besonders im tropischen Bergregenwald vorhandenen epiphyllen Gefäßpflanzen werden in der Regel nicht zur Phyllosphäre gerechnet, da sie selbst raumgreifend sind und die Zone der unmittelbaren Blattoberfläche verlassen. Streng genommen sind Epiphylle jedoch nur diejenigen Organismen, die Blattoberseiten besiedeln, Bewohner von Blattunterseiten hingegen „Hypophylle“. Epi- und Hypophylle werden ihrerseits auch unter dem Oberbegriff „foliicol“ zusammengefasst, eine Bezeichnung, die sich besonders für die auch mit bloßem Auge sichtbaren Organismen wie Moose oder Flechten zumindest teilweise in der Fachliteratur durchgesetzt hat.[9][10]
Bedeutung
Der Lebensraum (Habitat) Phyllosphäre bildet die größte biologische Oberfläche der Erde. Auf der Grundlage von Satellitendaten wird die terrestrische Gesamtblattfläche auf etwa 640 Millionen km²[11] bis 1 Milliarde km²[7] geschätzt, was etwa 125 % bis 200 % der gesamten Erdoberfläche entspricht. Die Phyllosphäre bietet somit einen ausgedehnten, zudem reich strukturierten Lebensraum. Als Besiedler herrschen Mikroorganismen vor, deren Betrachtung gemeinhin den Schwerpunkt der Phyllosphärenforschung darstellt. Dies sind insbesondere Bakterien (deren Individuenzahl bei weitem dominiert), gefolgt von Hefen, filamentösen (fadenförmigen) Pilzen und ggf. weiteren Organismengruppen: Pflanzenviren, Archaeen, Oomyceten, Myxomyceten, Grünalgen, Moosen, Flechten, Farnen, tierischen Einzellern und Wirbellosen.
Konservative Schätzungen gehen von einer Bakteriengesamtzahl in der Phyllosphäre von 1026 aus. Ein Pflanzenblatt trägt pro Quadratzentimeter typischerweise eine Million bis 10 Millionen Bakterien. Manche Pflanzengruppen, etwa Citrusarten oder Koniferen, sind hingegen mit teilweise weniger als 1.000 Zellen pro cm² deutlich schwächer besiedelt.[8]
Die Phyllosphäre stellt aufgrund ihrer großen Fläche ein wichtiges Refugium und zugleich eine bedeutende Ressource für Mikroorganismen dar. Da diese organische Substanz aufnehmen und später in veränderter Form wieder freisetzen, ist – neben dem über das Blatt ohnehin stattfindenden Stoffaustausch mit der Umgebung – auch die Phyllosphäre in biogeochemische Stoffkreisläufe eingebunden. Die Anzahl der die Phyllosphäre bewohnenden Mikroorganismen ist hinreichend groß, um auch die globalen Kohlenstoff- und Stickstoffkreisläufe beeinflussen zu können.[8]
Während die Erforschung der Rhizosphäre bereits auf eine längere Tradition zurückblicken kann, wird den Eigenschaften, der Biodiversität sowie den Interaktionen der Phyllosphärenbewohner mit der belebten und unbelebten Umgebung erst seit wenigen Jahrzehnten vermehrte Aufmerksamkeit zuteil. Anfangs richtete sich das Hauptinteresse der Phyllosphären-Mikrobiologie aus ökonomischen Gründen auf die Untersuchung von Krankheitserregern (Pathogenen) bei Pflanzen, um die Mechanismen ihrer Ansiedlung, Ausbreitung und Schadwirkungen zu verstehen und entsprechende Gegenmaßnahmen ergreifen zu können. Mittlerweile wurde auch die wichtige Rolle der zahlreichen neutral oder gar fördernd auf ihre Unterlage wirkenden Phyllosphärenorganismen erkannt. Der Bedeutung der Phyllosphärenforschung wird durch regelmäßige Fachveranstaltungen Rechnung getragen, darunter ein internationales Phyllosphärensymposium, das seit der ersten Veranstaltung dieser Art 1970 in Newcastle upon Tyne in einem 5-Jahres-Turnus stattfindet. Das 9th International Symposium on the Microbiology of Aerial Plant Surfaces wurde im August 2010 durch die Oregon State University ausgerichtet.
Untersuchungsmethoden
Grundlage für die Erforschung der mit bloßem Auge vielfach unsichtbaren Lebensgemeinschaften der Phyllosphäre ist die Entwicklung geeigneter Untersuchungsmethoden. Tiefergehende Einblicke in komplette Artenspektren werden inzwischen durch moderne Verfahren der Molekularbiologie ermöglicht.
Klassische Verfahren
Zu den klassischen Untersuchungsmethoden für Mikroorganismen der Phyllosphäre zählt das sogenannte „Leaf Printing“. Dabei wird ein Blatt vorsichtig auf ein Nährmedium, etwa eine Agarplatte, gedrückt und wieder abgezogen. Nach Inkubation werden dann die mittlerweile gewachsenen Bakterien- oder Pilz-Kolonien untersucht. Eine ähnliche Methode ist die Technik des „Leaf Washing“: Hierbei werden Blätter in einem Gefäß mit einer Flüssigkeit (zum Beispiel Salzlösung oder Phosphatpuffer) gespült und die von der Cuticula abgewaschenen Mikroorganismen dann weiterkultiviert, zum Beispiel durch Ausplattierung auf einem Nährmedium. Bei beiden Verfahren kommen anschließend Licht-, Fluoreszenz- bzw. Elektronenmikroskopie in Kombination mit mikrobiologischen bzw. biochemischen Methoden zum Einsatz, um die gewachsenen Organismen genauer analysieren zu können. So können die Kulturmedien bestimmte Nährstoffe oder hemmende Substanzen enthalten, mit denen sich verschiedene Organismengruppen unterscheiden lassen.
Zu beachten ist jedoch, dass nur ein Teil der epiphyllen Mikroorganismen unter Laborbedingungen kultivierbar ist oder Kolonien bildet. Daher kann mit den genannten Methoden nur ein Ausschnitt des tatsächlich vorhandenen Artenspektrums erfasst werden. Auch bilden sie nur die mikrobielle Population zu einem bestimmten Zeitpunkt ab; um die im Lauf der Blattentwicklung oft signifikanten Veränderungen erfassen zu können, bedarf es zahlreicher Blattanalysen über die gesamte Entwicklungszeit hinweg.[12]
Molekularbiologische Verfahren
Neben morphologischen oder physiologischen Untersuchungsmethoden sind mittlerweile auch Verfahren verfügbar, mit denen von Blättern abgewaschene Proben auf das gesamte Erbgut (Genom, in diesem Fall das Metagenom) der gewonnenen Organismen hin untersucht werden können. Häufig wird hierbei die Polymerase-Kettenreaktion (PCR) angewandt, mit der Erbsubstanz vervielfältigt wird, um sie dann mittels Gelelektrophorese aufzutrennen und auf bestimmte Marker hin zu untersuchen. Solche Marker bilden insbesondere die für Teile von Ribosomen codierenden Gene (16S rRNA bei Prokaryoten wie Bakterien, 18S rRNA bei Eukaryoten wie Pilzen).[12] Vergleichbare Verfahren werden neuerdings auch im Hinblick auf die Gesamtheit der Proteine (Metaproteom) unter Verwendung massenspektrometrischer Methoden eingesetzt.[7]
Andere Untersuchungsmethoden des Lebensraums Phyllosphäre beruhen auf der Inokulation von Blattoberflächen im Labor oder Freiland mit Suspensionen, die definierte Bakterien oder Pilzsporen enthalten (einzelne Arten bzw. Stämme oder auch Gemische). Forschungsgegenstand ist dann insbesondere deren Wachstumserfolg unter verschiedenen Umweltbedingungen und Wechselwirkungen mit bereits vorhandenen Besiedlern. Dabei kommen vielfach gentechnisch veränderte Bakterien als sogenannte Bioreporter oder Biosensoren zum Einsatz. Diese besitzen spezielle Reportergene, häufig ein Fluoreszenzgen (zum Beispiel das aus der Leuchtqualle Aequorea victoria stammende GFP-Gen), dessen Aktivität sich leicht nachweisen lässt. Mit Hilfe solcher Bioreporter lassen sich beispielsweise Anwesenheit und Verteilung bestimmter Substanzen auf Blättern, etwa Nährstoffe wie verschiedene Zucker, Spurenelemente oder auch Wasser, erkennen.[12]
Habitat
.jpg.webp)
Besonderheiten
Das Habitat Phyllosphäre stellt die geno- und phänotypische Flexibilität potenzieller Besiedler vor besondere Herausforderungen, denn die Blattoberfläche ist ein höchst uneinheitlicher Lebensraum. Strukturell bzw. funktionell verschiedene Regionen des Blattes wie Spaltöffnungen (Stomata), Blattadern, Haare (Trichome) und Epidermiszellen bieten nicht nur eine unterschiedliche „Topographie“, sondern variieren auch beträchtlich im Hinblick auf Wasserrückhaltefähigkeit, Dicke der Cuticula oder Durchlässigkeit für pflanzliche Stoffe. Die Cuticula der Blätter ist in der Regel das Substrat, mit dem die Organismen der Phyllosphäre zunächst in Kontakt kommen oder das von ihnen besiedelt wird. Sie ist ein extrazelluläres lipophiles Biopolymer und besteht hauptsächlich aus Cutin, in das Wachse verschiedener Zusammensetzung ein- oder aufgelagert sind. Ihre Struktur zeigt einen oftmals hochkomplexen dreidimensionalen und kristalloiden Aufbau, der im Laufe der Blattentwicklung starken Veränderungen unterworfen sein kann und bei älteren Blättern vielfach erodiert.[8][13]
Neben den strukturellen Besonderheiten der Unterlage ist der Lebensraum Phyllosphäre durch weitere spezielle physikalisch-chemische Gegebenheiten geprägt. Kennzeichnend sind häufige und rasche Änderungen der verfügbaren Feuchtigkeit. Diese wird insbesondere von Regen, Nebel oder Tau geliefert und hängt in hohem Maß auch von Blattoberflächenstrukturen und deren Benetzbarkeit ab. Weitere von oft raschen Schwankungen geprägte Faktoren sind Strahlung (insbesondere UV-Licht), Temperaturverhältnisse, Wind sowie Nährstoffverfügbarkeit. Hierin unterscheidet sich die Phyllosphäre von der Rhizosphäre, für die weitgehend konstante oder sich nur langsam ändernde Verhältnisse typisch sind. Insgesamt herrscht in der Phyllosphäre ein geringes Wasser- und Nährstoffangebot vor; nur ein kleiner Teil der im Blatt transportierten Nährstoffe und des Wassers tritt auch nach außen. Für Mikroorganismen nutzbar ist beispielsweise die Guttationsflüssigkeit mancher Pflanzenarten, die zugleich auch Nährstoffe enthält. Die für Besiedler verfügbaren Nährstoffe der Phyllosphäre stammen jedoch meist nur zu einem kleinen Teil aus dem Blatt selbst, da die Cuticula eine Barriere für polare Moleküle wie Zucker oder Aminosäuren darstellt, sondern vorwiegend aus der Atmosphäre (stickstoffhaltige Verbindungen, Pollen) oder als Honigtau von Insekten. Wachstumsbegrenzend für Mikroorganismen ist vielfach in erster Linie die Verfügbarkeit von Kohlenstoffverbindungen, erst in zweiter Linie die Verfügbarkeit von Stickstoff.[8]
Besiedlungsstrategien
Die Besiedlung der Phyllosphäre geschieht insbesondere durch Regen, Windverfrachtung (ggf. über hunderte von Kilometern hinweg) oder Insekten. Die Verteilung von Mikroorganismen auf Blättern ist jedoch sehr inhomogen. Blattadern, Blattunterseiten oder beschattete, basisnahe Bereiche von Drüsenhaaren oder Spaltöffnungen weisen meist eine dichtere mikrobielle Besiedlung auf als andere Blattzonen. Vorteilhaft ist dabei die Beweglichkeit mancher Mikroorganismen, die es ihnen erlaubt, sich aktiv zu geeigneten Stellen hinzubewegen. Zur Befestigung auf der hydrophoben Blattoberfläche kommen neben einer passiven Adhäsion auch aktive Mechanismen zum Tragen. So kann eine Anheftung zum Beispiel durch extrazelluläre wasserunlösliche Glykoproteine oder Polysaccharide erfolgen. Manche Bakterien verfügen hierzu über spezielle Bildungen, etwa dünne, fädige Proteinanhängsel oder -röhren (Pili) oder Mikrofibrillen aus Cellulose. Oft bilden Mikroorganismen auf Blättern größere Kolonien oder Aggregate. Eine Reihe von Arten ist in der Lage, sogenannte Biofilme zu entwickeln. Biofilme sind dünne schleimige Schichten, die eine komplexe Matrix extrazellulärer Polysaccharide und weiterer Biopolymere darstellen und aus einer Vielzahl von Lebensräumen bekannt sind. Sie bieten den darin oft in großer Zahl eingebetteten Organismen – vielfach ein breites Spektrum von Bakterien, Hefen und filamentösen Pilzen – günstigeres Milieu, zum Beispiel hinsichtlich pH-Wert oder Ionenstärke, und stellen insgesamt einen Schutz vor Austrocknung und Umwelteinflüssen dar.[14]
Manche Arten sind zur Abgabe oberflächenaktiver Stoffe befähigt, die als sogenannte Biotenside die Oberflächenspannung herabsetzen. So wird die Benetzbarkeit der hydrophoben Blattoberflächen mit Wasser verbessert und somit dessen Verfügbarkeit für Mikroorganismen gesteigert. Ein wirksames Biotensid ist beispielsweise das von Pseudomonas syringae produzierte Syringomycin.[15]
Abhängig von den rasch veränderlichen Umweltbedingungen ist die Besiedlungsdichte der Phyllosphäre starken zeitlichen Schwankungen unterworfen. So führen Niederschläge nicht nur zu einer Besiedlung, sondern auch einer Auswaschung vorhandener Blattbesiedler. Starke Niederschläge können daher signifikante Veränderungen der Besiedlungsdichte und -struktur nach sich ziehen, begünstigen aber durch zumindest vorübergehende Befeuchtung wiederum eine Neubesiedlung. Auch der Ankunftszeitpunkt ist für potenzielle Besiedler wesentlich: Erstbesiedler finden in der Regel mehr Nährstoffe vor als spätere Ankömmlinge und treffen auf weniger Konkurrenz. Überlebensvorteile in der Phyllosphäre haben Organismen, die über spezielle Anpassungsmechanismen verfügen, um mittels Toleranz- oder Vermeidungsstrategien auch rasche Milieu-Änderungen zu überstehen. Neben der Schaffung eigener Umgebungen durch Biofilme (s. o.) sind viele Mikroorganismen der Phyllosphäre in der Lage, Schirm-Pigmente (meist rosa, orange oder gelb gefärbt) zu produzieren, die ihnen Schutz vor UV-Strahlung verleihen. Da Strahlung ein erhöhtes Mutations-Risiko mit sich bringt, können zusätzlich oder alternativ leistungsfähige DNA-Reparatursysteme von Vorteil sein. So sind etwa von Pseudomonas syringae derartige auf UV-B-Strahlung ansprechende Mechanismen bekannt.[16]
Die Fähigkeit, auch tiefere Bereiche des Blattes und anderer Pflanzenorgane besiedeln zu können, ist hauptsächlich auf Krankheitserreger (Pathogene) beschränkt. Viele Pilze sind zu einer Durchdringung der Cuticula durch Hyphen befähigt, was ihnen nicht nur eine mechanische Befestigung, sondern oftmals auch ein direktes Anzapfen von Nährstoffen des Blattes gestattet. Sie bilden aufgrund ihrer Lebensweise den Übergang zum Endophytismus, der vom Epiphytismus und von rein epiphyller Lebensweise jedoch oft nicht scharf trennbar ist und bei einzelnen Arten auch von Umweltbedingungen oder Entwicklungsstadium abhängig sein kann. Meist erfolgt eine methodische Unterscheidung dadurch, dass eine Oberflächen-Sterilisierung überstanden wird oder nicht. Pathogenität ist jedoch nicht zwangsläufig an endophytische Lebensweise gebunden.[17][18]
Artenzusammensetzung und -sukzession
Neben der Besiedlungsdichte ist auch die Artenzusammensetzung von Phyllosphärengesellschaften nicht statisch, sondern von hoher Dynamik geprägt, wobei neben Umweltfaktoren wie Witterung oder Strahlung zum Beispiel auch Luftverschmutzung eine Rolle spielen kann. Wegen der hohen Heterogenität der Phyllosphäre gibt es Versuche, biogeographische Modelle der Inselbiogeographie auf die Mikroskala der Phyllosphäre zu übertragen und damit die auch zwischen benachbarten Blättern teilweise stark divergierende mikrobielle Besiedlungsstruktur zu erklären.[19]
Bakterien, Hefen und Pilze
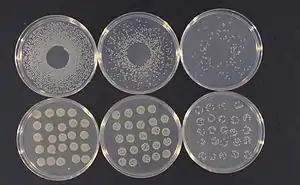
In gemäßigten Breiten ist im Lauf der Vegetationsperiode vielfach eine zeitliche Abfolge (Sukzession) mehrerer Gruppen epiphyller Mikroorganismen zu beobachten: Auf jungen, sich entfaltenden Blättern dominieren in der Regel – bei anfangs eher geringem Nährstoffangebot – Bakterien. Unter den leicht unter Laborbedingungen kultivierbaren Arten finden sich häufig Vertreter sauerstoffatmender (aerober) Gruppen der Gattungen Pseudomonas, darunter Pseudomonas syringae (einer der bestuntersuchten Organismen der Phyllosphäre[20]), Corynebacterium, Erwinia, Bacillus und Xanthomonas. Ebenfalls häufig, aber wegen ihres langsameren Wachstums und speziellerer Ansprüche im Labor schwieriger nachweisbar sind fakultativ methylotrophe (also zur Nutzung von Methanol als Kohlenstoff- und Energiequelle befähigte) Bakterien aus der Gattung Methylobacterium. Ferner können auf Blättern Cyanobakterien unter anderem aus den Gattungen Anabaena, Nostoc, Scytonema und Aulosira leben.[21] Wird das Metagenom analysiert, finden sich vielfach noch unbekannte Arten in den Proben, die belegen, dass die Kenntnis der bakteriellen Epiphyllen noch erhebliche Lücken aufweist. So wurden allein auf Zuckerrübenblättern 78 Bakterienarten aus 37 bekannten und 12 bislang namenlosen Gattungen nachgewiesen.[22]
Werden im Lauf der Blattentwicklung vermehrt Nährstoffe verfügbar (zum Beispiel in Form von Pollen, Staub oder Exkrementen blattbewohnender Arthropoden, insbesondere zuckerhaltiger Honigtau), treten Hefen in den Vordergrund. Häufig vertretene Gattungen sind Cryptococcus, Sporobolomyces, Rhodotorula, Torulopsis und Aureobasidium. Arten der Gattung Sporobolomyces sind unter den Hefen besonders erfolgreiche Besiedler der Phyllosphäre, da sie sich mit Hilfe des Abschusses sogenannter Ballistosporen effizient von einem Blatt zum anderen ausbreiten können.[21]
Mit fortschreitender Blattalterung (Seneszenz) im Herbst wird die Lebensgemeinschaft der Phyllosphäre zunehmend durch filamentöse Pilze geprägt. Sie stammen aus den Gruppen der Schlauchpilze (Ascomycota), Ständerpilze (Basidiomycota) sowie der künstlichen Gruppe der Imperfekten Pilze, die Arten unklarer systematischer Einordnung enthält. Nachgewiesen sind beispielsweise die Gattungen Epicoccum, Alternaria und Stemphylium, darunter auch blattschädigende Arten. Vorhandener Honigtau bildet auch Nahrungsgrundlage für vorwiegend saprophytische, also von totem organischen Material lebende Arten, wie die sogenannten Rußtaupilze. Bei weiter fortschreitender Blattseneszenz erscheinen fast nur noch Saprophyten, etwa Vertreter aus den Gattungen Ascochytula, Leptosphaeria, Pleospora und Phoma. Allochthon (also aus anderen Habitaten stammend, vor allem dem Boden) sind unter anderem die Gattungen Cryptococcus (s. o.), Myrothecium und Pilobolus neben zahlreichen weiteren auch in der Phyllosphäre vertreten.[21] Eine Inventarisierung auf den Blättern mediterraner Pflanzen ergab 1029 Stämme filamentöser Pilze und 540 Hefenstämme, die sich 36 bzw. 46 verschiedenen Arten zuordnen ließen.[23] Wie bei den Bakterien sind auch unter den Pilzen und Hefen bislang bei weitem nicht alle Arten bekannt.
Weitere Organismengruppen
Die Bedingungen in den subtropischen und tropischen Regionen, besonders den tropischen Regenwäldern mit ganzjährig hohen Temperaturen und entsprechendem Feuchteangebot (wie auch die Tatsache, dass in den Tropen viele Pflanzen ausdauerndes Laub tragen) erlauben es neben Mikroorganismen weiteren Artengruppen, dort Blattflächen zu besiedeln. Dazu zählen epiphylle (foliicole) Flechten, von denen über 800 Arten bekannt sind, allein 616 für die Neotropis, darunter beispielsweise Vertreter der Gattungen Arthonia, Bacidia, Byssoloma, Mazosia, Porina, Strigula und Tricharia.[10][24] Unter den ebenfalls sehr artenreichen foliicolen Moosen dominieren foliose Lebermoose der Familie Lejeuneaceae; bereits 1996 waren rund 1.000 Lebermoosarten mit epiphyller Lebensweise bekannt, darunter Arten aus den Gattungen Cololejeunea, Ceratolejeunea, Drepanolejeunea und Colura.[25] Auch aus ozeanisch geprägten Klimazonen höherer Breiten liegen vereinzelte Beobachtungen von Lebermoosen auf langlebigen Blättern vor, so bei Efeu (Hedera helix) in Südengland.[26] Wird mit zunehmendem Blattalter die Cuticula degradiert und die Benetzbarkeit mit Wasser höher, finden auch Grünalgen geeignete Bedingungen vor. Dies gilt in gemäßigten Klimazonen insbesondere für die mehrjährigen Nadeln von Koniferen, die ab dem zweiten Jahr häufig von Vertretern der Gattung Chlorococcus besiedelt werden.[27]
Erst seit Ende der 1990er-Jahre ist bekannt, dass die Phyllosphäre in tropischen Regionen – im gemäßigten Klima nur ausnahmsweise – auch ein Habitat für die Organismengruppe der Schleimpilze (Myxomyceten) darstellt. Während Moose und Flechten meist auf Blattoberseiten siedeln, bevorzugen die Schleimpilze mit ihren verschiedenen Entwicklungsstadien eher weniger regen- bzw. lichtexponierte Bereiche, also Blattunterseiten oder sekundäre, durch epiphylle Lebermoose gebildete Mikrohabitate.[28][29]
Tierische Einzeller, die sich bekanntermaßen im Boden und Wasser von Bakterien ernähren, konnten auch auf Blättern häufig nachgewiesen werden. Ein Beispiel ist das Heutierchen (Colpoda cucullus), das die Fähigkeit besitzt, bei Austrocknung Cysten zu bilden, um bei Befeuchtung rasch wieder aktiv werden zu können.[19] Zu den häufigen wirbellosen Bewohnern der Phyllosphäre zählen Nematoden. Zumindest größere Teile ihres Lebens halten sich zahlreiche Arten aus weiteren Tiergruppen in der Phyllosphäre auf, darunter Bärtierchen, Ringelwürmer, Schnecken, Milben, Doppelschwänze, Springschwänze, Staubläuse, Blattläuse, Schmetterlinge und Hautflügler, insbesondere Ameisen.[30]
Wechselwirkungen
Innerhalb der Phyllosphäre
Wechselwirkungen zwischen den Organismen der Phyllosphäre spielen sich einerseits zwischen den Besiedlern untereinander ab, andererseits zwischen den Besiedlern und ihrer Wirtsunterlage, also dem Blatt. Die Phyllosphäre begünstigt durch die enge Aggregierung der sie besiedelnden Mikroorganismen den Genaustausch. So wurden hohe Raten von horizontalem Gentransfer auch über Artgrenzen hinweg durch Übertragung bakterieller Plasmide nachgewiesen, was die Phyllosphäre wahrscheinlich zu einer wichtigen Quelle bzw. einem Hotspot mikrobieller Biodiversität macht.[8] Auch Interaktionen zwischen verschiedenen Epiphyllen-Gruppen bestehen, die über bloße Konkurrenz hinausgehen, so können etwa blattschädigende Pilze ihrerseits von Bakterien besiedelt, d. h. von diesen parasitiert werden, zum Beispiel Neurospora crassa durch Pseudomonas syringae.[31]
Die Organismen der Phyllosphäre können als Kommensalen neutrale, als Krankheitserreger (Pathogene) negative oder als Symbionten positive Einflüsse auf ihre Unterlage ausüben. Es gibt verschiedene Möglichkeiten, mit denen Epiphylle ein Blatt zu ihrem Vorteil beeinflussen können und es dadurch mehr oder minder schädigen. Die Einflussnahme kann etwa in der Abgabe pflanzlicher Hormone (Phytohormone), Giftstoffe (Toxine) oder Substanzen bestehen, welche die Durchlässigkeit (Permeabilität) von Zellmembranen steigern, um so die Nährstoffverfügbarkeit aus dem Blatt zu erhöhen. Positive Wirkungen (Mutualismus) für die Wirtspflanze können sich beispielsweise ergeben, wenn ihre Blätter durch Stickstofffixierer besiedelt werden, ihr Wachstum durch Phytohormone der Epiphyllen gesteigert wird oder deren Vorhandensein zu einer Unterdrückung anderer Organismen mit pathogener Wirkung führt. Vielfach ist keine klare Zuordnung der Organismen möglich, da Umweltfaktoren und Entwicklungszyklus insbesondere bei Bakterienarten mitbestimmen, ob sie neutral oder phytopathogen wirken.
Die mit bloßem Auge sichtbaren Blattbesiedler – wie Moose, Flechten oder Grünalgen – sind in der Regel für besiedelte Blätter nicht direkt schädlich, können allerdings mit zunehmendem Deckungsgrad deren Photosynthese-Leistung herabsetzen. Parasitismus ist bei diesen Gruppen wenig verbreitet, kommt jedoch vor. Beispiele sind Grünalgen der Gattung Cephaleuros und Flechten der Gattung Strigula, bei denen Cephaleuros-Arten Symbiosepartner sind.[32]

Die Aufmerksamkeit der Forschung konzentrierte sich lange Zeit auf die zahlreichen phytopathogenen Organismen der Phyllosphäre. Neben Blattzerstörern wie den vielen Mehltau-auslösenden Pilzen oder Feuerbrand-Erregern (Erwinia) können manche Erwinia- oder Pseudomonas-Arten auch Frostschäden durch Eisbildung begünstigen. Blätter enthalten vielfach biologische Frostschutzsubstanzen, die auch bei Temperaturen deutlich unter 0 °C ein Gefrieren verhindern. Bakterien, die das sogenannte ice-Gen enthalten, etwa verschiedene Stämme (Pathovare) von Pseudomonas syringae, reduzieren die Gefriertoleranz von Blättern, so dass es zu frühzeitiger, zellzerstörender Eiskristallbildung kommt. Um dieser Schadwirkung entgegenzutreten, kam es zu den ersten Freilandversuchen mit gentechnisch veränderten Bakterien überhaupt, denn es konnte nachgewiesen werden, dass Bakterienstämme ohne das ice-Gen erfolgreich mit pflanzenschädlichen Stämmen konkurrieren können. Entsprechende Bakterienstämme werden mittlerweile kommerziell vertrieben.[8]

Zur Bekämpfung des im Obstbau wirtschaftlich sehr bedeutsamen Feuerbranderregers Erwinia amylovora wurden im Sinne eines biologischen Pflanzenschutzes gleichfalls nicht-chemische, auf Konkurrenz basierende Strategien entwickelt, die darauf beruhen, dass eine frühzeitige Aufbringung antagonistisch wirkender Mikroorganismen eine spätere Besiedlung mit Erwinia erfolgreich unterdrücken kann.[8] Generell finden die unter ökonomischen Aspekten positiven Effekte mancher Mikroorganismen in Form sogenannter Biological Control Agents (BCA) zur Kontrolle oder Verhinderung von Pflanzenkrankheiten wachsendes Interesse. Diese sind in der Lage, Pathogenbefall auf Blattoberflächen zu kontrollieren oder zu reduzieren. Hier kommen unterschiedliche Mechanismen in Frage wie Konkurrenz um Nährstoffe, Okkupation ökologischer Nischen oder aktive Hemmung anderer Arten durch Abgabe von Substanzen wie Säuren, zellauflösend wirkenden Enzymen oder antibiotisch oder fungizid wirkenden Stoffen.[31]
Phytohormone der Auxin-Gruppe sind unter den Bakterien der Phyllosphäre weit verbreitet und können an vielen Stellen der Pflanzenentwicklung wirksam werden. Sie können das Pflanzenwachstum im positiven Sinne fördern, was auch für die Phytohormongruppe der Cytokinine gilt, die von manchen Methylobacterium-Arten produziert werden.[33] Nachteile für den Wirt entstehen, wenn durch Phytohormone Hyperplasien bzw. Blattdeformationen oder Pflanzengallen ausgelöst werden. Abgegebene Hormonsubstanzen der Phyllosphärenbewohner können zudem eine Nährstoffabgabe des Blattes nach außen stimulieren, etwa über Neubildung von Ionenkanälen in Zellmembranen mit der Folge eines erhöhten Ausstroms von Stoffwechselprodukten. Indol-3-essigsäure (IAA, der wichtigste Auxin-Vertreter) stimuliert beispielsweise die Abgabe von Sacchariden aus pflanzlichen Zellwänden. Im Extremfall kann die Wirkung abgegebener Substanzen durch Epiphylle bis hin zum Zerfall (Lyse) von Blattzellen führen.
Von den Blättern vieler Trägerpflanzen in tropischen Regionen ist bekannt, dass sie regelmäßig von stickstofffixierenden (diazotrophen) Mikroorganismen besiedelt werden. Ein Teil des fixierten Stickstoffs kann auch von den Wirtspflanzen ins Blatt aufgenommen und genutzt werden. Eine Schlüsselrolle spielen dabei insbesondere diazotrophe Cyanobakterien, die ihrerseits wiederum oft eine enge, teils symbiotische Bindung an epiphylle Moose besitzen. Es wird angenommen, dass solche Gemeinschaften einen signifikanten Beitrag zum Stickstoffeintrag in tropischen Regenwäldern leisten. So werden für einen prämontanen Regenwald in Costa Rica Stickstoff-Fixationsraten in der Phyllosphäre von 2 bis 5 kg pro Hektar und Jahr angegeben (hauptsächlich durch Vertreter der Gattung Scytonema bewirkt)[34]. Die tatsächliche Kapazität der Phyllosphäre zur Stickstofffixierung und ihre Bedeutung im globalen Stickstoffkreislauf ist bislang jedoch nur unzureichend bekannt.[35]
Mit Mensch und Atmosphäre
Direkt für die menschliche Ernährung von Bedeutung sind einerseits von Pilzen produzierte Giftstoffe (Mykotoxine), die allerdings meist von Endophyten produziert werden. In jüngerer Zeit beobachtete Fallhäufungen von Nahrungsmittelvergiftungen belegen andererseits das Risiko, dass reifende Früchte oder Blattflächen von Gemüsen bereits vor der Ernte mit humanpathogenen Enterobakterien, etwa Salmonella oder Shigella, besiedelt sein können (zum Beispiel durch Berieselung mit ungeklärtem Wasser oder Dünger). Entgegen früherer Ansicht können derartige Bakterien auf solchen Oberflächen nicht nur überleben, sondern sich auch vermehren, dies insbesondere bei feuchten Bedingungen. Insgesamt ist die Biologie von Enterobakterien auf pflanzlichen Oberflächen jedoch noch wenig erforscht.[36]
Da Oberflächen allgemein eine wichtige Senke für reaktive Spurengase in der Atmosphäre darstellen, kommt in diesem Zusammenhang auch der Phyllosphäre eine nicht unbedeutende Rolle bei der Regulierung und Entfernung von Luftschadstoffen wie Ozon, Schwefeldioxid, Ammoniak und anderen zu. Grundsätzlich bieten die komplexen Blattstrukturen mit ihren Wachsauflagen und großen Oberflächen vielfältige Ablagerungsmöglichkeiten für feine Partikel (Staub) oder Aerosole. Inwieweit neben den nur teilweise verstandenen physikalisch-chemischen Effekten auf Blattoberflächen hier auch Interaktionen mit den Mikroorganismen der Phyllosphäre von Bedeutung sind, ist kaum erforscht. Es ist bekannt, dass Phyllosphärengesellschaften empfindlich auf Luftschadstoffe wie Schwefeldioxid oder Stickoxide reagieren.[37][38] Andererseits kann das Vorkommen schwermetallresistenter Bakterien in der Phyllosphäre auch als positiver Bioindikator für bestimmte Luftverunreinigungen dienen.[39]
Literatur
- M. J. Bailey, A. K. Lilley et al. (Hrsg.): Microbial Ecology of Aerial Plant Surfaces. CAB International, Wallingford/Oxfordshire 2006, ISBN 978-1845930615, 315 S.
- Steven E. Lindow, Eva I. Hecht-Poinar, Vern J. Elliot (Hrsg.): Phyllosphere microbiology. APS Press, St. Paul, Minn., 2002, ISBN 978-0-89054-286-6, 395 S.
- Steven E. Lindow, Maria T. Brandl: Microbiology of the phyllosphere. Applied and Environmental Microbiology 69, 2003, S. 1875–1883, online
Weblinks
Einzelnachweise
- F. T. Last: Seasonal incidence of Sporobolomyces on cereal leaves. Transactions of the British Mycological Society 38, 1955, S. 221–239.
- Jakoba Ruinen: Occurrence of „Beijerinckia“ species in the phyllosphere. Nature 177, 1956, S. 220–221.
- Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. München/Wien 1965.
- Elmar Weiler, Lutz Nover: Allgemeine und molekulare Botanik. G. Thieme, Stuttgart 2008, ISBN 978-3131476616, S. 805.
- T. M. Timms-Wilson, K. Smalla et al.: Microbial Diversity in the Phyllosphere and Rhizosphere of Field Grown Crop Plants: Microbial Specialisation at the Plant Surface. In: M. J. Bailey, A. K. Lilley et al. (Hrsg.): Microbial Ecology of Aerial Plant Surfaces. CAB International, Wallingford/Oxfordshire 2006, ISBN 978-1845930615, S. 21–36.
- Á Fonseca, J. Inácio: Phylloplane Yeasts. In: C. Rosa und G. Peter (Hrsg.): Biodiversity and Ecophysiology of Yeasts. Springer, Berlin/Heidelberg 2006, ISBN 978-3540261001, S. 263–302.
- Nathanaël Delmotte, Claudia Knief et al.: Community proteogenomics reveals insights into the physiology of phyllosphere bacteria. Proceedings of the National Academy of Sciences 38, 2009, S. 16428–16433, online
- Steven E. Lindow, Maria T. Brandl: Microbiology of the phyllosphere. Applied and Environmental Microbiology 69, 2003, S. 1875–1883, online
- Rainer Nowak, Sieghard Winkler: Foliicole Flechten der Sierra Nevada de Santa Marta (Kolumbien) und ihre gegenseitigen Beziehungen. Österreichische Botanische Zeitschrift 118, 1970, S. 456–485.
- Robert Lücking: Foliicolous lichenized fungi. Flora Neotropica Monograph 103. The New York Botanical Garden Press, New York 2008, ISBN 978-0-89327-491-7, 866 S.
- C. E. Morris, L. L. Kinkel: Fifty years of phyllosphere microbiology: Significant contributions to research in related fields. In: Steven E. Lindow, Eva I. Hecht-Poinar, Vern J. Elliot (Hrsg.): Phyllosphere microbiology. APS Press, St. Paul, Minn., 2002, ISBN 978-0-89054-286-6, S. 365–375.
- Markus Riederer, Caroline Müller (Hrsg.): Biology of the plant cuticle. Blackwell Pub., Oxford 2006, ISBN 978-1405132688, S. 334–341.
- Wilhelm Barthlott, Christoph Neinhuis et al.: Classification and terminology of plant epicuticular waxes. Botanical Journal of the Linnean Society 126 (3), 1998, S. 237–260.
- J.-F. Monier: Bacterial Assemblages on Plant Surfaces. In: M. J. Bailey, A. K. Lilley et al. (Hrsg.): Microbial Ecology of Aerial Plant Surfaces. CAB International, Wallingford/Oxfordshire 2006, ISBN 978-1845930615, S. 83–105.
- M. L. Hutchison, M. A. Tester, D. C. Gross: Role of biosurfactant and ion channel-forming activities of syringomycin in transmembrane ion flux: a model for the mechanism of action in the plant-pathogen interaction. Molecular Plant-Microbe Interactions 8, 1995, S. 610–620.
- J. J. Kim, G. W. Sundin: Regulation of the rulAB Mutagenic DNA Repair Operon of Pseudomonas syringae by UV-B (290 to 320 Nanometers) Radiation and Analysis of rulAB-Mediated Mutability In Vitro and In Planta. Journal of Bacteriology 182 (21), 2000, S. 6137–6144, PMID 11029435, PMC 94749 (freier Volltext).
- P. Bayman: Diversity, Scale and Variation of Endophytic Fungi in Leaves of Tropical Plants. In: M. J. Bailey, A. K. Lilley et al. (Hrsg.): Microbial Ecology of Aerial Plant Surfaces. CAB International, Wallingford/Oxfordshire 2006, ISBN 978-1845930615, S. 37–50.
- R. W. S. Weber, H. Anke: Effects of Endophytes on Colonisation by Leaf Surface Microbiota. In: M. J. Bailey, A. K. Lilley et al. (Hrsg.): Microbial Ecology of Aerial Plant Surfaces. CAB International, Wallingford/Oxfordshire 2006, ISBN 978-1845930615, S. 209–222.
- Steven E. Lindow: Phyllosphere Microbiology: A Perspective. In: M. J. Bailey, A. K. Lilley et al. (Hrsg.): Microbial Ecology of Aerial Plant Surfaces. CAB International, Wallingford/Oxfordshire 2006, ISBN 978-1845930615, S. 1–20.
- S. S. Hirano, C. D. Upper: Bacteria in the Leaf Ecosystem with Emphasis on Pseudomonas syringae – a Pathogen, Ice Nucleus, and Epiphyte. Microbiology and Molecular Biology Reviews 64 (3), 2000, S. 624–653, online
- P. K. Mohapatra: Textbook of Environmental Microbiology. I K International Publishing House Pvt. Ltd., New Delhi 2008, ISBN 978-8190656672, S. 183.
- Ian P. Thompson, Mark J. Bailey et al.: Short-term community dynamics in the phyllosphere microbiology of field-grown sugar beet. FEMS Microbiology Ecology 16, 2005, S. 205–211.
- J. Inácio, P. Pereira et al.: Estimation and diversity of phylloplane mycobiota on selected plants in a Mediterranean-type ecosystem in Portugal. Microbial Ecology 44 (4), 2002, S. 344–353.
- Robert Lücking, Marcela Cáceres: Folicolous lichens of the world, Web-Version (PDF; 2,8 MB)
- Tamás Pócs: Epiphyllous liverwort diversity at worldwide level and its threat and conservation. Anales del Instituto de Biologia, Universidad Nacional Autonoma de Mexico, Serie Botanica, 67 (1), 1996, S. 109–127, online (PDF; 1,1 MB)
- Jeff Duckett: Epiphyllic and epifungal liverworts on Hampstead Heath, London. Field Bryology 95, 2008, S. 8–10 online (PDF; 166 kB)
- Markus Riederer, Caroline Müller (Hrsg.): Biology of the plant cuticle. Blackwell Pub., Oxford 2006, ISBN 978-1405132688, S. 105.
- Uno H. Eliasson: Myxomyceten auf lebenden Blättern im tropischen Regenwald Ecuadors; eine Untersuchung basierend auf dem Herbarmaterial höherer Pflanzen. In: Stapfia. Band 73, Linz 2000, S. 81–84, zobodat.at [PDF]
- Martin Schnittler: Foliicolous liverworts as a microhabitat for Neotropical Myxomycetes. Nova Hedwigia 72 (1–2), 2001, S. 259–270, online (Memento vom 10. Mai 2015 im Internet Archive) (PDF; 107 kB)
- Robert Lücking, Andrea Bernecker-Lücking: Lichen feeders and lichenicolous fungi: do they affect dispersal and diversity in tropical foliicolous lichen communities? Ecotropica 6, 2000, S. 23–41.
- B. J. Jacobsen: Biological Control of Plant Diseases by Phyllosphere Applied Biological Control Agents. In: M. J. Bailey, A. K. Lilley et al. (Hrsg.): Microbial Ecology of Aerial Plant Surfaces. CAB International, Wallingford/Oxfordshire 2006, ISBN 978-1845930615, S. 131–147.
- T. S. Schubert: Strigula fries, the plant parasitic lichen. Plant Pathology Circular 227, 1981, 2 S., online (Memento vom 3. Dezember 2010 im Internet Archive) (PDF; 131 kB)
- M. A. Holland, R. L. G. Long, J. C. Polacco: Methylobacterium spp.: phylloplane bacteria involved in cross-talk with the plant host? In: Steven E. Lindow, Eva I. Hecht-Poinar, Vern J. Elliot (Hrsg.): Phyllosphere microbiology. APS Press, St. Paul, Minn., 2002, ISBN 978-0-89054-286-6, S. 125–135.
- Elke Freiberg: Microclimatic parameters influencing nitrogen fixation in the phyllosphere in a Costa Rican premontane rain forest. Oecologia 17, 1998, S. 9–18
- Michel Fürnkranz, Wolfgang Wanek et al.: Nitrogen fixation by phyllosphere bacteria associated with higher plants and their colonizing epiphytes of a tropical lowland rainforest of Costa Rica. The ISME Journal 2, 2008, S. 561–570, online
- Maria T. Brandl: Human Pathogens and the Health Threat of the Phyllosphere. In: M. J. Bailey, A. K. Lilley et al. (Hrsg.): Microbial Ecology of Aerial Plant Surfaces. CAB International, Wallingford/Oxfordshire 2006, ISBN 978-1845930615, S. 269–285.
- T. Müller, K. Strobel, A. Ulrich: Microorganisms in the Phyllosphere of Temperate Forest Ecosystems in a Changing Environment. In: M. J. Bailey, A. K. Lilley et al. (Hrsg.): Microbial Ecology of Aerial Plant Surfaces. CAB International, Wallingford/Oxfordshire 2006, ISBN 978-1845930615, S. 51–65.
- D. Fowler, J. N. Cape et al.: Atmospheric Composition and the Phyllosphere: the Role of Foliar Surfaces in Regulating Biogeochemical Cycles. In: M. J. Bailey, A. K. Lilley et al. (Hrsg.): Microbial Ecology of Aerial Plant Surfaces. CAB International, Wallingford/Oxfordshire 2006, ISBN 978-1845930615, S. 305–315.
- Franco Baldi, Maria A. Bianco, Milva Pepi: Mercury, arsenic and boron resistant bacteria isolated from the phyllosphere as positive bioindicators of airborne pollution near geothermal plants. In: Science of the Total Environment, 164 (2), 1995, S. 99–107, doi:10.1016/0048-9697(95)04426-2.
