Arecolin
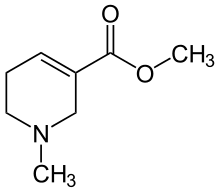
Arecolin ist eine chemische Verbindung aus der Gruppe der Alkaloide. Es ist der Methylester des Arecaidins und wirkt auf das vegetative Nervensystem als Acetylcholinrezeptor-Agonist. Arzneilich verarbeitet wurden die wasserlöslichen Salze (Arecolinhydrobromid, Arecolinhydrochlorid); als freie Base ist die Substanz eine ölige Flüssigkeit.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Arecolin | |||||||||||||||||||||
| Andere Namen |
Methyl-1-methyl-1,2,5,6-tetrahydro-3-pyridincarboxylat (IUPAC) | |||||||||||||||||||||
| Summenformel | C8H13NO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 155,19 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen und Geschichte
.jpg.webp)
Arecolin kommt in den Steinkernen der Früchte der Betelnusspalme natürlich vor. Es wurde erstmals 1888 von Ernst Friedrich Jahns isoliert.
Synthese
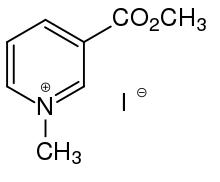
Jahns erhitzte Nicotinsäuremethylester mit Methyliodid und reduzierte das entstandene N-Methylpyridiniumsalz (das „Jodmethylat“) mit Zinn und Salzsäure.[5] Die Lage der C=C-Doppelbindung war jedoch damit nicht bewiesen.
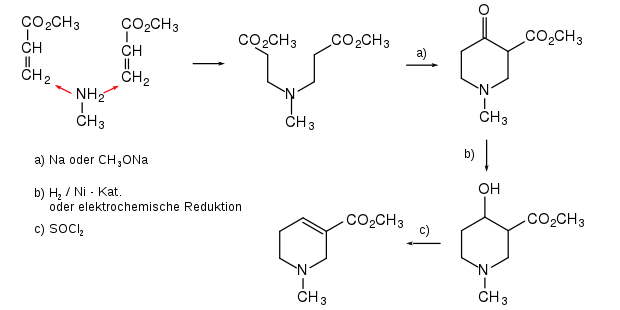
A. Johnson, ein Doktorand von Alfred Wohl, synthetisierte Arecolin aus Methylamin in mehreren Reaktionsschritten.[6]
Von der Wohl-Johnson-Synthese wurden mehrere Alternativen ausgearbeitet.[7] Besonders effizient ist die im Jahr 1957 publizierte Synthese von Preobraschenskii und Mitarbeitern.[8][9] Die russischen Forscher gingen ebenfalls von Methylamin aus, das an Methylacrylat addiert wurde. Der gebildete 4-Aza-heptandisäuredimethylester (im Original: Methyl-di-(beta-carbethoxyethyl)-amine) wurde der Dieckmann-Kondensation unterworfen, wodurch der Piperidin-Ring geschlossen wurde. Reduktion der Carbonylgruppe ergab ein Piperidinol, welches dehydratisiert wurde. Arecolin wurde u. a. als Hydrobromid isoliert. Ersetzte man Methylamin durch andere primäre Amine, so erhielt man Analoga des Arecolins, d. h. die Methylgruppe am Stickstoffatom wurde durch die entsprechenden Substituenten ersetzt.
Jahns' Versuch aus dem Jahr 1888, Arecolin durch Reduktion von N-Methylpyridinium-3-carbonsäuremethylesteriodid zu gewinnen, konnte verbessert werden, nachdem Kaliumborhydrid zugänglich geworden war. Dieses Reagens führte zur selektiven Addition von Wasserstoffatomen an die Positionen 2, 5 und 6 des Pyridiniumsalzes.[10][11][12]
Molekülstruktur
Auf Grund der Synthesen bestanden keine Zweifel an der Konstitution von Arecolin. Wegen der pharmakologischen Bedeutsamkeit des Alkaloids wurden mehrere spektroskopische Untersuchungen und Berechnungen zur Struktur unternommen. Vom Hydrobromid des Arecolins wurde eine Röntgenstrukturanalyse angefertigt.[13] Das durch Umsetzung von Arecolin mit Methyliodid erhaltene quartäre Ammoniumsalz (Arecolin-methoiodid) zeigt laut Röntgen-Kristallstrukturanalyse eine Halbsessel-Konformation des Piperidin-Rings.[14]
Verwendung

In vielen asiatischen Kulturen werden unreife Betelnüsse kleingehackt, in mit gelöschtem Kalk bestrichene Blätter des Betelpfeffers gerollt und dann als Betelbissen gekaut. Arecolin als die darin aktive Substanz wirkt auf den Konsumenten ähnlich wie Nicotin.
In der Veterinärmedizin diente Arecolin als Anthelmintikum. So wurde es zur Entwurmung von Nutztieren, wie Hunden eingesetzt. In dieser Funktion wird es jedoch nicht mehr verwendet.[15] Dabei kam das auch schwer resorbierbare Salz (Arecolinacetarsol) zum Einsatz.[16]
Wirkung
Arecolin hat eine dem Nicotin vergleichbare Wirkung; dieses wirkt jedoch primär auf den nikotinischen Acetylcholinrezeptor, während Arecolin ein Partialagonist der muskarinischen Acetylcholinrezeptoren ist und damit vor allem auf die – für die parasympathetischen Effekte des Alkaloids wie Pupillenkonstriktion (Musculus sphincter pupillae), Bronchialkonstriktion etc. verantwortlichen – Acetylcholinrezeptoren M1, M2, M3 und M4[17][18][19] wirkt.
Andere Toxine, die an Acetylcholinrezeptoren wirken, sind u. a. das Anatoxin A einiger Cyanobakterien, das Coniin des Gefleckten Schierlings, Cytisin des Goldregens, Epibatidin der Baumsteigerfrösche sowie Curare.[20][21][22][23][24]
Literatur
- The Alkaloids: Chemistry and Physiology. Volume 1 (1965)
Einzelnachweise
- Datenblatt Arecoline hydrobromide bei Sigma-Aldrich, abgerufen am 14. Mai 2017 (PDF).
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 127, ISBN 978-0-911910-00-1.
- Eintrag zu Arecolin bei Vetpharm, abgerufen am 18. April 2012.
- Peter Nuhn: Naturstoffchemie, S. Hirzel Wissenschaftliche Verlagsgesellschaft, Stuttgart, 2. Auflage, 1990, S. 563, ISBN 3-7776-0473-9.
- E. Jahns: Über die Alkaloide der Arekanuß. In: Archiv der Pharmazie. 229, 1891, S. 669–704, doi:10.1002/ardp.18912290812.
- A. Wohl, A. Johnson: Über Arecaidin und Arecolin, in: Berichte der deutschen chemischen Gesellschaft, Volume 51, Issue 1 S. 4712–4719. doi:10.1002/cber.190704004119
- The Alkaloids: Chemistry and Physiology V1: Chemistry and Physiology. Academic Press, 1. Januar 1965, ISBN 978-0-08-086525-6, S. 174ff..
- N. A. Preobrazhensky, K. M. Malkow, M. E. Maurit, M. A. Vorobyev, A. S. Vlazov: Synthesis of Alkaloid Arecoline and its Homologs, In: Journal of General Chemistry of the USSR (englische Übersetzung) Jg. 1957, Bd. 27, S. 3200–3206.
- M. E. Maurit, N. A. Preobrazhenskii, Synthesis of N-Methyl-3-carbomethoxy-4-hydroxypiperidines and a Study of their steric Structures, In: Journal of General Chemistry of the USSR (englische Übersetzung) Jg. 1958, Bd. 28, S. 943–948.
- J. J. Panouse, Comptes Rendus Heptomadaires des Séances de l'Acadadémie des Sciences 1951, Bd. 233, 1200. Zitiert nach I. A. Kozello, A. Ya. Gasheva, V. I. Khmelevskii: Improvement of the Synthesis of Nicotinic Acid, In: Pharm. Chem. Journal, 1976, Bd. 10, S. 1515–1516. Englische Übersetzung aus Khimiko-Farmatsevticheskii Zhurnal 1976, Bd. 10, S. 90–91.
- Nadao Kinoshita et al. Chemical and Pharmaceutical Bulletin (Tokyo) 1962, Bd. 8, S. 753. Zitiert nach I. A. Kozello, A. Ya. Gasheva, V. I. Khmelevskii: Improvement of the Synthesis of Nicotinic Acid, In: Pharm. Chem. Journal, 1976, Bd. 10, S. 1515–1516. Englische Übersetzung aus Khimiko-Farmatsevticheskii Zhurnal 1976, Bd. 10, S. 90–91.
- I. A. Kozello, A. Ya. Gasheva, V. I. Khmelevskii: Improvement of the Synthesis of Nicotinic Acid, In: Pharm. Chem. Journal, 1976, Bd. 10, S. 1515–1516. Englische Übersetzung aus Khimiko-Farmatsevticheskii Zhurnal 1976, Bd. 10, S. 90–91.
- R. W. Baker, C. H. Chotia, P. Pauling, T. J. Petcher: Structure and Activity of Muscarinic Stimulants. in: Nature (London) Jg. 1971, Bd. 230, 439–445. doi:10.1038/230439a0
- D. J. H. Mallard, D. P. Vaughan, T. A. Hamor: Crystal and Molecular Structure of Arecoline Methiodide, In: Acta Chrystallographica, Jg. 1975, Bd. B31, S. 1109–1112.
- G. W. A. Milne: Gardner's Commercially Important Chemicals: Synonyms, Trade Names, and Properties. John Wiley & Sons, 2 September 2005, ISBN 978-0-471-73661-5, S. 44–.
- Pharmakotherapie bei Haus und Nutztieren - Begründet von W. Löscher, F.R. Ungemach und R. Kroker. W. Löscher, H. Potschka, A. Richter (Hrsg. ) 9. Auflage, Georg Thieme Verlag 2014. S. 384.
- Yang YR, Chang KC, Chen CL, Chiu TH.: Arecoline excites rat locus coeruleus neurons by activating the M2-muscarinic receptor.. In: Chin J Physiol.. 43, Nr. 1, 2000, S. 23–8. PMID 10857465.
- Xie DP, Chen LB, Liu CY, Zhang CL, Liu KJ, Wang PS.: Arecoline excites the colonic smooth muscle motility via M3 receptor in rabbits.. In: Chin J Physiol.. 47, Nr. 2, 2004, S. 89–94. PMID 15481791.
- K. C. Raffaele, A. Berardi, P. P. Morris, S. Asthana, J. V. Haxby, M. B. Schapiro, S. I. Rapoport, T. T. Soncrant: Effects of acute infusion of the muscarinic cholinergic agonist arecoline on verbal memory and visuo-spatial function in dementia of the Alzheimer type. In: Progress in neuro-psychopharmacology & biological psychiatry. Band 15, Nummer 5, 1991, S. 643–648, PMID 1956992.
- R. Aráoz, J. Molgó, N. Tandeau de Marsac: Neurotoxic cyanobacterial toxins. In: Toxicon. Band 56, Nummer 5, Oktober 2010, S. 813–828, doi:10.1016/j.toxicon.2009.07.036, PMID 19660486 (Review).
- B. T. Green, S. T. Lee, K. D. Welch, J. A. Pfister, K. E. Panter: Fetal muscle-type nicotinic acetylcholine receptor activation in TE-671 cells and inhibition of fetal movement in a day 40 pregnant goat model by optical isomers of the piperidine alkaloid coniine. In: The Journal of pharmacology and experimental therapeutics. Band 344, Nummer 1, Januar 2013, S. 295–307, doi:10.1124/jpet.112.199588, PMID 23086230.
- R. L. Papke, F. Ono, C. Stokes, J. M. Urban, R. T. Boyd: The nicotinic acetylcholine receptors of zebrafish and an evaluation of pharmacological tools used for their study. In: Biochemical pharmacology. Band 84, Nummer 3, August 2012, S. 352–365, doi:10.1016/j.bcp.2012.04.022, PMID 22580045, PMC 3372685 (freier Volltext).
- V. Gerzanich, X. Peng, F. Wang, G. Wells, R. Anand, S. Fletcher, J. Lindstrom: Comparative pharmacology of epibatidine: a potent agonist for neuronal nicotinic acetylcholine receptors. In: Molecular pharmacology. Band 48, Nummer 4, Oktober 1995, S. 774–782, PMID 7476906.
- A. Trautmann: Curare can open and block ionic channels associated with cholinergic receptors. In: Nature. Band 298, Nummer 5871, Juli 1982, S. 272–275, PMID 6283380.