Pflanzliche Abwehr von Herbivoren
Die pflanzliche Abwehr von Herbivoren (Fraßverteidigung) basiert wie die pflanzliche Abwehr von Pathogenen auf zahlreichen Mechanismen, die in vielen Fällen artspezifisch sind. Ihr Verständnis ist von wirtschaftlichem Interesse, weil weltweit erhebliche Teile der Ernte durch Insektenfraß (13 %) und Pflanzenkrankheiten (12 %) vernichtet werden.[1] Die Evolution selektiert Pflanzen wie alle Lebewesen nach ihrem Fortpflanzungserfolg, der bei Pflanzen ökologisch durch Symbiosen mit Pilzen (Mykorrhiza) und bestäubenden Insekten (Bestäubung) ebenso wie durch erfolgreiche Verteidigung gegen Pflanzenfresser (Herbivoren) und Pathogene erreicht werden kann. Das Verhältnis zwischen Pflanzen und ihren Herbivoren oder Pathogenen kann als eine Art Wettrüsten verstanden werden. Diese Koevolution führt in den meisten Ökosystemen zu einer Situation, in der die Pflanzen und ihre Herbivoren überleben können.

Konstitutive Abwehr
Morphologische Aspekte

Die pflanzlichen Abwehrmechanismen sind wie tierische Immunreaktionen teils konstitutiv und teils induziert. Die konstitutive Abwehr wirkt vorbeugend und ist bereits vor Interaktionen mit Herbivoren aktiv. Sie wird morphologisch durch Bildung von Stacheln (zum Beispiel bei Rosen und Brombeeren), Dornen (zum Beispiel bei Schlehe, Wildbirne und Kakteen) oder verhärteten Trichomen (zum Beispiel bei Kreuzblütlern) realisiert. Die Brennnessel bildet als Brennhaare spezialisierte Trichome, deren Spitze bei Berührung abbricht; der verbleibende Schaft wirkt wie eine Injektionskanüle, aus der irritierende Substanzen wie Histamin, Acetylcholin und Ameisensäure freigesetzt werden. Nach einer Verwundung nimmt die Dichte der Brennhaare auf allen sich neu entwickelnden Blättern zu.[2] Dies ist bereits ein Beispiel für die induzierte Abwehrreaktion. Weitere mechanische Resistenzfaktoren sind verholzte oder verkieselte Zellwände, die als eine physikalische Barriere gegen Blattfraß wirken können.
Sekundärmetabolite
Die chemische Basis für die konstitutive Abwehr liefern zahlreiche Sekundärmetabolite, die in Bezug auf Struktur, Wirkungsweise und Vorkommen stark variieren:
20 % der Gefäßpflanzen bilden Alkaloide, von denen die meisten Abwehrsubstanzen darstellen. Fast alle dieser Substanzen können auf Menschen toxisch wirken. In geringeren Konzentrationen werden jedoch einige, darunter Nicotin, Kokain und Morphin, pharmakologisch oder als Rauschmittel genutzt. Die Wirkungsweisen sind gut erforscht. Zum Beispiel hemmt Nicotin die synaptische Übertragung in den Nerven aufgrund der chemischen Verwandtschaft mit dem Neurotransmitter Acetylcholin und erhöht unter anderem die Adrenalinsekretion. Andere Alkaloide beeinflussen den Membrantransport, die Proteinsynthese oder die Aktivität von Enzymen.
Leguminosen bilden Isoflavone, die aus einem aromatischen Ringsystem bestehen. Die Isoflavone in Klee-Arten können bei Schafen Unfruchtbarkeit bewirken, indem sie aufgrund ihrer Strukturähnlichkeit zu Steroiden an die Östrogen-Rezeptoren binden. Dadurch wird in diesem Fall die Population der Herbivoren langfristig verringert. Andere Isoflavone wie Rotenoide sind insektizid. Als Phytoalexine schützen manche Isoflavone die Pflanzen vor Infektionen durch Pilze oder Bakterien.
Tannine sind im Pflanzenreich weit verbreitete phenolische Polymere, die bevorzugt in unreifen Früchten akkumulieren. Ihre Toxizität ist darauf zurückzuführen, dass sie unspezifisch an Proteine binden und somit insbesondere Verdauungsenzyme inaktivieren. Sie verursachen einen bitteren Geschmack und üben dadurch eine Abschreckungsfunktion aus. Die geringe Dosis an Tanninen in Rotweinen könnte jedoch für Blutgefäßerweiterungen verantwortlich sein und somit Herzinfarkten oder Hirnschlägen entgegenwirken.[3]

Viele Pflanzen speichern Sekundärmetabolite, aus denen bei Verwundung unmittelbar Gifte gebildet werden. Hierzu gehören cyanogene Glycoside, die in den Vakuolen von Epidermoszellen gelagert werden. Durch Blattfraß brechen die Vakuolen auf und die cyanogenen Glykoside werden in das Cytoplasma freigesetzt, wo sie enzymatisch in Ketone und Blausäure (Cyanwasserstoff) umgesetzt werden. Es handelt sich um Abwehrstoffe, die häufig bei Gräsern (zum Beispiel Dhurrin in der Hirse), Leguminosen und Rosen vorkommen. Glucosinolate, die vor allem in Kreuzblütengewächsen akkumulieren, werden wie die cyanogenen Glykoside erst bei Beschädigung der Pflanze enzymatisch abgebaut. In diesem Fall entstehen hochreaktive und daher toxische Isothiocyanate und Nitrile. Steinklee (Melilotus spec.) und Waldmeister (Galium odoratum) speichern in ihren Vakuolen o-Cumarsäure-Glucosid. Bei Verwundung und somit Zerstörung der Zellkompartimente kommt diese Verbindung in Kontakt mit Glucosidasen aus der Zellwand. Die Enzyme katalysieren die Umsetzung des Glucosids in o-Cumarsäure, die spontan zum toxischen Cumarin weiterreagiert.[4]
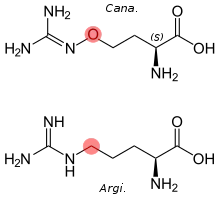
Nicht-proteinogene Aminosäuren wie Canavanin stellen eine weitere Gruppe von Abwehrstoffen dar. Canavanin ähnelt in seiner Struktur der Aminosäure Arginin und kann deshalb statt dieser in die Proteine der Herbivoren eingebaut werden, was zum tödlichen Verlust zahlreicher Proteinfunktionen führen kann. Pflanzen wie Canavalia ensiformis, die Canavanin in großen Mengen produzieren, weisen eine tRNA auf, die im Rahmen der Proteinsynthese nur Arginin und nicht Canavanin bindet, wodurch keine Gefahr der Selbstvergiftung besteht. Andere nicht-proteinogene Aminosäuren stören in Herbivoren die Synthese oder die Aufnahme von proteinogenen Aminosäuren.
Induzierte Abwehr
Jasmonsäure und induzierte Abwehrstoffe
Die induzierten Abwehrmechanismen der Pflanzen setzen als direkte Reaktion auf eine Beschädigung durch Herbivoren ein. Da sie nicht ständig ausgeprägt sind, müssen im Vergleich zur konstitutiven Abwehr relativ wenig Energie und Nährstoffe investiert werden.
In vielen Fällen reagiert Glutamin aus dem Speichel von angreifenden Insekten mit Fettsäuren aus den zerstörten Plasmamembranen der Pflanzenzellen zu Fettsäureamiden (Fettsäure-Aminosäure-Konjugate). Diese Verbindungen sind Elicitoren, die Abwehrreaktionen auslösen. Typischerweise induzieren sie die Produktion des Pflanzenhormons Jasmonsäure aus Linolensäure. Letztere ist Bestandteil von Membran-Lipiden. Die Synthese der Jasmonsäure beginnt in den Chloroplasten und wird in den Peroxisomen zu Ende geführt. Das Pflanzenhormon aktiviert seinerseits über Transkriptionsfaktoren die Synthese verschiedener Abwehrsubstanzen. Zu diesen gehören artabhängig verschiedene Alkaloide, Proteinase-Inhibitoren (darunter Inhibitoren der Verdauungsenzyme Trypsin und Chymotrypsin), verdauungsstörende Lektine und Inhibitoren der Stärke abbauenden alpha-Amylase. Untersuchungen an Macaranga tanarius haben gezeigt, dass eine durch Jasmonsäure induzierte Steigerung der Blattnektar-Produktion Fressfeinde und Parasiten der Herbivoren anlockt und somit weiterem Blattfraß entgegenwirkt.[5] Dies gilt wahrscheinlich auch für andere Blattnektar bildende Pflanzen wie Holunder, Baumwolle, Balsabaum, Cashew-Nuss oder Kirschbäume.
Systemin und systemische Reaktion
In der Tomate (Solanum lycopersicum L.) und weiteren Vertretern der Nachtschattengewächse führt Blattfraß zur Synthese von Proteinase-Inhibitoren und weiteren Abwehrverbindungen in der gesamten Pflanze, das heißt auch in unbeschädigten Organen. Für die systemische Abwehrreaktion in der Tomate wurde folgendes Modell entwickelt:[6]
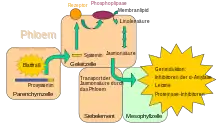
Die verwundeten Tomatenblätter synthetisieren Prosystemin, ein Protein aus 200 Aminosäuren. Durch eine proteolytische Spaltung am C-Ende wird aus Prosystemin das 18 Aminosäure große Systemin freigesetzt. Systemin wird aus den verletzten Zellen in die Zellwände freigesetzt. Im Phloemparenchym bindet es an einen Rezeptor in der Plasmamembran. Der Rezeptor aktiviert über eine Phosphorylierung eine ebenfalls in der Plasmamembran befindliche Phospholipase. Die Phospholipase spaltet aus den Membranlipiden Linolensäure ab, die schließlich in Jasmonsäure umgewandelt wird. Jasmonsäure wird durch das Phloem transportiert und erreicht auf diesem Weg sämtliche Gewebe, in denen sie die Gene zur Expression von Proteinase-Inhibitoren aktiviert. Der hier vorgestellte Systemin-Signalweg existiert nur in Solanaceen. Dennoch können systemische Reaktionen auch für andere Pflanzen (zum Beispiel bei Limabohne, Getreide- und Baumwollpflanzen-Arten) festgestellt werden. Die dahinter stehenden Mechanismen sind noch unbekannt.
Flüchtige organische Verbindungen
Alle Pflanzen reagieren auf mechanische Beschädigung mit der Freisetzung von flüchtigen Aldehyden, Alkoholen und Estern. Diese flüchtigen organischen Verbindungen (englisch VOC) locken in vielen Fällen natürliche Feinde der attackierenden Insekten an. Flüchtige organische Verbindungen, die nach der Eiablage von Schmetterlingen freigesetzt werden, wirken auf Weibchen der Schmetterlinge abschreckend, so dass eine weitere Eiablage und Herbivorie verhindert werden. Manche flüchtige organische Verbindungen bleiben an der Blattoberfläche gebunden und wirken aufgrund ihres Geschmacks abschreckend auf blattfressende Insekten. Pflanzen können ihre Herbivoren voneinander unterscheiden und auf diese unterschiedlich reagieren. Zum Beispiel produziert die wilde Tabak-Art (Nicotiana attenuata) gewöhnlich verstärkt Nicotin nach Herbivoren-Befall. Im Fall von Raupen, die eine Resistenz gegen Nicotin entwickelt haben, setzt die Tabakpflanze jedoch flüchtige Terpene frei, die auch zu den flüchtigen organischen Verbindungen gezählt werden. Diese Verbindungen locken wiederum Fressfeinde der Raupen an. Die Herbivoren werden von der Pflanze durch die Art der Verwundung oder aufgrund spezifischer Substanzen im Speichel erkannt. Bestimmte flüchtige organische Verbindungen können in benachbarten Pflanzen zur Induktion von Genen mit Abwehrfunktionen führen.
Pflanzliche Abwehrmechanismen – eine Frage der richtigen Investition
Die Produktion von Abwehrsubstanzen lohnt sich nur ab einer bestimmten Anzahl von Herbivoren oder Pathogenen, weil sie Energie und Nährstoffe erfordert. Das heißt, die Verteidigungsmaßnahmen einer Pflanze konkurrieren mit anderen physiologischen Prozessen wie Wachstum und Reproduktionsraten (Frucht- und Samenbildung) um die verfügbaren Ressourcen. Dies spiegelt sich in der Erfahrung wider, dass gezüchtete Nutzpflanzen gegenüber wild wachsenden Vorfahren zwar ertragreicher, aber dafür krankheitsanfälliger sind. Zudem haben Laborversuche gezeigt, dass resistenzerhöhende Mutationen in der Modellpflanze Arabidopsis thaliana zu verringerter Samenproduktion führen. Es muss noch erforscht werden, inwiefern durch Düngungsmaßnahmen ein durch erhöhte Resistenzen bedingter Ernterückgang vermieden werden kann.[7]
Siehe auch
Literatur
- Bob B. Buchanan, Wilhelm Gruissem, Russell L. Jones (Hrsg.): Biochemistry and molecular biology of plants. American Society of Plant Physiologists, Rockville MD 2000, ISBN 0-943088-37-2.
- Peter Schopfer, Axel Brennecke (d. i.: Axel Brennicke): Pflanzenphysiologie. 6. Auflage. Elsevier – Spektrum Akademischer Verlag, Heidelberg 2006, ISBN 3-8274-1561-6.
- Lincoln Taiz, Eduardo Zeiger: Plant Physiology. Sinauer, Sunderland, MA 2006, ISBN 0-87893-856-7.
- Borchard, F., Berger, A., Bunzel-Drüke, M. & T. Fartmann (2011): Diversity of plant-animal interactions: possibilities for a new plant defense indicator value? In: Ecological Indicators 11(5), S. 1311–1318.
Weblinks
- High Noon im Beet (DIE ZEIT, 24. Februar 2005, Nr. 9)
- BSA Online Image Collection, Plant Defence Mechanisms (Memento vom 7. September 2015 im Internet Archive)
Einzelnachweise
- D. Pimentel: Diversification of biological control strategies in agriculture. In: Crop protection. 10, 4, August 1991, S. 243–253, doi:10.1016/0261-2194(91)90001-8.
- Andreas Schaller: Die Abwehr von Fressfeinden: Selbstverteidigung im Pflanzenreich. In: Vierteljahresschrift der Naturforschenden Gesellschaft in Zürich. 147, 4, 2002, S. 141–150, online (PDF; 373 kB) (Memento des Originals vom 14. Dezember 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- Roger Corder, Julie A. Douthwaite, Delphine M. Lees, Noorafza Q. Khan, Ana Carolina Viseu dos Santos, Elizabeth G. Wood, Martin J. Carrier: Health: Endothelin-1 synthesis reduced by red wine. In: Nature. Band 414, Nr. 6866, Dezember 2001, S. 863–864, doi:10.1038/414863a.
- Philippe Matile: Das toxische Kompartiment der Pflanzenzelle. In: Naturwissenschaften. 71, 1, 1984, S. 18–24, doi:10.1007/BF00365975.
- Martin Heil, Thomas Koch, Andrea Hilpert, Brigitte Fiala, Wilhelm Boland, K. Eduard Linsenmair: Extrafloral nectar production of the ant-associated plant, Macaranga tanarius, is an induced, indirect, defensive response elicited by jasmonic acid. In: Proceedings of the National Academy of Sciences (PNAS). 98, 3, 2001, S. 1083–1088, doi:10.1073/pnas.98.3.1083.
- Lei Li, Chuanyou Li, Gyu In Lee, Gregg A. Howe: Distinct roles for jasmonate synthesis and action in the systemic wound response of tomato. In: PNAS. Band 99, Nr. 9, 30. April 2002, S. 6416–6421, doi:10.1073/pnas.072072599 (ODF [PDF]).
- M. Heil: Fitness costs of induced resistance: emerging experimental support for a slippery concept. In: Trends in Plant Science. Band 7, Nr. 2, 2002, S. 61–67, doi:10.1016/S1360-1385(01)02186-0 (PDF). PDF (Memento des Originals vom 23. September 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.