Seepocken
Seepocken fasst die Vertreter der festsitzenden (sessilen) Rankenfußkrebse, zusammen, die ohne Ausbildung eines Stiels dem Untergrund aufsitzen. Daran sind sie von den gestielten Entenmuscheln zu unterscheiden. Fast alle Seepocken sind durch ein verschließbares, aus Kalkplatten bestehendes Außenskelett eingehüllt und geschützt. Das darin sitzende Tier ernährt sich als Filtrierer von Plankton. Alle Seepocken leben im Meer, seltener im Brackwasser von Flussmündungen, sie fehlen im Süßwasser. Sie kommen von der zeitweise trockenfallenden Gezeitenzone bis in die Tiefsee, von der Arktis über die tropischen Breiten bis in die Antarktis weltweit vor. 2011 gab es knapp 450 Arten von Seepocken.[1]
| Seepocken | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

Fistulobalanus albicostatus | ||||||||||
| Systematik | ||||||||||
| ||||||||||
| Wissenschaftlicher Name | ||||||||||
| Sessilia | ||||||||||
| Lamarck, 1818 |
Körperbau

Seepocken[2] sind mit ihrem verbreiterten und abgeplatteten Vorderkopf senkrecht am Substrat festgewachsene Tiere. Der nach oben ragende Rumpf mit den langen Beinen ist im Leben eingeschlossen in eine aus verkalkten Platten bestehende Hülle, in die sich das Tier bei Störung oder beim Trockenfallen vollständig zurückziehen kann. Die Hülle wird nach außen abgeschieden durch ein beutel- oder sackförmiges, das Tier umschließendes Organ, das als Mantel bezeichnet wird (anatomisch dem Carapax der anderen Krebse entsprechend). Der Mantel besitzt nur eine einzige, schlitzartige Öffnung, durch die der Körper mit den Beinen nach oben herausgestreckt werden kann. Mit den Beinen filtert der Organismus seine Nahrung aus dem Wasser. Die meisten Seepocken können mit ihrer Hilfe eine Wasserströmung in ihr Gehäuse hinein erzeugen, so dass sie die Beine nicht immer hervorstrecken und so möglichen Feinden aussetzen müssen.
Der Kopf der Seepocken ist in zwei Abschnitte gegliedert. Der Vorderkopf haftet fest an der Unterlage des Tiers. Unter dieser Haftscheibe sind meist Rudimente der ersten Antennen (Antennulae) erkennbar, mit deren Hilfe sich die Seepocken-Larve am Beginn ihres Wachstums festgeheftet hatte. Die sonst für Krebse typischen zweiten Antennen fehlen vollständig, auch andere Sinnesorgane wie die Augen sind zurückgebildet. Zum Hinterkopf hin ist der Kopfabschnitt meist ringförmig abgeschnürt und geknickt, wodurch der Mundkegel mit den Mundwerkzeugen nach oben zeigt. An diesem Knick innerhalb des Kopfes ist das Tier in sich beweglich. Die Mundwerkzeuge bestehen aus einfachen, ungegliederten Platten. Am breiten Hinterende des Vorderkopfs entspringt der das Tier einhüllende Mantel. Dieser ist sowohl an der Oberseite (dorsal) wie an der Unterseite (ventral) verwachsen und lässt nur am Hinterende einen Spalt offen. Der Mantel umschließt einen sackartigen Raum, die Mantelhöhle, in der der Rest des Leibs liegt.
Der Rumpf (oder Thorax) besteht aus sechs beintragenden Segmenten. Ein Hinterleib (oder Abdomen) fehlt vollständig, am Hinterende des Thorax sitzen nur zwei, meist vielgliedrige sog. Caudalanhänge an. Die sechs Rumpfbeinpaare oder Thorakopoden sind als für Krebstiere typische Spaltbeine ausgebildet. Beide Beinäste, Endopod und Exopod genannt, sind bei den Seepocken sehr ähnlich gebaut. Sie bestehen aus sehr zahlreichen, dicht mit Borsten besetzten Gliedern, Cirren genannt. Am festsitzenden Tier haben die Beine jede Funktion für die Fortbewegung verloren und dienen ausschließlich der Nahrungsaufnahme. Die Cirren können durch Innendruck der Hämolymphe ausgestreckt und durch Muskelbewegung eingerollt werden. Sie werden entweder in einer aktiven Bewegung durchs Wasser gezogen oder als Filterkorb unbeweglich in eine Wasserströmung gehalten. Hängenbleibende Nahrungspartikel, Plankton-Organismen und organischer Detritus werden ausgekämmt.
In Ruhe ist der Rumpf der Tiere unsichtbar in die verkalkte Hülle zurückgezogen. Diese besteht aus zwei Teilen. Als erster Teil wird ihr Rand aus ringförmig verwachsenen Kalkplatten gebildet, zusammen „Mauerkrone“ genannt. Diese sind in sich unbeweglich und fest auf der harten Unterlage festzementiert. Je nach systematischer Gruppe wird auch auf der Unterseite eine damit verbundene kalkige Platte abgeschieden, oder diese fehlt und das Tier sitzt direkt dem Untergrund auf. Beim Wachsen häutet sich die Seepocke nur auf der Innenseite, die kalkige Mauerkrone bleibt, einmal gebildet, erhalten. Sie wächst aber vom Rand her mit, wodurch auf den Platten Zuwachsstreifen erkennbar werden. Als zweiter Teil ist die Mauerkrone oben durch einen mehrteiligen, beweglichen Deckel, Operculum genannt, verschlossen. In der Regel sind zwei Paar bewegliche Platten vorhanden, die größeren Scuta (Einzahl: Scutum) und die kleineren Terga (Einzahl: Tergum). Scuta und Terga jeder Seite können zur Seite gezogen werden und legen dabei eine schlitzförmige Öffnung frei, durch die der Rumpf mit den Cirren vorgestreckt werden kann. Im Grundplan besteht die randliche, unbewegliche Mauerkrone aus acht Platten. Die einzelne (unpaare) Platte an der (anatomischen) Vorderseite des Tiers heißt Carina, die entgegengesetzte an der Hinterseite Rostrum. Dazwischen liegen drei seitliche Paare von Platten, Carinolaterale, Laterale und Rostrolaterale genannt. Je nach systematischer Gruppe können einzelne der seitlichen Paare zurückgebildet sein, wodurch die Mauerkrone dann nur aus sechs, oder vier, Platten besteht. Manchmal sind auch alle zu einem einheitlichen, kegelförmigen Gebilde ohne erkennbare Nähte verschmolzen, meist sind sie aber durch nicht verkalkte, Radien genannte Zwischenstücke voneinander getrennt. Einen abweichenden Bau zeigen die (relativ wenigen) Arten der Unterordnung Verrucomorpha. Bei diesen ist das Gehäuse asymmetrisch; nur Scutum und Tergum einer Körperseite bilden ein bewegliches Operculum, diejenigen der anderen Seite bilden mit Carina und Rostrum die Mauerkrone aus.
Fortpflanzung und Entwicklung
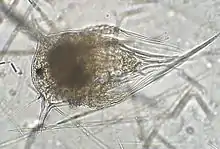


Alle Seepocken sind Zwitter, die sich gegenseitig befruchten. Sie sind oft protandrisch, d. h. dasselbe Individuum zuerst funktional männlich und später weiblich. Bei wenigen Gattungen, etwa Solidobalanus und Conopea, sind zusätzlich Zwergmännchen nachgewiesen worden.[3] Nicht wenige, besonders in der Gezeitenzone, sind simultane Hermaphroditen, also gleichzeitig männlich und weiblich.[4] Bei einigen Arten ist alternativ auch Selbstbefruchtung nachgewiesen; da diese in kleineren Gelegen und weniger kräftigem Nachwuchs resultiert, wird sie nur in Notsituationen, wenn keine anderen Seepocken benachbart wachsen, eingesetzt.[5] Bei der Kopulation gibt der männliche Partner das Sperma nicht ins umströmende Wasser, sondern direkt in die Mantelhöhle des weiblichen ab (innere Befruchtung). Der Partner muss sich aufgrund der Ortsgebundenheit des adulten Tieres also in unmittelbarer Nähe befinden. Die männlichen Partner tasten mit dem Penis, der mit bis zu achtfacher Körperlänge relativ zur Körpergröße zu den längsten im Tierreich gehört[6], den Platz um sich herum ab und suchen nach anderen Seepocken. Der weibliche gibt dafür anlockend wirkende Substanzen ins Wasser ab.
Der Penis entspringt zwischen dem sechsten Cirrenpaar am Hinterende des Rumpfs der Tiere. Er ist rüsselartig, durch Längsmuskulatur hoch beweglich und aus ringförmigen Abschnitten aufgebaut, durch die er verlängert oder zurückgezogen werden kann, er trägt daran Ringel aus Sinnesborsten. Die verstärkten Ringe geben ihm zudem mechanische Stabilität.[5] Bei den besonders gut untersuchten Seepocken der Brandungszone der Meeresküste ist Wellenschlag ein besonderes Problem, diese Arten haben daher einen kürzeren, aber stabileren Penis.[6] In geschützten Lagen werden sie dafür häufiger von Räubern abgebissen. Befinden sich keine Seepocken in unmittelbarer Nähe, kann er mittels phänotypischer Plastizität individuell weiter verlängert werden.
Die Eier der Seepocken sind dotterreich und telolecithal, das bedeutet, der Dotter ist an einem Eipol konzentriert. Die ersten Teilungen des sich entwickelnden Embryo sind daher ungleich (inaequal). Die Eientwicklung erfolgt innerhalb von Eilamellen in der Mantelhöhle des Muttertiers. Ins freie Wasser abgegeben wird erst das erste Larvenstadium, eine (für die Krebstiere typische) Nauplius-Larve. Die Abgabe der Nauplii erfolgt oft synchronisiert, sie wird manchmal durch Algenblüten im umgebenden Wasser ausgelöst. Andere geben Larven, unsynchronisiert, zu jeder Zeit des Jahres ab. Die Nauplii schwimmen im freien Wasser (pelagisch), sie gehören also zum Zooplankton. Die Larven durchlaufen sechs Naupliusstadien, an deren Ende sie sich jeweils häuten und an Größe zunehmen, meist innerhalb von ein bis drei Wochen. Die Nauplii der Cirripedier sind von denjenigen anderer Krebse meist an drei Dornen, zwei paarigen frontolateralen Hörnern und einem Schwanzstachel, unterscheidbar. Die drei Extremitätenpaare dienen sowohl zum (ruckartigen) Schwimmen wie zum Fangen der Nahrung.[7]
Das letzte, sechste Nauplius-Stadium metamorphisiert schließlich in ein weiteres, morphologisch anders gebautes weiteres Larvenstadium, die langgestreckte Cypris-Larve (bei einigen Arten verbleiben die Naupliuslarven im Muttertier oder sind ganz zurückgebildet, so dass ausschließlich Cypris-Larven freigesetzt werden[4]). Cypris-Larven sind eine Besonderheit der Rankenfußkrebse. Der Name leitet sich ab von Cypris, einer (nicht näher verwandten) Gattung der Ostrakoden oder Muschelkrebse, die in der Gestalt ähnlich sind und daher von den frühesten Bearbeitern verwechselt worden waren. Cypris-Larven der Seepocken sind etwa 600 Mikrometer lang. Sie wird auf der Oberseite eingehüllt von einem schildartigen Panzer (Carapax). Auf der Oberseite trägt er zahlreiche Borsten (Setae), deren Anordnung wichtig ist für die Artbestimmung. Die Cypris-Larve besitzt zusätzlich zum unpaaren Naupliusauge ein Paar kleiner Komplexaugen aus jeweils 10 bis 12 Ommatidien. Sie besitzen ein Paar Antennen (die zweiten Antennen oder Antennulae, die beim Nauplius vorhandenen ersten werden zurückgebildet). Sie besitzen zudem die Mundwerkzeuge und sechs Paare von Rumpfbeinen, ebenso wie die festsitzenden adulten Seepocken. Diese dienen ihnen als Schwimmbeine zur Fortbewegung, sie können erheblich schneller Schwimmen als die Nauplii. Cypris-Larven nehmen keinerlei Nahrung auf, sie ernähren sich ausschließlich durch im Nauplius-Stadium akkumulierte Vorräte. Ihre Funktion ist die Suche nach einem geeigneten Anheftungsplatz für das festsitzende Adulttier. Sie können dazu einige Wochen aktiv schwimmen. Ist eine geeignete Stelle erreicht, fixiert sich das Tier mittels Haftscheiben, die am dritten Antennensegment ansitzen. Die Anheftung erfolgt mittels eines flüssigen, später erhärtenden, Zement genannten Klebstoffs aus Proteinen, dieser wird von paarigen Zementdrüsen abgeschieden. Die festsitzende Cypris-Larve durchläuft nun eine zweite Metamorphose zum Adulttier.[8]
Ökologie und Lebensweise
Seepocken sind typischerweise aktive oder passive Filtrierer. Als solche haben sie eine Vielzahl von marinen Lebensräumen erschlossen (Darstellung nach[4]):
Seepocken der Felsküsten und Brandungsufer der Gezeitenzonen
Typisch und am besten bekannt ist das Vorkommen von Seepocken an Felsküsten, oft in der Gezeitenzone zeitweise trockenfallend. Seepocken-Arten bilden hier, nach Höhe und damit Dauer des Trockenfallens geordnet, gürtelartige Zonen aus jeweils wenigen dominanten Arten aus, die ungeheure Individuendichten erreichen können. Die meisten Seepocken-Arten von Fels- und Brandungsküsten sind kegelförmig, mit breiter Basis, um die Anheftungsfläche zu vergrößern. Spezialisten, wie Tetraclitella-Arten auf der Unterseite von Felsblöcken, sind stark abgeflacht. Seepocken der Felsküsten sind fast alle Filtrierer, die sich von Plankton ernähren. Meist sind bei ihnen die hinteren drei Cirrenpaare verlängert und dienen zum Beutefang, je nach Art weisen sie dazu eine unterschiedliche, oft gefiederte oder verzweigte, Beborstung auf. Die vorderen drei sind kürzer (manchmal, etwas missverständlich Maxillipeden genannt) und dienen eher dem Transport und dem Sortieren der Nahrung. Die Nahrung wird dann von den kurzen, eingliedrigen Mundwerkzeugen zerkaut und in die Mundöffnung gestopft. Während einige Seepocken der Felsküsten sich auf passive Filtration im bewegten Wasser verlassen, bewegen viele andere ihre Cirren. Die passiven Filtrierer führen meist eine Art Fangschlag aus und ziehen die Cirren nur zurück, wenn Beute darin ist. Viele Arten führen aber rhythmische Schläge unabhängig davon aus.
An den Felsküsten der Nordsee zeigen die dort vorkommenden Seepocken-Arten eine charakteristische Zonierung nach der Höhe.[9][10] Diese ergibt sich aus der unterschiedlichen Resistenz gegenüber Wellenschlag, schwankendem Salzgehalt sowie Temperatur und Austrocknungsdauer in Verbindung mit unterschiedlicher Konkurrenzkraft der einzelnen Arten. In der gut durchlüfteten Brandungszone ist Semibalanus balanoides die häufigste Art. Noch oberhalb von dieser, in der nur selten vom Wasser erreichten Spritzwasserzone, können die Arten Chthamalus stellatus und Chthalamus montagui einen oberen Gürtel aufbauen. Unterhalb, vom Bereich der Mitteltiden-Niedrigwasserlinie an dominieren Balanus crenatus und Amphibalanus improvisus. Diese können bis in 40 bis 50 Meter Wassertiefe leben, kommen aber nur bis 50 bis 60 Zentimeter oberhalb der Niedrigwasserlinie vor. Im tieferen Wasser dominieren dann schließlich Balanus balanus und Verruca stroemia. Sie können nur manchmal in geschützten, beschatteten Lagen bis in den Bereich der Niedrigwasserlinie vordringen. Balanus balanus erreicht 300 Meter Wassertiefe.
Seepocken der Sand- und Mangrovenküsten
In geschützten, aus Weichsubstraten aufgebauten Küstenabschnitten tropischer und subtropischer Meere dominieren andere Seepocken als an den Felsküsten. Typisch sind Arten der Gattungen Euraphia (inkl. der kürzlich abgetrennten Microeuraphia) und Balanus mit schwächer gebauten, dünneren Skelettelementen. In diesen Lebensräumen mit geringer Strömungsgeschwindigkeit dominieren aktive Filtrierer, die ihre Cirren durch das Wasser ziehen, während an den Felsküsten mehr passive Filtrierer leben, die ihre Fangbeine einfach in die Strömung halten. Seepocken auf Mangroven sitzen auf der Unterseite von Blättern oder am Stamm, meist in Bereichen ohne direkte Sonneneinstrahlung.
Seepocken der Korallenriffe
Eine große Artenfülle von Seepocken-Arten sind spezialisierte Besiedler von Steinkorallen der Korallenriffe und kommen nur dort vor. Dazu gehören nahezu alle Arten der Familie Pyrgomatidae, sowie die Gattung Armatobalanus der Archaeobalanidae. Typischerweise sind sie auf der sichtbaren Oberseite flach und oft teilweise von Korallengewebe überwachsen, sind aber in der Tiefe röhrenartig in den Korallenkörper eingebettet. Sie ernähren sich wie typische Seepocken als Filtrierer, teilweise aber auch von abgegebenen Substanzen wie Schleim oder ausgestoßenen Zooxanthellen der Korallen selbst. Zumindest die Arten der Gattung Hoekia (Pyrgomatidae) haben die filtrierende Ernährung ganz aufgegeben und ernähren sich nur noch von Korallengewebe. Seepocken der Unterfamilie Acastinae (Archaeobalanidae), z. B. der Gattung Acasta sind ebenso hoch spezialisierte Besiedler von Schwämmen.
Seepocken der Tiefsee
In Tiefsee-Lebensräumen überwiegen gestielte Rankenfußkrebse der Scalpellomorpha. Es kommen aber auch eine Reihe ungestielter eigentlicher Seepocken vor. Die Arten der zu den Verrucomorpha gehörenden Familie Verrucidae sind hier häufiger als in flachen Gewässern. Viele sitzen auf anderen Organismen auf (epibiotisch), darunter andere Krebstiere, Asselspinnen, Mollusken und Seegurken. Eine Besonderheit sind die Seepocken-Arten an hydrothermalen Quellen der Riftzonen und mittelozeanischen Rücken. Diese filtrieren, soweit bekannt, die dort lebenden chemosynthetischen Bakterienarten, die die Basis der Nahrungskette bilden. Über die meisten Tiefseebewohner ist allerdings fast nichts zur Lebensweise bekannt.
Seepocken auf schwimmenden Meeresorganismen
Eine Reihe von Seepocken-Arten besiedeln die Panzer oder die paddelartigen Flossen von Meeresschildkröten oder die Haut von Walen. Auch dabei handelt es sich um Habitatspezialisten, die nirgendwo sonst leben können. Sie bilden einen eigenen Verwandtschaftskreis, die Überfamilie Coronuloidea mit den drei Familien Chelonibiidae, Platylepadidae und Coronulidae.[11] Bei den meisten sind die Platten des beweglichen „Deckels“ (Operculum) mehr oder weniger reduziert, bei einigen völlig rückgebildet. Bei der auf Delphinen lebenden Xenobalanus ist das gesamte Außenskelett reduziert zu einer sternförmigen Haltevorrichtung, die in die Haut der Wale eingebettet ist. Die Seepocken auf Walen und Schildkröten sind in ihrer Ernährung normale Filtrierer, sie leben nicht parasitisch vom Gewebe ihrer Wirte.
Feinde und Konkurrenten der Seepocken
Ebenso wie Seepocken epizoisch auf anderen Organismen aufwachsen, kann auch ihr Panzer Lebensraum sein. In der Gezeitenzone der britischen Felsküsten wächst dort häufig die schwarz gefärbte Flechte Arthropyrenia sublittoralis. Ein verbreiteter Parasit der britischen Seepocken ist die Asselart Hemioniscus balani. Diese hat einen komplexen Lebenszyklus. Junge Männchen dringen in die Mantelhöhle von Seepocken der Gezeitenzone ein, wo sie sich an den Ovarien festsetzt und zunächst von Körperflüssigkeiten des Wirts lebt. Bilden sich in den Ovarien der Seepocke die befruchteten Eier heran, wandelt sie sich in das immobile Weibchen um, das sich von den entwickelnden Eiern ernährt und so die Fortpflanzung der Seepocke verhindert. Im eigenen Brutraum bildet sie orange gefärbte Eier, bis schließlich fast nur ein gewaltiger Brutsack überbleibt, der die Mantelhöhle des Wirts ausfüllt.[9] Wichtige Konkurrenten der Seepocken an Felsküsten sind Miesmuscheln, deren Kolonien die Seepocken überwachsen und so verdrängen können.
Phylogenie, Taxonomie, Systematik
Die Seepocken gehören zu den Cirripedia oder Rankenfußkrebsen und dort in die Überordnung Thoracica. Die immer sessilen (festsitzenden) Rankenfußkrebse sind, bei den nicht-parasitischen Vertretern, fast immer gestielt, d. h. der Körper sitzt dem Substrat mit einem deutlich erkennbaren Stiel auf. Lange Zeit wurden daher innerhalb der Thoracica zwei Unterordnungen unterschieden, die ungestielten Sessilia und die gestielten Pedunculata (mit den Entenmuscheln als bekanntesten Vertretern).[12] Dass die ungestielten Rankenfußkrebse aus gestielten Vorfahren hervorgegangen sein müssen, wurde dabei schon lange vermutet, nicht zuletzt deshalb, weil die ältesten fossilen Vertreter alle gestielt sind. Obwohl die Monophylie der Pedunculata also schon lange umstritten ist, wurde an dem Taxon lange Zeit festgehalten, da kein anderes System Akzeptanz fand.
Lange Zeit wurde aber außerdem von anderen Forschern angenommen, dass auch die ungestielten Cirripedier nicht monophyletisch seien, d. h. dass sich die ungestielte Form mehrfach konvergent aus gestielten Vorfahren entwickelt hätte.[13] Problematisch war dabei insbesondere lange Zeit die Position der erst 1989 entdeckten Gattung Neoverruca, die mit nur zwei Arten in der Tiefsee, ausschließlich an hydrothermalen Quellen, den sog. „Schwarzen Rauchern“ leben. Wie andere Tiefseeformen besitzen sie zahlreiche plesiomorphe Merkmale wie zusätzliche Reihen von verkalkten Lateralplatten und wurden daher als „lebende Fossilien“ bezeichnet.[14] Auch die Stellung einer weiteren Tiefseeform, Neobrachylepas relicta[15] sorgte für Verwirrung, da sie mit der ausgestorbenen und nur fossil überlieferten Familie der Brachylepadidae in Verbindung gebracht wurde, die möglicherweise unabhängig von den rezenten Seepocken ungestielte Vertreter hervorgebracht hatte; heute erscheint es nach morphologischen Daten wahrscheinlich, dass Neobrachylepas seine Gestalt unabhängig von ähnlichen rezenten Seepocken, aber aus derselben Stammgruppe wie diese, erworben hat[16], nach molekularen Daten ist die Position weiter unsicher.[17] Sie wird daher, als einzige rezente Art in eine eigene Unterordnung gestellt.
Lässt man diese ungewöhnlichen Tiefseeformen beiseite, ergibt sich, entgegen früherer Vermutungen, eine klare Zweiteilung. Fast alle Seepocken gehören zu einer Unterordnung Balanomorpha (diese war von Charles Darwin noch als eine einzige Familie Balanidae aufgefasst worden, wird heute aber in zahlreiche Familien aufgesplittet). Die schon von Darwin als eigenständig erkannte Familie der Verrucidae bildet mit Neoverruca (und einigen ausgestorbenen, nur fossil überlieferten Vertretern) eine eigene Unterordnung Verrucomorpha. Balanomorpha und Verrucomorpha sind Schwestergruppen. Dies war, entgegen der Einstufung bei Darwin, von der Forschung, aufgrund der Interpretation fossiler Formen, lange Zeit wieder bestritten worden, bis William Newman die Hypothese 1987 erneut favorisiert hatte[18], was sich später bestätigte.[13] Obwohl die Monophylie der Balanomorpha und Verrucomorpha kaum noch bezweifelt wird, ist die Stellung zahlreicher Familien und Gattungen bis heute unsicher und zwischen verschiedenen Untersuchungen umstritten. Es sind daher zukünftig noch zahlreiche Änderungen zu erwarten.
Dies ergibt das folgende System (ohne rein fossile Gruppen):[19][1]
- Ordnung Sessilia
- Unterordnung Brachylepadomorpha
- Familie Neobrachylepadidae Newman & Yamaguchi, 1995 mit der einzigen Art Neobrachylepas relicta. Reliktart, Tiefsee des Pazifik.
- Unterordnung Verrucomorpha
- Unterordnung Balanomorpha
- Überfamilie Chionelasmatoidea Buckeridge, 1983
- Familie Chionelasmatidae Buckeridge, 1983 (5 Arten)
- Überfamilie Pachylasmatoidea Utinomi, 1968
- Familie Pachylasmatidae Utinomi, 1968 (26 Arten)
- Überfamilie Chthamaloidea Darwin, 1854
- Familie Catophragmidae Utinomi, 1968 (2 Arten)
- Familie Chthamalidae Darwin, 1854 (48 Arten)
- Überfamilie Coronuloidea Leach, 1817
- Familie Chelonibiidae Pilsbry, 1916 (6 Arten)
- Familie Coronulidae Leach, 1817 (5 Arten)
- Familie Platylepadidae Newman & Ross, 1976 (15 Arten)
- Überfamilie Tetraclitoidea Gruvel, 1903
- Familie Austrobalanidae Newman & Ross, 1976 (14 Arten)
- Familie Bathylasmatidae Newman & Ross, 1971 (20 Arten)
- Familie Tetraclitidae Gruvel, 1903 (38 Arten)
- Überfamilie Balanoidea Leach, 1817
- Familie Archaeobalanidae Newman & Ross, 1976 (121 Arten)
- Familie Balanidae Leach, 1817 (94 Arten)
- Familie Pyrgomatidae Gray, 1825 (72 Arten)
- Überfamilie Chionelasmatoidea Buckeridge, 1983
- Unterordnung Brachylepadomorpha
Fouling
.jpg.webp)
Da Seepocken Hartsubstrate aller Art besiedeln können, siedeln sich viele Arten auch auf vom Menschen eingebrachten Substraten an, wo sie erhebliche Probleme verursachen können. Besonders bedeutsam bei diesem (nach dem Englischen) als Fouling, in seinen biotischen Anteilen auch als Biofouling bezeichneten Prozess ist die Besiedlung von Schiffsrümpfen unterhalb der Wasserlinie. In historischen Zeiten, bei Schiffen mit Holzrumpf, konnte durch Fouling die Integrität des Rumpfs in Gefahr sein und das Schiff sinken. Deshalb wurde der Bewuchs seit der Antike abgekratzt, der Rumpf mit Pech oder Teer angestrichen oder mit Metallplatten (oft aus Blei) verkleidet.[20] Bei modernen Schiffen mit Metallrumpf ist der erhöhte Wasserwiderstand das Problem, durch den das Schiff verlangsamt wird und der Treibstoffverbrauch ansteigt. Der durch das notwendige Antifouling verursachte monetäre Schaden wurde, für das Jahr 1989, mit 730 Millionen Dollar veranschlagt, allein die jährlichen Kosten der US Navy wurden mit 180 bis 260 Millionen Dollar abgeschätzt.[21] Die dabei eingesetzten Tributylzinn-Verbindungen verursachen erhebliche toxikologische und Umweltprobleme. Seepocken sind an 60 bis 80 Prozent der von Fouling betroffenen Schiffsrümpfe an der Besiedlung beteiligt, die Arten Amphibalanus amphitrite und Amphibalanus improvisus (beide früher in die Gattung Balanus gestellt) sind etablierte Modellorganismen zur Erforschung von Fouling.[21] Die Etablierung der Seepocken beginnt mit dem Festsetzen der Cypis-Larven. Diese scheiden eine als Zement bezeichnete, hochwirksame Mischung aus Proteinen aus zwei hinter den Augen liegenden Drüsen aus, die als Klebstoff wirken, um sich auf der Oberfläche zu verankern. Dieser wird flüssig abgeschieden und härtet binnen einiger Stunden aus. In der Initialphase der Besiedlung können daher nur liegende oder mit weniger als zwei Knoten fahrende Schiffe besiedelt werden. Die Besiedlungsdichte allein durch Seepocken kann mehr als 100 Individuen pro 100 Quadratzentimeter Rumpf erreichen.
Das Fouling verursacht außerdem auch ökologische Probleme. Am Schiffsrumpf festsitzende Organismen wie Seepocken werden durch den Transport rund um den Globus verschleppt. Sie können sich dort vermehren und in anderen Regionen als Neozoen die Zusammensetzung der Fauna nachteilig verändern. Bei einer Untersuchung von Schiffen in deutschen Nordseehäfen wurden an 96 Prozent der Schiffe lebende Organismen entdeckt, die nicht in der Nordsee heimisch waren, darunter allein die Seepockenart Amphibalanus amphitrite an 64 von 131 untersuchten, oft in hoher Individuenzahl.[22] Die Verbreitung global verbreiteter Seepockenarten wie Amphibalanus improvisus[23] wird wesentlich auf den Transport durch Biofouling zurückgeführt.
Nutzung
Seepocken dienen selten auch der menschlichen Ernährung. So wird beispielsweise die in Südamerika Picoroco genannte Art Austromegabalanus psittacus gerne im Curanto, einem Eintopf, verwendet.
Forschungsgeschichte: Charles Darwin und die Seepocken
Der berühmteste und einer der einflussreichsten Forscher über Seepocken war Charles Darwin, der Begründer der Evolutionstheorie und einer der berühmtesten Biologen überhaupt. Darwin widmete acht Jahre seines Lebens, 1846 bis 1854, der Erforschung der Cirripedien. Er publizierte in den Jahren 1851 und 1854 insgesamt vier Monographien, zwei umfangreiche über rezente und zwei kürzere über die fossilen Formen.
Darwins Interesse an Seepocken wird meist auf eine Entdeckung an der chilenischen Küste zurückgeführt: Er fand am Strand Muschelschalen, in die ein kleiner, oranger Organismus eingebohrt war, offensichtlich ein Parasit der Muschel. Darwin erkannte das Tier unmittelbar als Rankenfußkrebs, konnte ihn aber nicht ins System einordnen. Das von ihm in seinen Notizen und Tagebüchern „Mr.Arthrobalanus“ getaufte Tier, später von ihm selbst als Cryptophialus minutus erstbeschrieben, war kleiner als alle anderen und besaß keine kalkige Schale.[24] Allerdings wurde glaubhaft gemacht, dass Darwin, etwa angeregt durch die Werke von John Vaughan Thompson, sich bereits vor der Entdeckung 1846 mit der Tiergruppe beschäftigt hatte.[25] Eine einflussreiche Hypothese deutet Darwins exzessive Beschäftigung mit dieser eher entlegenen Tiergruppe als eine Art Flucht: Darwin habe, nachdem ihm die Grundzüge seiner Evolutionstheorie seit mindestens 1838 bewusst waren, mit deren Publikation gezögert („Darwin's Delay“[26]), da er die Kritik und Widerstände seiner Fachkollegen, aber auch seines privaten Umfelds fürchtete; er habe die Veröffentlichung seines Hauptwerks Über die Entstehung der Arten hinausgeschoben, bis ihn die Kenntnis der Forschungen von Alfred Russel Wallace 1858 zum Handeln gezwungen hätte. Auch die Anhänger der Hypothese (die möglicherweise auf Nora Barlow, Historikerin und Darwins Enkeltochter, zurückgeht[27]), erkennen durchaus an, dass Darwin durch die genaue Beobachtung lernte, seine Hypothesen zu schärfen, zudem habe er durch das Werk seine Reputation als systematischer Zoologe aufgebaut.[28] Andere Forscher weisen die Hypothese vom Zögern Darwins völlig zurück. Er sei in die Forschung im Rahmen der Publikation der Ergebnisse der Beagle-Expedition hineingezogen worden und äußerte in seiner Korrespondenz große persönliche Befriedigung des auf präziser Beobachtung beruhenden Werks, das auch von Fachkollegen schon vor seinen Monographien hoch geschätzt wurde.[27] So erhielt er 1853 für seine Arbeit über Seepocken die hoch anerkannte Royal Medal.[29] Gerade durch die Arbeit über Seepocken sei sein Verständnis für die Variation in natürlichen Populationen gegenüber seinen früheren Vorstellungen geschärft worden, sodass die Arbeit keinesfalls nebensächlich für die Ausarbeitung der Evolutionstheorie gewesen sei.[29]
Darwin beschrieb in seinem Werk alle damals bekannten Cirripedier-Arten und -Gattungen und beschrieb zahlreiche neue. Alle Arten wurden in umfangreichen Abbildungen im Detail dargestellt. Erst wenige Jahre vorher war durch die Entdeckung der Seepocken-Larven durch John Vaughan Thompson klar geworden, dass die Seepocken nicht, wie bis dahin von allen führenden Zoologen angenommen, zu den Mollusken, sondern zu den Krebstieren gehören, für die, nach Arbeiten von George Sowery, dann Hermann Burmeister das Taxon der Rankenfußkrebse aufstellte.[30] Darwin baute seine Systematik auf der Morphologie der adulten Tiere auf. Besonders beschäftigte er sich mit der Homologie der Kalkplatten bei den verschiedenen Taxa, auf die er sein neues System wesentlich aufbaute. Die von Darwin begründete Nomenklatur wird bis heute verwendet.[31]
Einzelnachweise
- Shane T. Ahyong et al (2011): Subphylum Crustacea Brünnich, 1772. In: Zhi-Qiang Zhang (Editor): Animal biodiversity: An outline of higher-level classification and survey of taxonomic richness. Zootaxa 3148: 165–191.
- Alfred Kaestner (Begründer): Lehrbuch der Speziellen Zoologie. Hrsg.: Hans-Eckhard Gruner. 4. Auflage. Band 1: Wirbellose Tiere; 4. Teil: Arthropoda (ohne Insecta). Gustav Fischer Verlag, Jena Stuttgart New York 1993, ISBN 3-334-60404-7. 12. Unterklasse Cirripedia, Rankenfußkrebse. S. 680–712.
- Waltraud Klepal (1990): The fundamentals of insemination in cirripedes. Oceanography And Marine Biology, Annual Review 28: 353–379.
- Benny K.K. Chan and Jens T. Høeg: Diversity of lifestyles, sexual systems and larval development patterns in sessile crustaceans. Chapter 2 in: Martin Thiel and Les Watling (editors): Lifestyles and Feeding Biology. The Natural History of the Crustacea Vol. 2. Oxford University Press, 2015. ISBN 978-0-19-979702-8.
- J. Matthew Hoch, Daniel T. Schneck, Christopher J. Neufeld (2016): Ecology and Evolution of Phenotypic Plasticity in the Penis and Cirri of Barnacles. Integrative and Comparative Biology 56 (4): 728–740. doi:10.1093/icb/icw006
- Christopher J. Neufeld & A. Richard Palmer. “Precisely Proportioned: Intertidal Barnacles Alter Penis Form to Suit Coastal Wave Action.” Proceedings of the Royal Society B: Biological Sciences 275.1638 (2008): 1081–1087. doi:10.1098/rspb.2007.1760
- V.L. Kas`yanov, O.M. Korn, A.V. Rybakov (1998): Reproductive strategy of Cirripedes. 3. Embryonic development and early larvae. Russian Journal of Marine Biology 24 (5): 277–286.
- V.L. Kas`yanov, O.M. Korn, A.V. Rybakov (1999): Reproductive strategy of Cirripedes. 4. Cypris larvae, metamorphosis, and settlement. Russian Journal of Marine Biology 25 (1): 1–10.
- P.S. Rainbow (1984): An introduction to the biology of British littoral barnacles. Field Studies 6: 1-51.
- Gertraud Luther: Seepocken der deutschen Küstengewässer. Helgoländer Meeresunters. 41, 1--43 (1987) (Online, PDF)
- Ryota Hayashi, Benny K.K. Chan, Noa Simon-Blecher, Hiromi Watanabe, Tamar Guy-Haim, Takahiro Yonezawa, Yaniv Levy, Takuho Shuto, Yair Achituv (2013): Phylogenetic position and evolutionary history of the turtle and whale barnacles (Cirripedia: Balanomorpha: Coronuloidea). Molecular Phylogenetics and Evolution 67: 9–14. doi:10.1016/j.ympev.2012.12.018
- Joel W. Martin and George E. Davis (2001): An Updated Classification of the Recent Crustacea. Natural History Museum of Los Angeles County, Science Series 39. 124 S.
- Marcos Pérez-Losada, Margaret Harp, Jens T. Høeg, Yair Achituv, Diana Jones, Hiromi Watanabe, Keith A. Crandall (2008): The tempo and mode of barnacle evolution. Molecular Phylogenetics and Evolution 46: 328–346. doi:10.1016/j.ympev.2007.10.004
- William A Newman and Robert R Hessler (1989): A new abyssal hydrothermal verrucomorphan (Cirripedia; Sessilia): the most primitive living sessile barnacle. Transactions of the San Diego Society of Natural History 21: 259–273.
- William A. Newman and Toshiyuki Yamaguchi(1995): A new sessile barnacle (Cirripedia, Brachylepadomorpha) from the Lau Back-Arc Basin, Tonga; first record of a living representative since the Miocene. Bulletin du Muséum national d'histoire naturelle, Section A (Zoologie, biologie et écologie animales) 17: 221–244.
- Andy S. Gale, Crispin T.S. Little, Joel E. Johnson, Liviu Giosan (2020): A new neolepadid cirripede from a Pleistocene cold seep, Krishna-Godavari Basin, offshore India. Acta Palaeontologica Polonica 65 (2): 351–362.
- Santiago Herrera, Hiromi Watanabe, Timothy M. Shank (2015): Evolutionary and biogeographical patterns of barnacles from deep‐sea hydrothermal vents. Molecular Ecology 24 (3): 673–689. doi:10.1111/mec.13054
- William A. Newman (1987): Evolution of Cirripeds and theit major groups. In Alan J. Southward (editor): Barnacle Biology. A.A.Balkema, Rotterdam 1987. ISBN 90-6191-628-3.
- Sessilia WoRMS World Register of Marine Species. abgerufen am 2. Februar 2021.
- Woods Hole Oceanographic Institution (WHOI): Marine fouling and its prevention. United States Naval Institute, Annapolis 1952. (Contribution No. 580). Chapter 11, The History of the Prevention of Fouling. Volltext download
- Eric R. Holm (2012): Barnacles and Biofouling. Integrative and Comparative Biology 52(3): 348–355. doi:10.1093/icb/ics042
- S. Gollasch (2002): The importance of ship hull fouling as a vector of species introductions in the North Sea. Biofouling 19 (2): 105–121.
- Anna-Lisa Wrange, Gregory Charrier, Anne Thonig, Magnus Alm Rosenblad, Anders Blomberg, Jonathan N. Havenhand, Per R. Jonsson, Carl André (2016): The Story of a Hitchhiker: Population Genetic Patterns in the Invasive Barnacle Balanus (Amphibalanus) improvisus Darwin 1854. PLoS ONE 11(1): e0147082. doi:10.1371/journal.pone.0147082
- Roderick D. Buchanan (2016): Darwin's "Mr. Arthrobalanus": Sexual Differentiation, Evolutionary Destiny and the Expert Eye of the Beholder. Journal of the History of Biology 50 (2): 315–355. JSTOR 44980417
- Alan C. Love (2002): Darwin and Cirripedia Prior to 1846: Exploring the Origins of the Barnacle Research. Journal of the History of Biology 35: 251–289.
- Stephen Jay Gould: Darwin’s Delay. In: Ever Since Darwin. Reflections in Natural History. W.W. Norton & Company, New York/London 1977. ISBN 978 0393308181
- John van Wyhe (2010): Mind the gap: did Darwin avoid publishing his theory for many years? Notes and Records of the Royal Society 61: 177–205. doi:10.1098/rsnr.2006.0171
- Adrian Desmond, James R Moore: Darwin. Penguin Books, London 1991. ISBN 978 0 14 193556 0, Kap. 22 „Illformed Little Monsters“
- Costas Mannouris (2011): Darwin's "Beloved Barnacles": Tough Lessons in Variation. History and Philosophy of the Life Sciences 33 (1): 51–70.
- R. Moray: Understanding barnacles. In: D.T. Andersson (editor): Barnacles: Structure, function, development and evolution. Chapman & Hall, London etc. 1994. ISBN 0 412 44420 8.
- Jean Deutsch (2010): Darwin and barnacles. Comptes Rendus Biologies 333: 99–106. doi:10.1016/j.crvi.2009.11.009