1,1,2-Trichlor-1,2,2-trifluorethan
1,1,2-Trichlor-1,2,2-trifluorethan (TCTFE) ist eine organische Verbindung aus der Gruppe der FCKW (LHKW), die in Form einer farblosen Flüssigkeit auftritt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
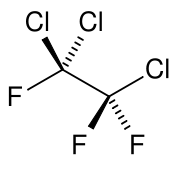 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,1,2-Trichlor-1,2,2-trifluorethan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2Cl3F3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, süßlich riechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 187,38 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,58 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
47,6 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
sehr schwer in Wasser (0,17 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,358 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Treibhauspotential |
6586 (bezogen auf 100 Jahre)[5] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−745,0 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Eigenschaften
1,1,2-Trichlor-1,2,2-trifluorethan ist eine farblose, süßlich riechende Flüssigkeit, welche schwer löslich in Wasser ist. Die Dämpfe von 1,1,2-Trichlor-1,2,2-trifluorethan sind viel schwerer (6,5 mal so schwer) als Luft.[2]
Verwendung
Früher fand 1,1,2-Trichlor-1,2,2-trifluorethan als Kältemittel und in den 1960er Jahren als Reinigungsmittel (Pflegesymbol eingekreistes F) für empfindliche Stoffe[7] Verwendung. Seit dem Verbot von FCKWs als Kältemittel wird es nur noch im Labor bei der Analyse von Mineralölen oder Zuckern eingesetzt. In der Gaschromatographie mit Flammenionisationsdetektor von – zur Verbesserung der Flüchtigkeit – silylierten Verbindungen wird es als Zusatz zugegeben, um die Bildung von Siliciumdioxid im Detektor zu verhindern.
Sicherheitshinweise
Als FCKW ist es schädigend für die Ozonschicht und hat ein hohes Treibhauspotenzial. Bei Kontakt mit Flammen zersetzt sich der Stoff, wobei toxische Chlor- und Fluorverbindungen wie etwa Phosgen oder Fluorwasserstoff entstehen können.[2]
Einzelnachweise
- Datenblatt 1,1,2-Trichlor-1,2,2-trifluorethan (PDF) bei Merck, abgerufen am 18. Januar 2011.
- Eintrag zu 1,1,2-Trichlor-1,2,2-trifluorethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Datenblatt 1,1,2-Trichlor-1,2,2-trifluorethan bei Sigma-Aldrich, abgerufen am 16. Oktober 2016 (PDF).
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 76-13-1 bzw. 1,1,2-Trichlor-1,2,2-trifluorethan), abgerufen am 2. November 2015.
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- Sächsisches Landesamt für Umwelt und Geologie: Branchenbezogene Merkblätter zur Altlastenbehandlung: Chemische Reinigungen, Stand: 11/99.

