Abscisinsäure
Abscisinsäure oder Abszisinsäure (veraltet Dormin) ist ein Phytohormon (Pflanzenhormon) mit allgemein hemmender Wirkung. Chemisch zählt sie zu den monocyclischen Sesquiterpenen. International gebräuchlich ist die Abkürzung ABA von engl. abscisic acid.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
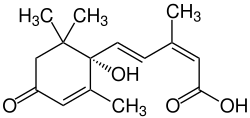 | |||||||||||||||||||
| Struktur von (+)-Abscisinsäure | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Abscisinsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C15H20O4 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 264,32 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sublimationspunkt |
120 °C[3] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
ABA kommt in höheren Pflanzen, Laubmoosen, Algen, Pilzen und Cyanobakterien vor, jedoch nicht in anderen Bakterien, Archaeen und Lebermoosen.
Struktur
Im Gegensatz zu den meisten anderen Phytohormonen handelt es sich bei Abscisinsäure um einen Einzelstoff und nicht um eine Stoffgruppe. Von der Struktur her ist ABA ein monocyclisches Sesquiterpen. Die Biosynthese erfolgt jedoch aus dem Spaltprodukt eines Tetraterpens (siehe unten).
Die natürlich vorkommende Form ist (S)-(+)-ABA [auch als (+)-ABA bezeichnet], mit einem stereogenen Zentrum in C-1′-Position. Dennoch wurden die biologischen und biochemischen Aktivität des synthetischen Enantiomers (–)-ABA seit den 1960er Jahren eingehend untersucht.[5]
Eigenschaften
Abscisinsäure bildet farblose Kristalle, die in organischen Lösungsmitteln gut löslich sind. Die Löslichkeit in Wasser ist pH-Wert-abhängig: in sauren und neutralen Lösungen löst sich Abscisinsäure schlecht, in alkalischen gut. Abscisinsäure ist sehr lichtempfindlich. Durch Lichteinwirkung erfolgt eine photochemische Umlagerung zum physiologisch unwirksamen trans-Isomer.
Biosynthese
Die pflanzliche Biosynthese findet vor allem in Blättern als allgemeine Stressantwort (vor allem bei Trockenstress) statt. Als Signal zur Synthese dient meist ein Abfall des zellulären Turgors. Die Synthese folgt im Allgemeinen der anderer Tetraterpene aus Isopentenylpyrophosphat (IPP), das über den Methylerythritolphosphatweg (MEP-Weg) in den Chloroplasten der Blätter gebildet wird. Zwischenprodukt sind die bei der Terpensynthese entstehenden Xanthophylle Zeaxanthin und Violaxanthin. Aus ihnen wird im Zytoplasma durch Spaltung und Oxidation ABA gebildet.
Die Inaktivierung der Abscisinsäure erfolgt durch oxidativen Abbau zu Phaseinsäure und Dihydro-Phaseinsäure. Neben freier Abscisinsäure finden sich im Pflanzengewebe auch deren Glucoseester und das O-Glucosid. Diese Konjugate der Abscisinsäure werden als inaktive Transport- und Speicherformen angesehen. Transportiert wird ABA im Leitgewebe größtenteils durch das Phloem von den Blättern zur Wurzel, geringe Mengen auch umgekehrt im Xylem von der Wurzel in den Spross.
Entdeckungsgeschichte
Abscisinsäure wurde 1963 in zwei Arbeitsgruppen unabhängig voneinander entdeckt. In der Arbeitsgruppe von P. F. Wareing (England) wurde sie als das die Knospenruhe (Dormancy) verursachende Prinzip aus Ahornblättern isoliert und „Dormin“ genannt. F. T. Addicott, K. Ohkuma und Mitarbeiter (USA) isolierten sie als blattfallförderndes Prinzip als „Abscisin II“ aus jungen Baumwollfrüchten. Aufgrund der übereinstimmenden chemischen Struktur beider Substanzen erhielt die Verbindung 1965 den Namen Abscisinsäure.[6]
Bereits kurze Zeit darauf publizierten John W. Cornforth und Mitarbeiter die Synthese des Racemats.[7]
Der Name Abscisinsäure beruht darauf, dass die Säure (erstmals als Faktor Abscisin II beschrieben) in hohen Konzentrationen in abgeworfenen Baumwollblättern gefunden wurde. Bei Applikation auf Blatt- und Fruchtstiele bewirkt sie auch tatsächlich deren Abwurf (Abscission). Diese Wirkung ist jedoch auf wenige Pflanzen beschränkt und wird auch nicht direkt von der Abscisinsäure hervorgerufen, sondern durch eine von ihr hervorgerufene Ethylenfreisetzung. Unabhängig davon wurde sie auch als der Dormanz auslösende Faktor Dormin beschrieben, bis sich durch chemische Analyse herausstellte, dass es sich bei Abscisin II und Dormin um dieselbe Substanz handelte. Der Name Abscisin setzte sich jedoch durch, obwohl Dormin (von lateinisch dormire = schlafen) funktionell passender gewesen wäre.
Wirkungen
Abscisinsäure wirkt allgemein antagonistisch zu wachstumsfördernden Phytohormonen und ist dadurch ein natürlicher Wachstumsinhibitor. Zusammen mit den wachstumsfördernden Auxinen, Gibberellinen und Cytokininen reguliert Abscisinsäure Alterung, Laubfall, Blütenbildung, Fruchtreife, Samen- und Knospenruhe, die stomatäre Transpiration und andere Entwicklungsprozesse der Pflanze.
Allgemeine Wirkungen
Die beiden primären Wirkungen der Abscisinsäure lassen sich in zwei Gruppen aufteilen:
Auslösung und Aufrechterhaltung der Dormanz pflanzlicher Organe
- Samenruhe: ABA wird während der späten Embryogenese im Embryo gebildet. Sie verhindert die sofortige Keimung auf der Mutterpflanze (Viviparie) und induziert die Bildung von Speicherproteinen und Dehydrinen (vor allem LEA-Proteine) zum Schutz vor osmotischem Stress. Als Antagonist wirken Gibberelline (GAs) und führen nach Stratifikation zur Keimung, wobei ausschlaggebend das Verhältnis von ABA zu GA ist (ähnlich wie bei Differenzierungsprozessen das Auxin/Cytokinin-Verhältnis).
- Knospenruhe: ABA induziert auch die Knospenruhe der neuen Triebe von Laubbäumen im Winter. Als Antagonist wirken auch hier Gibberelline, welche nach Vernalisation im Frühjahr das Schossen auslösen.
Reaktionen auf biotischen und abiotischen Stress
- osmotischer Stress (Trockenstress, Hitzestress, Salzstress): Einschränkung der Transpiration (ABA induziert über Ionenflüsse den Schluss der Stomata, so dass weniger Wasser verdunstet) und Einschränkung der Photosynthese. Das Phytohormon ABA induziert dabei auf molekularer Ebene das Öffnen von Anionenkanälen, wodurch Anionen aus der Schließzelle austreten. Dadurch wird das Membranpotential positiver (Depolarisation), wodurch sich wiederum Kalium-Abgabekanäle öffnen und K+-Ionen aus der Zelle in den Apoplasten strömen. Das Wasser aus der Zelle strömt in den Apoplasten nach, der Turgor in den Schließzellen nimmt ab und die Stomata schließen sich. Bei Trockenstress (Wasserstress) korreliert die stressinduzierte ABA-Konzentration linear mit der Wasserleitfähigkeit der Blätter, während sich die Wassernutzungseffizienz erhöht.[8]
- Kältestress: bewirkt Knospenruhe (verlangsamt Knospenwachstum, bildet schützende Schuppen) und Einstellung des primären und sekundären Dickenwachstums (Hemmung der Zellteilung im Kambium)
- Pflanzenpathogene
Signaltransduktion
Kurzfristige physiologische Anpassungen
- Stomataschluss:
Bei Wasserstress steigt der pH-Wert im Apoplasten des Mesophyll von ca. 6,3 auf ca. 7,2. Dadurch dissoziiert Abscisinsäure unter Abspaltung eines Protons zu ihrem Anion. Durch seine negative Ladung kann das ABA-Ion wesentlich schlechter durch Zellmembranen diffundieren und wird somit weniger von den Mesophyllzellen aufgenommen. Stattdessen bindet es vermehrt an einen G-Protein-gekoppelten Rezeptor in der Zellmembran der Schließzellen der Spaltöffnungen. Dies führt einerseits zur kurzfristigen Öffnung zellulärer Calcium-Kanäle und Depolarisierung durch Einstrom von Ca2+ in die Zelle. Andererseits aktiviert das G-Protein die Phospholipase C, und damit die Freisetzung von Inositoltrisphosphat (IP3), was wiederum zur Freisetzung von intrazellulär in der Vakuole und den Endoplasmatischen Retikulums gespeichertem Calcium ins Cytoplasma führt. Durch beide Effekte steigt der cytoplasmatische Ca2+-Spiegel und damit die positive Ladung der Zelle. Ca2+ wirkt in Pflanzenzellen als Second messenger. Es hemmt Protonenpumpen in der Zellmembran (H+-ATPasen, die normalerweise H+ aktiv aus der Zelle pumpen) und weitere Depolarisierung durch die Öffnung anderer Ionenkanäle. Cl− und K+ und eventuell Malat2− strömen aus. Osmotisch gekoppelt strömt auch Wasser aus. Damit sinkt der Turgor in den Schließzellen, so dass diese schließen.
Längerfristige Differenzierung
- Veränderte Genexpression:
Die intrazelluläre Signaltransduktion von ABA und die Genaktivierung ist noch weitgehend unbekannt. Relativ gut untersucht ist das EM-Gen des Weizens, das neben anderen regulatorischen Sequenzen ein ABA-Responsive-Element (ABRE) enthält. Zu den langfristigen Wirkungen von ABA in der Pflanze zählt eine Erhöhung der hydraulischen Leitfähigkeit der Wurzeln, und ein verstärktes Wurzelwachstum, während das sonstige Wachstum (im Spross, Knospen, Blättern) gehemmt wird. Im Keimling induziert ABA wie oben erwähnt die Bildung bzw. Einlagerung von Speicherstoffen und Dehydrinen.
Im Protonema der Laubmoose induziert ABA sehr spezifisch die Umwandlung photosynthetisch aktiver Zellen zu vegetativen Dauersporen, den sogenannten Brachycyten.[9] Abscisinsäure hat ein breites Wirkungsspektrum, dessen Wirkungsmechanismus noch ungeklärt ist. Der Gehalt an Abscisinsäure ist vom Pflanzenorgan und seinem Entwicklungszustand abhängig, beträgt aber im Durchschnitt etwa 100 µg je kg Frischmasse.
Literatur
- Friedrich Kauder: Biochemische Reaktionen des pflanzlichen Stoffwechsels auf Abscisinsäure und Änderungen der atmosphärischen CO2-Konzentration. Cuvillier, Göttingen 1998, ISBN 3-89712-435-1.
- Laura B. Sheard, Ning Zheng: Plant biology: Signal advance for abscisic acid. In: Nature. 462, Nr. 7273, Dezember 2009, S. 575–576. doi:10.1038/462575a. PMID 19956245.
- Mitsunori Seo, Tomokazu Koshiba: Complex regulation of ABA biosynthesis in plants. In: Trends Plant Science. 7, 1, 2002, S. 41–48, Review, doi:10.1016/S1360-1385(01)02187-2.
- Eiji Nambara, Annie Marion-Poll: Abscisic acid biosynthesis and catabolism. In: Annual Review of Plant Biology. 56, 2005, S. 165–185, doi:10.1146/annurev.arplant.56.032604.144046.
- B. V. Milborrow: The pathway of biosynthesis of abscisic acid in vascular plants: a review of the present state of knowledge of ABA biosynthesis. In: Journal of Experimental Botany. 52, 359, 2001, S. 1145–1164, doi:10.1093/jexbot/52.359.1145.
- Dieter Heß: Pflanzenphysiologie. Grundlagen der Physiologie und Biotechnologie der Pflanzen. 11. komplett neu bearbeitete und neu gestaltete Auflage. Ulmer, Stuttgart 2008, ISBN 978-3-8001-2885-3 (UTB – Botanik, Biologie, Agrarwissenschaften 8393).
- Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, Gunther Neuhaus, Uwe Sonnewald: Strasburger – Lehrbuch der Botanik. 36. Auflage. Spektrum, Heidelberg 2008, ISBN 978-3-8274-1455-7.
- Razem, FA. et al. (2006): The RNA-binding protein FCA is an abscisic acid receptor. In: Nature 439(7074); 290–294; PMID 16421562; doi:10.1038/nature04373.
Weblinks
- Informationsseite über Abscisinsäure der Uni Hamburg
- englische Informationsseite über Abscisinsäure auf Kimball's Biology Pages
- englische Informationsseite über Abscisinsäure des BBSRC (Biotechnology and Biological Sciences Research Council)
- Abszisinsäuresynthese in den Schließzellen
Einzelnachweise
- Eintrag zu S-Abscisinsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Dezember 2021. (JavaScript erforderlich)
- Datenblatt (±)-Abscisinsäure bei Sigma-Aldrich, abgerufen am 12. Januar 2013 (PDF).
- Richard J. Lewis, Sr.: Hawley's Condensed Chemical Dictionary. 15. Auflage. Wiley-Interscience, 2007, ISBN 978-0-471-76865-4 (englisch).
- Growth Regulators. In: Plant Tissue Culture Protocols. Sigma-Aldrich Co. LLC., abgerufen am 7. Januar 2012 (englisch).
- Xingliang Zhang, Lun Jiang, Guoqiang Wang, Lin Yu, Qi Zhang, Qi Xin, Wei Wu, Zhizhong Gong, Zhongzhou Chen: Structural Insights into the Abscisic Acid Stereospecificity by the ABA Receptors PYR/PYL/RCAR. In: PLOS ONE. Band 8, Nr. 7, 2013, ISSN 1932-6203, S. e67477, doi:10.1371/journal.pone.0067477, PMID 23844015 (plos.org).
- Eckehart Jäger, Stefanie Neumann, Erich Ohmann: Botanik. Springer-Verlag, 2015, ISBN 978-3-8274-2358-0, S. 489 (books.google.com).
- Richard Wegler: Chemie der Pflanzenschutz- und Schädlingsbekämpfungsmittel Band 2: Fungizide · Herbizide · Natürliche · Pflanzenwuchsstoffe · Rückstandsprobleme. Springer-Verlag, 2013, ISBN 978-3-7091-4184-7, S. 425 (eingeschränkte Vorschau in der Google-Buchsuche).
- Barbara Steuer, Thomas Stuhlfauth, Heinrich P. Fock: The efficiency of water use in water stressed plants is increased due to ABA induced stomatal closure. In: Photosynthesis Research. 18, Nr. 3, 1988, S. 327–336. doi:10.1007/BF00034837.
- Decker EL, Frank W, Sarnighausen E, Reski R: Moss systems biology en route: phytohormones in Physcomitrella development Archiviert vom Original am 4. Februar 2012. (PDF) In: Plant Biol (Stuttg). 8, Nr. 3, Mai 2006, S. 397–405. doi:10.1055/s-2006-923952. PMID 16807833.
