Warmhaus-Riesenkrabbenspinne
Die Warmhaus-Riesenkrabbenspinne (Heteropoda venatoria), häufig vereinfachend auch nur Riesenkrabbenspinne genannt, ist eine Spinne aus der gleichnamigen Familie der Riesenkrabbenspinnen (Sparassidae). Die mit einer Beinspannweite von bis zu 120 Millimetern sehr große Spinnenart stammt wahrscheinlich aus den tropischen Bereichen Asiens, hat sich mittlerweile jedoch weltweit ausgebreitet. In eigentlich überlebensfeindlichen geografischen Gebieten bevorzugt die Warmhaus-Riesenkrabbenspinne beheizte Gebäude menschlicher Siedlungsbereiche und hierbei insbesondere Warmhäuser, ein Umstand, auf den auch ihr erster Namensbestandteil zurückgeht.
| Warmhaus-Riesenkrabbenspinne | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Warmhaus-Riesenkrabbenspinne (Heteropoda venatoria), Weibchen | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Heteropoda venatoria | ||||||||||||
| (Linnaeus, 1767) |
Weil die Warmhaus-Riesenkrabbenspinne mitunter Bananenplantagen bewohnt und deshalb an gehandelten Bananen gefunden werden kann, wird sie auch als „Bananenspinne“ bezeichnet. Diese Trivialbezeichnung hat sie mit einigen Arten der Gattung Cupiennius aus der Familie der Fischerspinnen (Trechaleidae) und auch mit Vertretern der Gattung Phoneutria innerhalb der Familie der Kammspinnen (Ctenidae), die ebenfalls auf Bananenplantagen leben, gemein. Im Gegensatz zu letzteren, zu denen auch die giftige Brasilianische Wanderspinne (P. nigriventer) gehört, ist die Warmhaus-Riesenkrabbenspinne für den Menschen weitestgehend ungefährlich.
Die nachtaktive Warmhaus-Riesenkrabbenspinne legt wie alle Angehörigen der Familie der Riesenkrabbenspinnen kein Spinnennetz zum Fangzweck an, sondern erlegt Beutetiere freilaufend als Lauerjäger. Wegen ihrer für Spinnen beachtlichen Dimensionen weist die Warmhaus-Riesenkrabbenspinne ein vergleichsweise großes Beutespektrum auf, wozu auch größere und wehrhaftere Gliederfüßer sowie kleinere Wirbeltiere gehören. Eine weitere besondere Eigenschaft der Art ist die Fähigkeit des Männchens zur Lauterzeugung durch Reiben zweier Körperteile (Stridulation), die bei der Balz Anwendung findet.
Merkmale
_male_Domestic_Hunting_Spider_(16289064336).jpg.webp)
Das Weibchen der Warmhaus-Riesenkrabbenspinne erreicht eine Körperlänge von 17 bis 34 Millimetern, das Männchen eine von bis zu 21 Millimetern.[1] Ausgewachsene Exemplare der Art erreichen eine Beinspannweite von etwa 70 bis 120 Millimetern, was die Warmhaus-Riesenkrabbenspinne zu einer vergleichsweise großen Spinne macht.[2]

Der Körperbau der Art entspricht dem anderer Vertreter der Echten Riesenkrabbenspinnen (Heteropoda), womit auch die Warmhaus-Riesenkrabbenspinne einen für Riesenkrabbenspinnen (Sparassidae) üblichen deutlich abgeflachten Habitus (äußere Erscheinung) aufweist.[2] Ebenso gleicht die Beinanordnung der anderer Riesenkrabbenspinnen, d. h., das zweite Beinpaar ist deutlich länger. Beide Augenreihen sind nach hinten gebogen und die vorderen Mittelaugen sind kleiner als die vorderen Seitenaugen. Die hinteren Seitenaugen befinden sich auf leichten Erhebungen.[1] Ähnlich wie bei Wolfsspinnen (Lycosidae) sind auch gut getarnte Individuen der Warmhaus-Riesenkrabbenspinne in der Nacht mit einer geeigneten Lichtquelle, z. B. einer Taschenlampe, durch die reflektierenden Augen leicht auffindbar.[2]
Die Grundfärbung der Warmhaus-Riesenkrabbenspinne ist braun. Beide Geschlechter verfügen über einen gelb- bis cremefarbenen Clypeus (Bereich zw. Augen und Cheliceren bzw. Kieferklauen) und ein breites Randband, das den Carapax (Rückenschild des Prosomas bzw. Vorderkörpers) umgibt, der bei beiden Geschlechtern unterschiedlich gefärbt ist. Dazu haben sowohl das Männchen als auch das Weibchen schwarze Flecken auf den Beinen, aus denen eine auffällige und kurz ausfallende Behaarung entspringt.[2]
Sehsinn

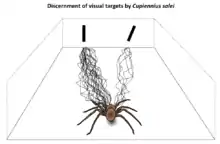
Die Warmhaus-Riesenkrabbenspinne besitzt wie für Riesenkrabbenspinnen (Sparassidae) üblich eine gute Sehfähigkeit. Hierbei bestehen Parallelen zum ebenfalls guten Sehvermögen der zur Familie der Fischerspinnen (Trechaleidae) zählenden Großen Wanderspinne (Cupiennius salei). Diese vollführt eine ähnliche Lebensweise wie die Warmhaus-Riesenkrabbenspinne, jedoch ist ihre Augenstellung deutlich anders. Verglichen mit letzterer Art ist die Große Wanderspinne allerdings auch im Bezug auf ihr visuelles Sichtfeld deutlich besser erforscht.[3]
2012 wurde das Sehvermögen der Warmhaus-Riesenkrabbenspinne anhand von zwei Versuchsreihen erforscht. Dazu wurden nacheinander je ein Exemplar der Art pro Versuch in eine Laufarena gesetzt. Mithilfe der ersten Versuchsreihe wurden in der Arena zwei unterschiedlich breite schwarze Papierrechtecke aufgestellt, die visuell von der Spinne als Unterschlupf wahrgenommen werden sollten. So sollte analysiert werden, ob die Warmhaus-Riesenkrabbenspinne ein visuell gesteuertes Verhalten aufweist. Das Versuchstier bevorzugte häufig das breitere Rechteck gegenüber dem schmaleren und steuerte bei vielen Versuchen mit den unterschiedlichen Rechtecken dieses an. Die Wahrscheinlichkeit, dass das Rechteck angelaufen wurde, sank, je schmaler dieses wurde. Bei weiteren Versuchen dieser Reihe, wo zwei ähnlich große Papierrechtecke aufgestellt wurden, wurden beide etwa gleich häufig angesteuert. Das Ergebnis der Studie ist, dass die Augen der Warmhaus-Riesenkrabbenspinne über eine räumliche Auflösung von mindestens 4° bis 8° verfügen.[4]
Die zweite Versuchsreihe diente dazu, den Sehsinn der Warmhaus-Riesenkrabbenspinne im Zusammenhang mit ihren Laufspuren zu ermitteln. Diese wurden von dieser Art direkt und geradlinig angelaufen, wodurch sie sich diesbezüglich von der Großen Wanderspinne unterscheidet, die sich derartigen Objekte in einem seitlichen Zick-Zack-Kurs nähert. Es wird vermutet, dass dieses Verhalten bei dieser Art dazu dient, unterschiedliche Entfernung verschiedener optisch wahrgenommener Objekte besser unterscheiden zu können. Da die Warmhaus-Riesenkrabbenspinne dieses Verhalten nicht aufweist, wird vermutet, dass sie Entfernungen visuell von der Großen Wanderspinne abweichend oder gar nicht wahrnimmt.[5]
Sexualdimorphismus

Wie bei vielen anderen Spinnen existiert auch bei der Warmhaus-Riesenkrabbenspinne ein beachtlicher Sexualdimorphismus (Unterschied der Geschlechter), der sich neben der Körpergröße auch im Körperbau und der Färbung von Weibchen und Männchen bemerkbar macht.[2]
Weibchen
Das Weibchen der Warmhaus-Riesenkrabbenspinne ist wesentlich kräftiger gebaut und hat im Verhältnis kürzere Beine als das Männchen. Dabei tritt insbesondere das Opisthosoma (Hinterleib) deutlich kräftiger als beim Männchen in Erscheinung. Das Randband auf dem Carapax ist beim Weibchen dunkelgelb gefärbt.[2] Ansonsten ist das Weibchen verglichen mit dem Männchen kontrastarm gezeichnet.
Männchen
Das weniger kräftig gebaute Männchen hat längere Beine als das weibliche Gegenstück. Hier tritt das Randband des Carapaxes cremefarben in Erscheinung. Das Männchen verfügt im Gegensatz zu dem Weibchen zusätzlich über ein dunkles Längsband auf dem Opisthosoma und einen hell umrandeten und blassen Bereich hinter den Augen.[2]
.jpg.webp) Dorsalansicht eines Männchens
Dorsalansicht eines Männchens Frontalansicht eines Männchens
Frontalansicht eines Männchens-left_01.jpg.webp) Lateralansicht eines Männchens
Lateralansicht eines Männchens Rückansicht eines Männchens
Rückansicht eines Männchens Detailansicht eines Männchens mit erbeuteter Zikade
Detailansicht eines Männchens mit erbeuteter Zikade
Genitalmorphologische Merkmale
Das Männchen der Warmhaus-Riesenkrabbenspinne kann von allen anderen Arten der Echten Riesenkrabbenspinnen (Heteropoda) durch die zwei zahnartige Fortsätze unterschieden werden. Diese befinden sich an der für die Gattung typischen retrolateralen (weiter von der Körpermitte entfernt liegende) Apophyse (chitinisierter Fortsatz) an jedem der beiden Bulbi (männliche Geschlechtsorgane). Ein weiteres Alleinstellungsmerkmal der Warmhaus-Riesenkrabbenspinnen ist der Verlauf der Spermophoren (Samenschläuche) bei jedem der beiden Bulbi: Ein einzelner Spermophor weist in der distalen (seitlich vom Körper abgewandten) Hälfte des Tegulums (zweites Sklerit bzw. Glied des Bulbus) einen großflächigen, rechtwinklig kurvenartigen Verlauf auf.[6]
Die Epigyne (weibliches Geschlechtsorgan) der Warmhaus-Riesenkrabbenspinne hat an beiden Seiten je ein Läppchen, die sich beide auf medianer Ebene berühren und dabei anteriorale (vorhergehende) und posteriorale (hinten gelegene) Teile des Septums freilegen.[6]
Ähnliche Arten
Die Warmhaus-Riesenkrabbenspinne wird gelegentlich mit anderen ihr optisch ähnlichen Spinnenarten verwechselt. Beispiele sind in den beiden folgenden Unterabschnitten aufgeführt.
Ähnlichkeiten mit Heteropoda tetrica
_(23767835046).jpg.webp)
Die Warmhaus-Riesenkrabbenspinne kann innerhalb der Gattung der Echten Riesenkrabbenspinnen (Heteropoda) vor allem mit der in Indochina verbreiteten Art Heteropoda tetrica verwechselt werden. Das Männchen dieser Art hat allerdings zusätzlich zu dem Randband noch zwei parallel angeordnete Streifen vor dem Band.[6] Die Weibchen beider Arten können zumeist nur durch Merkmale der sehr ähnlich aufgebauten Epigynen sicher unterschieden werden. Beim Weibchen von H. tetrica hat das mittlere Septum eine größere Variabilität als bei der Warmhaus-Riesenkrabbenspinne.[6]
Verwechslungen mit Loxosceles reclusa

Die Warmhaus-Riesenkrabbenspinne wird in den Vereinigten Staaten gelegentlich mit der nicht näher verwandten Spinnenart Loxosceles reclusa aus der Familie der Sechsäugigen Sandspinnen (Sicariidae) verwechselt. Verglichen mit der Warmhaus-Riesenkrabbenspinne kann der Biss von Loxosceles reclusa für den Menschen medizinisch deutlich relevantere Symptome hervorrufen.[2]
Vorkommen

Die Warmhaus-Riesenkrabbenspinne war ursprünglich vermutlich in Südostasien beheimatet[7] und wurde in vielen Teilen der Welt, darunter Europa, Afrika, Amerika, den pazifischen Inseln und Makaronesien eingeführt.[1][8] In Gebieten, die der Art in freier Natur bedingt durch jahreszeitliche Schwankungen kein Überleben ermöglichen, darunter Zentraleuropa,[1] kommt sie synanthrop (an menschliche Siedlungsbereiche gebunden) vor.[2]
Lebensräume
.jpg.webp)
Über die bevorzugten Habitate (Lebensräume) der Warmhaus-Riesenkrabbenspinne in ihrem ursprünglichen Verbreitungsgebiet liegen keine genaueren Informationen vor. In klimatisch ungünstigen Gebieten ist die dort eingeschleppte Art besonders in beheizten Einrichtungen, darunter vor allem Gewächshäusern und geheizten Lagerhäusern, vorfindbar.[1] Aus dem US-Staat Florida liegen allerdings auch Berichte über eine Anpassung außerhalb menschlicher Behausungen vor, wo die Warmhaus-Riesenkrabbenspinne insbesondere Avocado-Haine bewohnt.[2]
Präferenz für Bananenpflanzen
.jpg.webp)
Zusammen mit Arten der Gattung Cupiennius aus der Familie der Fischerspinnen (Trechaleidae) und Arten der Gattung Phoneutria aus der Familie der Kammspinnen (Ctenidae) wird die Warmhaus-Riesenkrabbenspinne auch als „Bananenspinne“ bezeichnet. Der Name leitet sich aus ihrer Vorliebe für die Pflanze der Dessertbanane (Musa × paradisiaca) ab, wobei auf entsprechenden Plantagen Weibchen weitaus häufiger als Männchen anzutreffen sind.[9]
Die Präferenz für Bananenplantagen lässt sich damit erklären, dass die Pflanzen der Dessertbanane neben dem Nahrungsangebot an Beutetieren tagsüber auch viele Rückzugsorte für die nachtaktiven Spinnen bieten. Die Spinne nutzt dazu je nach Alter verschiedene Hohlräume an den Pseudostämmen, den Deckblättern und den Fruchtkörpern. Dabei wird der obere Bereich mit dem Blattwerk und den Früchten gegenüber dem unteren Bereich der Bananenpflanzen bevorzugt.[10] Ausgewachsene Tiere, insbesondere Weibchen mit Eikokons, suchen zumeist unter den losen Blattscheiden und den Zwischenräumen zwischen den Fruchtkörpern sowie -ständen Zuflucht. Jungtiere sind dagegen auch in den Rillen an Blattscheidenstielen und unter den Deckblättern anzutreffen. Diese Bevorzugung höherliegender Pflanzenteile kann durch die Anwesenheit von Fressfeinden im unteren Bereich der Bananenstaude erklärt werden.[11]
Die Fundrate an den jeweiligen Bereichen der Bananenpflanze variiert zeitlich, wie zum Beispiel in Kamerun beobachtet werden konnte. Zwischen April und August konnten Exemplare der Warmhaus-Riesenkrabbenspinne vor allem in den Zwischenräumen unter den losen Blattscheiden um den Pseudostämmen sowie in Rillen an Blatt- oder Stielen der Bananenpflanzen gefunden werden. Zwischen September und März, d. h. zur Blütezeit der Bananenpflanzen, halten sich die Spinnen vermehrt in den Rillen der Stiele der Blattscheiden und zwischen den Deckblättern sowie den Früchten im oberen Teil der Pflanze auf.[10]
Lebensweise
.jpg.webp)
Die Warmhaus-Riesenkrabbenspinne ist vornehmlich nachtaktiv. Tagsüber hält sie sich in temporären Unterschlüpfen verborgen. Bedingt durch den abgeflachten Körperbau der Spinne können dies auch schmale Ritzen sein.[12][13]
Jagdverhalten
_female_Domestic_Hunting_Spider_(16289068666).jpg.webp)
Die Warmhaus-Riesenkrabbenspinne lebt wie nahezu alle Spinnen ausschließlich räuberisch, jagt wie andere Riesenkrabbenspinnen (Sparassidae) ohne Fangnetz und erlegt Beutetiere demzufolge freilaufend. Wie alle Riesenkrabbenspinnen erreicht sie dabei hohe Laufgeschwindigkeiten.[1][13]
Beutefang und Aufspüren von Beutetieren
Wie genau die Warmhaus-Riesenkrabbenspinne ihre Beute fängt, konnte noch nicht abschließend geklärt werden. Einer beobachtungsbasierten Theorie aus China zufolge ist die Spinne ein Lauerjäger, d. h., sie wartet auf Beutetiere, die dann mit Hilfe eines schnell ausgeführten Giftbisses überwältigt werden. Es wird zudem vermutet, dass die Art auch aktiv nach Beutetieren sucht, wie es bei anderen Riesenkrabbenspinnen der Fall ist.[14] Befinden sich fliegende Insekten in Reichweite, können diese angesprungen werden.[15] Die Registrierung und Ortung der Beute geschieht zuvor vermutlich mittels der lyraförmigen Organe, d. h. der für Spinnen typischen Wahrnehmungsorgane für Schallschwingungen.[15]
Beutespektrum

Die Warmhaus-Riesenkrabbenspinne ist ein opportunistischer Jäger und erlegt demzufolge alle Beutetiere, die die Spinne zu überwältigen vermag. Am häufigsten werden andere Gliederfüßer erbeutet. Unter 2013 geschehenen Versuchen wurde erwiesen, dass die Warmhaus-Riesenkrabbenspinne eine Vielzahl von Insekten wie Schaben, Grashüpfer, Stubenfliegen, Mücken, Läuse, Libellen[16] und Marienkäfer[17] als Beute annimmt. Lediglich kleinere Individuen der Art mit einer Körperlänge von bis zu 15 Millimetern erbeuteten Fliegen, Mücken und Läuse, die von den größeren Spinnen zumeist ignoriert wurden.[16] Ameisen wurden in der Versuchsreihe gänzlich gemieden. Auch andere Spinnen wie Echte Radnetzspinnen (Araneidae) aus den Gattungen der Riedkreuzspinnen (Neoscona) und der Südlichen Radnetzspinnen (Argiope), Zitterspinnen (Pholcidae) aus der Gattung der Moskito- (Crossopriza) und der Echten Zitterspinnen (Pholcus), Springspinnen (Salticidae) aus der Gattung Plexippus und Kugelspinnen (Theridiidae) aus der Gattung der Echten Kugelspinnen (Theridion) nahmen die Exemplare der Warmhaus-Riesenkrabbenspinne unter Laborbedingungen als Beute an.[16] Hierbei erwiesen sich jedoch insbesondere Schaben und an zweiter Stelle Moskito-Zitterspinnen als bevorzugte Beute der Warmhaus-Riesenkrabbenspinne.[17]

Die Art wurde auch dabei beobachtet, wehrhafte Beutetiere wie Skorpione oder kleine Wirbeltiere wie Fledermäuse zu überwältigen.[2] 2017 wurde ein Weibchen der Warmhaus-Riesenkrabbenspinne dabei beobachtet, ein Exemplar des ebenfalls an menschliche Siedlungsbereiche angepassten Asiatischen Hausgecko (Hemidactylus frenatus) zu verzehren, das es zum Zeitpunkt der Sichtung bereits überwältigt und schon zur Hälfte ausgesogen hatte. Die Spinne maß eine Körperlänge von 23 und eine Beinspannweite von 110 Millimetern. Der Fund geschah im Dorf Jaymoni im Distrikt Bagerhat im Südwesten von Bangladesch. Bei dem Fundort handelte es sich um eine hölzerne Säule.[18]
Anlockung nachtaktiver Beutetiere
_female_Domestic_Hunting_Spider_(16289066016).jpg.webp)
Das helle Randband am Carapax der Warmhaus-Riesenkrabbenspinne ist frontal als deutlicher Streifen ausgebildet, der dazu dient, nachtaktive und flugfähige Insekten mit guter Sehfähigkeit, darunter Nachtfalter und einige Bienen, zur Spinne zu locken.[19] Dieser Streifen reflektiert Licht im Bereich von 300 bis zu 700 Nanometern. Allerdings ist bis heute nicht genau geklärt, wie der Streifen die jeweiligen Beutetiere anlockt.[15]
Ähnliche Phänomene sind auch von anderen Spinnen bekannt, etwa Nephila pilipes aus der Familie der Seidenspinnen (Nephilidae), die über gelbe Ventralstreifen auf dem Opisthosoma verfügt, die dieselbe Funktion haben. Weitere Beispiele, die derartige Färbungen auf dem Opisthosoma aufweisen, sind die Spinnenarten Leucauge magnifica (gelbe Ventralstreifen) aus der Familie der Streckerspinnen (Tetragnathidae), Neoscona punctigera (paarige Ventralpunkte) und Argyrodes fissifrons (silbrige Punkte) aus der Familie der Kugelspinnen (Theridiidae). Im Gegensatz zur Warmhaus-Riesenkrabbenspinne legen allerdings diese Arten allesamt Radnetze für den Beutefang an, sodass die Beutetiere dann in deren Netze gelockt werden. Die Warmhaus-Riesenkrabbenspinne, die kein Spinnennetz zum Fangzweck anlegt, erbeutet die Tiere dann direkt, sobald diese in Reichweite gelangen.[15]
Ferner besteht die Vermutung, dass der helle Streifen der Warmhaus-Riesenkrabbenspinne auch dazu dient, nachtaktive Prädatoren mit guter Sicht, etwa Geckos, abzuschrecken, was auch schon bei N. pilipes berichtet wurde. Eine dritte Funktion des Streifens, die vermutet wird, ist das nächtliche Erkennen von Geschlechtspartnern. Diese Annahme rührt von der guten Sehfähigkeit der Warmhaus-Riesenkrabbenspinne, die bei anderen nachtaktive freilaufenden Spinnen, etwa der Großen Wanderspinne (Cupiennius salei), auch gut an die Dunkelheit angepasst ist. Ferner ist überliefert, dass Streifenzeichnungen in der Gesichtsregion bei Springspinnen (Salticidae) einen großen Einfluss auf deren Partnerwahl haben.[15]
Lebenszyklus und Phänologie
Der Lebenszyklus der Warmhaus-Riesenkrabbenspinne ist wie bei anderen Spinnen in mehrere Abschnitte unterteilt. Das Fortpflanzungsverhalten und das Heranwachsen der Jungtiere wurde besonders in Gefangenschaft dokumentiert.
Die Phänologie (Aktivitätszeit) der Warmhaus-Riesenkrabbenspinne umfasst das ganze Jahr.[1] Gleiches trifft auch auf die Entwicklungszeit zu, sodass ausgewachsene Exemplare und Jungtiere simultan zu jeder Jahreszeit angetroffen werden können.[20] Auch die Paarungszeit ist bei der Art nicht auf eine zeitliche Periode beschränkt.[21]
Anlegen des Spermanetzes
Wie bei anderen Spinnen, so legt auch ein geschlechtsreifes Männchen der Warmhaus-Riesenkrabbenspinne ein sog. Spermanetz an und nimmt die darauf zuvor abgegebenen Spermien über seine Bulbi auf, ehe es ein Weibchen aufsucht.[11][22] Die Bulbi werden nach der Aufnahme der Spermien fünf bis 25 Sekunden lang vom Männchen gesäubert.[22]
Balz
Wurde ein Weibchen gefunden, beginnt das Männchen mit seinem bemerkenswerten Balzverhalten, das neben optischen Signalen zusammen mit dem weniger anderer Spinnen, darunter der Fettspinne (Steatoda bipunctata) oder einiger Spring- (Salticidae) oder Vogelspinnen (Theraphosidae), mitunter Stridulationen (Lauterzeugung durch Reiben zweier Körperteile) enthält. Zuerst nähert sich das Männchen allerdings vorsichtig dem Weibchen und hält dabei sein erstes Beinpaar angehoben nach vorne gestreckt. Dann reibt es diese Beine auf jeder Seite aneinander, während das Weibchen unbeweglich verbleibt.[23]
Optische Reize
_(Japanese_name_-_ashidaka-gumo)_(35972086641).jpg.webp)
Das Balzverhalten der Warmhaus-Riesenkrabbenspinne wird unter anderem durch das Wahrnehmen optischer Eigenschaften seitens des Weibchens beeinflusst, darunter von der Größe des Männchens. Ein größeres Männchen wird von einem Weibchen mit größerer Wahrscheinlichkeit als Partner angenommen als ein kleineres. Es wird vermutet, dass dies damit zusammenhängt, dass ein kleineres Männchen einem Weibchen mit größerer Wahrscheinlichkeit entkommen oder von diesem schlechter wahrnehmbar sein kann. Eine dritte Möglichkeit wäre, dass ein größeres Männchen auch über einen größeren Frontalstreifen verfügen kann, der neben seiner Funktion als Lockmittel für Beutetiere und Abwehrmittel gegen Prädatoren eine wichtige Rolle bei der Partnerwahl spielt.[24]
Ein besser ernährtes Männchen weist einen größeren Streifen als eines auf, das weniger Nahrung zu sich genommen hat. Deshalb wird vermutet, dass Weibchen der Warmhaus-Riesenkrabbenspinne Männchen mit gedeckterem Nährstoffbedarf von solchen mit einem geringeren unterscheiden können, die dann letztendlich weniger bevorzugt werden. Allerdings ist bisher unklar, ob die Art chromatische von achromatischen Farbmustern unterscheiden kann. Einige nachtaktive Spinnen, etwa viele Vogelspinnen (Tharaphosidae), verfügen über auffällige Setae (chitinisierte Haare), weshalb auch hier vermutet wird, dass die Farbmuster dieser Spinnen eine wichtige Rolle bei der Paarung spielen. Im Gegensatz dazu scheint die näher verwandte und ebenfalls kontrastreich gefärbte Große Wanderspinne (Cupiennius salei) farbenblind zu sein.[25]
Stridulation

Die Stridulation bildet den zweiten elementaren Bestandteil der Balz der Warmhaus-Riesenkrabbenspinne. Für die Stridulation spreizt das Männchen alle vier Beinpaare, heftet alle daran befindlichen Tarsen (Fersenglieder) an den Untergrund und hebt den Körper leicht an.[26] Im Gegensatz zu den anderen stridulationsfähigen Spinnen erzeugt das Männchen der Warmhaus-Riesenkrabbenspinne diese Geräusche jedoch nicht mittels der Pedipalpen, sondern vermutlich überwiegend durch die beiden hinteren Beinpaare. Es gibt jedoch keine morphologisch wesentlich anders entwickelten Stridulationsorgane als bei den anderen Arten. Bei der Stridulation sind außer an den beiden beteiligten Beinpaaren, dem vierten und dem letzten, auch entlang dem Opisthosoma verlaufende Vibrationen geringen Ausmaßes feststellbar.[27] Bei 1980 gemessenen Frequenzen der Vibrationen der Beine eines balzenden Männchens der Warmhaus-Riesenkrabbenspinne beliefen sich deren Werte auf 63, 83 und 125 Hertz, wobei das vierte Beinpaar die höchste der ermittelten Frequenzen aufwies. Untersuchungen legen jedoch die Vermutung nahe, dass lediglich die Beinbewegungen und besonders die des vierten Beinpaares ausschlaggebend für die Erzeugung von Geräuschen sind und dass es sich bei den Schwingungen des Opisthosomas lediglich um passive und von den Beinbewegungen induzierte Vibrationen handelt.[28] Das aus den Vibrationen des vierten Beinpaares resultierende Geräusch ist ein auch für das menschliche Gehör schwach wahrnehmbares Brummen, das für dieses bis zu 30 Zentimeter weit hörbar ist[29] und in verschieden langen Abständen innerhalb von vier Abschnitten unterschiedlicher Töne erklingt.[29]
Zuerst ertönen mehrere eng aneinander liegende Wellenzüge, deren Schwingungsrate sukzessiv ansteigt und deren Dauer gesamt etwa 25 Sekunden beträgt (ein einzelner Wellenzug dauert etwa zweieinhalb bis vier Sekunden). Darauf folgt als „Primärabschnitt“ ein zweiteiliger Brummton, der zuerst im Ton A und nach einiger Zeit im Ton B ertönt.[26] Die Frequenz fällt hier deutlich höher und homogener als bei den vorherigen Wellenzügen aus, wobei jedoch auch der zweite Teil dieses Abschnitts eine höhere oder niedrigere Frequenz als der erste besitzen kann.[30] Beim dritten Abschnitt wird das akustische Signal für kurze Zeit nahezu gänzlich ausgesetzt und stattdessen vermutlich durch ein Erkundungsverhalten mit einer Dauer von 30 Sekunden ersetzt. Den vierten und letzten Abschnitt bilden dann ähnlich wie beim ersten mehrere Wellenzüge geringer Frequenz. An den letzten Abschnitt anknüpfend kann erneut der erste wieder begonnen werden und sich somit das Balzverhalten wiederholen.[31]
Paarung
_(6747996553).jpg.webp)
Sollte das Weibchen paarungswillig sein und demzufolge auch eine Paarung erfolgen, trommelt das Männchen mit seinen Pedipalpen auf den Untergrund[11] und führt vibrierende Bewegungen aus,[22] ehe es langsam das Weibchen frontal besteigt. Beide Geschlechtspartner nehmen dadurch die für Echte Webspinnen, die ohne Fangnetz jagen, typische Position ein, bei der sie in die jeweils entgegengesetzte Richtung blicken. Unmittelbar vor der Paarung umschließt das Männchen mit den beiden hinteren Beinpaaren das Prosoma des Weibchens.[23]
Die eigentliche Paarung kann bis zu sechs Stunden dauern und das Männchen streicht bei der erstmaligen Einfuhr eines Bulbus die Ventralseite des Weibchens mit seinen Pedipalpen. Während der Paarung wechselt das Männchen seine in die Spermathek des Weibchens einzuführenden Bulbi permanent in einem Abstand von durchschnittlich 20,4 Sekunden,[22] maximal einer Minute.[23] Dabei dauert auch eine einzelne Einführung des jeweiligen Bulbus sechs bis sieben Sekunden.[22] Um dies zu erreichen, kippt das Männchen sein Prosoma entweder zur rechten oder zur linken Seite, hebt mit dem vorderen Beinpaar das Opisthosoma seiner Partnerin, sodass die Einfuhr mit dem jeweils auf der gekippten Seite liegenden Bulbus erfolgen kann.[23]
Nach der Paarung befreit sich oft das zumeist erschöpfte Weibchen gewaltsam vom Griff des Männchens und es kommt nicht selten zu Kannibalismus seitens des Weibchens gegenüber seinem Geschlechtspartner.[32] Die meist höhere Fundrate von weiblichen Individuen der Warmhaus-Riesenkrabbenspinne gegenüber männlichen könnte so erklärt werden.[22]
Kokonherstellung und Eiablage

Ungefähr 10 bis 15 Tage nach der Paarung beginnt das Opisthosoma des trächtigen Weibchens infolge der darin heranreifenden Eier deutlich anzuschwellen. Die Produktion des Eikokons tritt etwa 28 bis 30 Tage nach der Paarung ein.[32] Dieser ist von rundlicher Form, seitlich abgeflacht und besitzt einen Durchmesser von 12,7 bis 25,4 Millimetern und eine Höhe von 3,18 bis 6,35 Millimetern. Im Kokon wurden bei verschiedenen Untersuchungen 188 bis 436 Eier beziehungsweise durchschnittlich 163 und maximal 400 Eier gezählt. Diese haben einen Durchmesser von 1,5 Millimetern.[33] Anfangs ist der Kokon noch cremeweiß gefärbt.[32]
Um den Kokon zu konstruieren, beugt sich das Weibchen vor und nimmt eine etwas C-förmige Körperhaltung ein. Anschließend produziert es Fäden aus Spinnseide aus seinen Spinnwarzen und legt diese auf den Bodengrund, um eine kugelförmige flache Scheibe mit einem Durchmesser von etwa 20 Millimetern zu bilden. Dieser Vorgang dauert zumeist ca. 20 Minuten. Die Spinne bewegt sich dann wiederholt um den Umkreis dieser Scheibe, um jedes Mal mehr Seidenstränge auf dem äußersten Strang abzulegen, bis die kugelförmige Scheibe eine untertassenförmige Struktur mit einer Höhe von etwa einem Millimeter angenommen hat. Danach geht sie um die Seidenstruktur herum und lässt sich dann etwa zwei Minuten lang darauf nieder, um ihre Eier zu legen. Während der Eiablage verliert das Opisthosoma des Weibchens langsam, aber deutlich sichtbar an Volumen. Nach der Eiablage nimmt das Weibchen wieder die C-förmige Körperstellung ein und widmet sich der Fertigstellung des Kokons, indem es erneut das Seidenkonstrukt um dessen Achse umkreist, um weitere Seidenstränge abzulegen und somit den Kokon von oben zu versiegeln.[32]
Inkubation
_(6105403151).jpg.webp)
Nach der Fertigung des Kokons drückt das Weibchen diesen für etwa zwei Minuten unter sich an sein Opisthosoma, ehe es den Kokon mit Hilfe seiner Pedipalpen vom Untergrund trennt. Der Kokon wird von dem Weibchen während der gesamten Inkubationszeit mit Hilfe der Cheliceren und der Pedipalpen nahe am Sternum (Brustschild des Prosomas) gehalten. Der anfangs helle Kokon verdunkelt sich allmählich und schrumpft überdies im Laufe der Zeit leicht. Das Weibchen trägt den Kokon bis zum Schlupf, der etwa 30 Tage nach der Eiablage erfolgt, ununterbrochen mit sich herum und nimmt in dieser Zeit keine Nahrung zu sich. Aufgrund dessen kann auch der Hungertod des Weibchens daraus resultieren oder der Kokon wird vom Weibchen aufgefressen.[32] Kokons mit unbefruchteten Eiern werden von ihren Herstellern fallen gelassen oder ebenfalls verzehrt.[33] In diesem Fall wird die Inkubation unterbrochen und somit auch ein Schlupf der Jungtiere ohne Weiteres verhindert.[32]
Ein begattetes Weibchen kann nacheinander maximal drei Kokons produzieren. Mit zunehmender Anzahl der von einem Weibchen angelegten Kokons wird die Schlupfrate allerdings geringer und kann unter einem Drittel der Maximalschlupfrate des ersten Kokons herabfallen. Der zeitliche Intervall der nacheinander folgenden Eikokons liegt bei etwa 50 bis 60 Tagen. Ferner ist möglich, einem Weibchen der Warmhaus-Riesenkrabbenspinne einen zuvor von einem anderen gefertigten Kokon zu geben, der von diesem dann angenommen und wie der eigene behandelt wird. In diesem Falle findet auch ein Schlupf der Jungtiere nach einer erfolgreichen abgeschlossenen Inkubation statt.[32]
Schlupf
.jpg.webp)
_(19760243544).jpg.webp)
Die Jungspinnen schlüpfen nach etwa acht bis 14 Tagen in Form von Prälarven und durchleben in dieser Form zwei Stadien. Im ersten wird das Chorion des Eis größtenteils abgestoßen und bleibt am hinteren Ende der Prälarve als zerknittert erscheinende Masse zurück. Das erste Stadium dauert ein bis sechs Tage. Im zweiten wird die Vitellinmembran (Dotterhaut) vollständig abgestoßen. Nach etwa fünf oder sechs Tagen nach dem Beginn dieses Stadiums erscheinen die Augenpigmente und kurz darauf auch die für die Art typischen Zeichenelemente und die Seten. In diesem Stadium verbleiben die Prälarven bis zu zehn Tagen, ehe sie sich das erste Mal häuten und sich somit im Larvenstadium befinden. Diese beiden Prozesse finden noch im Eikokon statt[33]
Etwa 28 Tage nach der Eiablage werden mehrere winzige Löcher an der Hülle des Eikokons sichtbar, der nun kurz vor dem Schlupf der Jungtiere einen grauen Farbton annimmt. In regelmäßigen Abständen vergrößert das Weibchen diese Löcher mit seinen Beinen. Nach weiteren 29 bis 40 Tagen (durchschnittlich etwa 32) verlassen die Jungspinnen nun den Eikokon, wobei bei einigen Eiern die Inkubation fehlschlagen kann und ein Schlupf hier somit nicht erfolgt. Geschlüpfte Jungtiere versammeln sich zuerst auf der Hülle des nun leeren Eikokons, der noch immer vom Weibchen gehalten wird und in die sie sich bei Störungen zurückziehen. Die Jungtiere werden selbstständig, indem sie zu diesem Zeitpunkt Seidenstränge produzieren und sich mit deren Hilfe vom Kokon aus abseilen. Der leere Eikokon wird vom Weibchen nach dem Schlüpfen etwa 10 Tage lang gehalten, bis es diesen schließlich fallen lässt. Daraufhin ist dessen Nahrungsbedarf bedingt durch die zuvorigen Phasen der Entwicklung stark gestiegen und es versucht für diesen Zweck, eine Vielzahl an Beutetieren zu erlegen.[32]
Entwicklung der Jungtiere
%253F_(5780817470).jpg.webp)
Wie bei Gliederfüßern üblich, wachsen auch die Jungtiere der Warmhaus-Riesenkrabbenspinne über Häutungen heran und durchleben dabei mehrere Fresshäute (Häutungsstadien von Spinnen). Männchen durchlaufen dafür insgesamt neun Häutungen und Weibchen zwölf. Im Regelfall häuten sich diese Jungspinnen einmal im Monat. Ein bis zwei Tage vor der Häutung stellt ein Jungtier die Nahrungsaufnahme ein, nimmt einen dunkleren Farbton an und beginnt nun unmittelbar vor der Häutung sich an einem Spinnfaden kopfüber aufzuhängen und zieht anschließend die Beine zusammen. Die Häutung findet nachts statt und dauert etwa 30 Minuten. Ein gehäutetes Jungtier nimmt nach etwa weiteren fünf Tagen nach der Häutung die Nahrungsaufnahme wieder auf.[32]

Nach jeder Häutung nehmen die verschiedenen Körperteile unterschiedlich an Größe zu. Insbesondere bei heranwachsenden Männchen ist die Verlängerung der Beine nach einer Häutung zumeist höher als bei Weibchen. Insbesondere ab der siebten Häutung wird der Sexualdimorphismus deutlich. Der Ansatz der Bulbi wird bei Männchen hier sichtbarer und die Beine sind verglichen mit denen von Weibchen in diesem Stadium deutlich länger. Bei Spinnen, die unter Laborbedingungen das Adultstadium erreicht haben, nimmt das Prosoma eine Länge von 5,6 Millimeter an. Eine Abweichung von 0,3 Millimetern kann dabei auftreten. Das Opisthosoma wird nach der Reifehäutung 5,8 Millimeter mit einer Abweichung von 0,5 Millimetern lang. Die vier Beinpaare erreichen nach der Reifehäutung eine Gesamtlänge von 47,1 Millimetern mit einer Abweichung von 3,1 Millimetern. Die Pedipalpen werden zum Schluss 4,9 Millimeter lang, wobei auch hier eine Abweichung in diesem Fall von 0,5 Millimetern auftreten kann.[10]
Während einer Häutung kann es vorkommen, dass Bestandteile der Gliedmaßen im alten Exoskelett (chitinisierte Stützstruktur) stecken bleiben und nach Abtrennung mit der abgestreiften Exuvie (abgeworfenes Exoskelett nach einer Häutung) verschmelzen. In der darauf folgenden Häutung werden die fehlenden Extremitäten ersetzt, die danach jedoch kleiner sind. Mit jeder darauf folgenden Häutung wachsen diese Gliedmaßen jedoch an die Größe der ursprünglichen heran. Lediglich ausgewachsene Spinnen können keine verloren gegangenen Extremitäten mehr regenerieren, da diese sich nach der letzten Häutung, der sog. Reifehäutung, nach der dann auch die Geschlechtsreife eintritt, nicht mehr häuten.[10]
Dauer des Heranwachsens und Lebenserwartung
.jpg.webp)
Die Männchen benötigen für das Heranwachsen dadurch, dass sie weniger Häutungen durchlaufen, mit 304,7 Tagen und einer eventuell auftretenden Abweichung von 12 Tagen etwas weniger Zeit als die Weibchen, deren Entwicklung sich auf 391,6 Tage mit einer möglichen Abweichung von 2,9 beläuft.[10]
Unter Laborbedingungen erreichen Männchen eine gesamte Lebensdauer (mitsamt dem Embryonalstadium) von 355 bis zu 586 und Weibchen eine von 298 bis zu 710 Tagen. Die Überlebensrate beträgt unter diesen Bedingungen 85 %.[34]
Toxikologie
Das Gift der Warmhaus-Riesenkrabbenspinne besteht aus niedermolekularen Substanzen und Salzen, sowie aus Peptiden und Proteinen.[35] Letztere wirken teilweise als Spinnentoxine, deren Beschaffenheit und Wirkung mithilfe der Toxikologie erforscht wird.
Zusammensetzung des Giftes
| Toxin | Masse (Da)[36][37] | Aminosäuren[36] | EC50 (Kv4.2)[38] |
| HpTx1 | 3910,57 | 33 | 100 nM |
| HpTx2 | 3412,72 | 30 | 100 nM |
| HpTx3 | 3599,38 | 31 | 67 nM |
Das Gift der Warmhaus-Riesenkrabbenspinne wird als klare, farblose Flüssigkeit, die sich leicht in Wasser lösen lässt, beschrieben. Es wirkt tödlich auf Küchenschaben mit einem LD50-Wert von 28,18 μg/g. Seine Dichte beträgt 978 mg/ml, der Proteingehalt beträgt etwa 32 %. Unter den Proteinen finden sich über 100 Peptide,[35][39] von denen der Großteil in einem Molekulargewichtsbereich von 3000 bis 5000 Da liegt, was 27 bis 40 Aminosäuren entspricht.[40] In diesem Gewichtsbereich befinden sich auch die drei Heteropodatoxine (HpTx)[36] sowie das Insektizid μ-Sparatoxin-Hv2.[41] Anhand der Peptidsequenz und der Position der Cystein-Einheiten können 154 Peptid-Präkursoren aus dem Spinnengift in 24 Familien unterteilt werden.[39][42]
Die Heteropodatoxine sind Inhibitoren für spannungsaktivierte Kaliumkanäle mit Massen von 3,4 kDa bis 4 kDa. Sie bestehen aus 30–33 Aminosäuren mit amidiertem C-Terminus und weisen ein Sequenzidentität von 39–41 % untereinander auf. Dabei sind die sechs die Tertiärstruktur bestimmenden Cystein-Einheiten in ähnlichen Positionen und bilden drei Disulfid-Brücken aus.[43] Außerdem weist das HpTx3 mit 39 % eine hohe Gemeinsamkeit mit dem in Grammostola rosea vorkommenden Hanatoxin 2 (HaTx2) auf.[36] Die HpTx blocken die Kv4.2-Kanäle spannungsabhängig, was zu einem verlängerten Aktionspotential führt.[43]
Das μ-Sparatoxin-Hv2 wirkt hauptsächlich insektizid. Auf die Navs-Kanäle von Küchenschabenzellen wirkt das Toxin mit einem IC50 von 6,25 μg/ml[44] bzw. 833,7 nM,[45] während es keinen Effekt auf Kalium- und Calciumkanäle hat. Auf Rattenzellen hat das Toxin eine schwächere Wirkung und blockiert die Kanäle nur partiell,[44] während es auf Mäuse bei einer Dosis von 7,0 μg/g keine Wirkung zeigt.[45][46]
Die Peptide als Indikator für die evolutionäre Entwicklung von Spinnentoxinen
Anhand der Warmhaus-Riesenkrabbenspinne lässt sich die Evolution von Cystein-reichen Peptiden zwischen den Vogelspinnenartigen (Mygalomorphae) und den Echten Webspinnen (Araneomorphae) verdeutlichen. Die Art zählt wie alle der Riesenkrabbenspinnen zu den vergleichsweise primitiver gebauten Echten Webspinnen. Die phylogenetischen Beziehungen zwischen den Spinnenfamilien zeigen, dass sich die Warmhaus-Riesenkrabbenspinne wie andere Riesenkrabbenspinnen stammesgeschichtlich zwischen den primitiveren Vogelspinnen (Theraphosidae) und den moderneren Wolfsspinnen (Lycosidae) befindet. Mit diesen und einigen weiteren Spinnenfamilien teilen auch die Riesenkrabbenspinnen die Jagdtatiken als Lauerjäger, die ohne Spinnennetz jagen und stehen somit in Kontrast zu den netzbauenden Spinnen, die sich erst später entwickelt haben und deren Gifte eine höhere Komplexität und Wirksamkeit aufweisen.[47]
Cysteinhaltigen Peptide sind ein weiteres Indiz dafür, dass die Warmhaus-Riesenkrabbenspinne zu den frühzeitlicheren rezenten Vertretern der Echten Webspinnen zählt, da der Anteil an Cystein in Spinnentoxinen mit fortschreitender evolutionärer Entwicklung abgenommen hat. Die Cystein-reichen Peptide mit je sechs Cystein-Einheiten können bei Vogelspinnenartigen, etwa der Schwarzen (Cyriopagopus hainanus) und der Blauen Tigervogelspinne (C. schmidti) sowie den Vogelspinnenarten Grammostola rosea und Chilobrachys jingzhao über 69 % der gesamten Proteine ausmachen. Bei der Warmhaus-Riesenkrabbenspinne sind es 55 % des Toxinproteins, während die Giftpeptide der zu den Kreuzspinnen (Araneus) zählenden Art Araneus ventricosus nur noch zu 10 % aus Cystein-reichen Peptiden mit sechs Cysteinbindungen besteht. Einige Spinnenarten, darunter die Raubspinnenart Dolomedes mizhoanus, die wie die Warmhaus-Riesenkrabbenspinne ohne Fangnetz jagt, sowie die zu den Wolfsspinnen zählende Südrussische Tarantel (Lycosa singoriensis) weisen keine dieser Proteine in ihren Toxinen auf.[48]
Identifikation und Nomenklatur
Ein Vorläufer der Cystein-reichen Peptide in voller Länge enthält je eine Signalsequenz und ein reifes Peptid, während einige Vorläufer der Cystein-reichen Peptide zusätzlich ein Präkursor-Protein vor der reifen Toxinsequenz enthalten, was auch auf Vorläufer der überwiegenden Mehrheit der zuvor berichteten Peptide der Spinnentoxine zutrifft. Die Ausrichtung der resultierenden Aminosäuresequenzen ergab für die meisten auftretenden Formen der Cystein-reichen Peptiden eine weitgehende Variation der Molekülstruktur von den Transkripten.[42]
Systematik
Die Systematik befasst sich im Bereich der Biologie sowohl mit der taxonomischen (systematischen) Einteilung als auch mit der Bestimmung (Biologie) und mit der Nomenklatur (Disziplin der wissenschaftlichen Benennung) von Lebewesen einschließlich der Warmhaus-Riesenkrabbenspinne.
Der Artname venatoria ist eine Abwandlung des lateinischen Substantivs venator, welches übersetzt „Jäger“ bedeutet.
Beschreibungsgeschichte
Die Warmhaus-Riesenkrabbenspinne erfuhr seit ihrer Erstbeschreibung mehrere Umstellungen und Umbenennungen. Erstbeschreiber Carl von Linné gab der Art 1767 den Namen Aranea venatoria (damals wurden alle Spinnen in diese heute nicht mehr bestehende Gattung eingeteilt). Als Pierre André Latreille 1804 die Gattung Heteropoda erstmals beschrieb, ordnete er auch die Warmhaus-Riesenkrabbenspinne in selbige ein und sie erhielt die noch heute gültige Bezeichnung Heteropoda venatoria, die ab der Zeit um 1900 nahezu durchgehend genutzt wird. Heute ist die Warmhaus-Riesenkrabbenspinne die Typusart der Gattung.[8]
Unterarten
Die Warmhaus-Riesenkrabbenspinne besitzt neben der Nominatform H. v. venatoria zwei weitere Unterarten, die 1881 von Tord Tamerlan Teodor Thorell erstbeschrieben wurden. Bei diesen handelt es sich um folgende:
Synonymisierte Arten und Unterarten
Unter Peter Jäger wurden 2014 mehrere vorherige Arten aus der Familie der Riesenkrabbenspinnen mit der Warmhaus-Riesenkrabbenspinne synonymisiert und verloren somit ihren Artstatus. Ein Beispiel ist die 1845 von Carl Ludwig Koch entdeckte Art Ocypete thoracica, die von Jäger anhand der Illustration Kochs durch die Zeichnung des Carapax als Warmhaus-Riesenkrabbenspinne identifiziert werden konnte. 1878 beschrieb Tord Tamerlan Teodor Thorell angeblich ein von der indonesischen Insel Ambon stammendes Männchen. Er erwähnt bereits damals die Ähnlichkeit dieses Tiers zur Warmhaus-Riesenkrabbenspinne und erwog, ob es sich dabei um eine Unterart von dieser handelt.[51]
Carl Ludwig Kochs Sohn Ludwig Carl Christian Koch beschrieb zwei Weibchen der Warmhaus-Riesenkrabbenspinne als neue Arten unter dem heute nicht mehr verwendeten Gattungsnamen Sarotes. Davon ist eine, Sarotes aulicus anhand der Illustration als Warmhaus-Riesenkrabbenspinne identifizierbar. Die zweite ist Sarotes invictus, die von Friedrich Wilhelm Bösenberg und Embrik Strand falsch bestimmt wurde.[51] Strand erkannte den Irrtum und ordnete in einer 1906 und somit drei Jahre nach dem Tod Bösenbergs erschienenen Publikation das gefundene Exemplar der mit der Warmhaus-Riesenkrabbenspinne nah verwandten Art Heteropoda invicta zu.[8] Ferdinand Karsch fertigte bereits 1881 eine Illustration eines Männchens an, das allerdings eindeutig eines der zur gleichen Familie zählenden Art Sinopoda forcipata darstellt. Der weibliche Holotyp von Sarotes invictus hingegen ist deutlich der Warmhaus-Riesenkrabbenspinne zuzuordnen, was die Synonymisierung mit der Warmhaus-Riesenkrabbenspinne bekräftigt.[51]
Auch der Holotyp der 1881 von Karsch erstbeschriebenen Art Sinopoda formicata erwies sich 2014 als Exemplar der Warmhaus-Riesenkrabbenspinne. Dieser Holotyp besitzt eine Länge von 27,3 Millimetern und wurde anfangs von Karsch um etwa 30 gemessen. Diese Fehlmessung mag vielleicht daraus resultieren, dass in Ethanol eingelagerten Spinnen mit der Zeit einen längeren Petilous (Trennstiel zwischen Prosoma und Opisthosoma) bekommen, was von Karsch eventuell nicht beachtet wurde.[51]
Eine weitere der Gattung Sarodes zugeordnete Art war S. truncus, die 1878 von Henry Christopher McCook erstbeschrieben wurde. McCook erwähnte schon damals die starke Ähnlichkeit von S. truncus zur Warmhaus-Riesenkrabbenspinne, die sich lediglich durch die Form des Prosomas von anderen ihm bekannten Individuen von letzterer Art unterschied, weshalb McCook selber in Frage stellte, ob S. truncus wirklich eine eigene Art bildet. Da der Erstbeschreiber dieser fragwürdigen Art selber betont, dass alle anderen Eigenschaften des von ihm beschriebenen Exemplars mit den arttypischen der Warmhaus-Riesenkrabbenspinne übereinstimmen, wird vermutet, dass das Prosoma dieses Exemplars durch eine Fehlhäutung verformt wurde und somit das abweichende Erscheinungsbild des Prosomas erklärt werden könnte.[51]
Strand beschrieb 1907 folgende drei Unterarten:
- Heteropoda venatoria chinesica
- Heteropoda venatoria japonica
- Heteropoda venatoria maculipes
Bei H. v. chinesica und H. v. japonica unterscheiden sich lediglich die zwei Zähne und der distale Rand der retrolateralen Tibiaabophyse von der Nominatform der Warmhaus-Riesenkrabbenspinne, was nicht als Kriterium für eine eigene Art sowie Unterart ausreichend wäre. Bei H. v. maculipes erwähnt Strand eine Farbvariation, die sich jedoch im Nachhinein nie bestätigen ließ.[51]
Strand beschrieb 1915 außerdem die sehr ähnliche Art Heteropoda nicki aus Java und die Unterart H. n. quala aus Sumatra, die beide eine der Warmhaus-Riesenkrabbenspinne sehr ähnliche Epigyne und Vulva aufweisen. Sowohl H. nicki als auch die Unterart lassen sich lediglich durch die von Strand angegebene und kleiner ausfallende Größe als die für die Warmhaus-Riesenkrabbenspinne übliche unterscheiden, obgleich auch ähnlich kleine Individuen letzter Art etwa vom Krakatau-Archipel bekannt sind. Gleiches trifft auch auf die 1961 von Takeo Yaginuma erstbeschriebene Art Heteropoda tokarensis zu, deren Illustrationen sich ebenfalls 2014 als Warmhaus-Riesenkrabbenspinne rausstellte.[51]
Von Benoy Krishna Tikader wurde 1977 die Art Heteropoda andamanensis von den Andamanen erstbeschrieben, die durch Illustrationen anfangs tatsächlich arteigene Merkmale aufwies. Diese waren die hakenförmige dorsal-retrolaterale Tibiaabophyse und das leicht sichtbare mediane Septum bei den Bulbi sowie die sehr schmale anteriore (vorhergehende) Breite des Prosomas. Allerdings wurden von Tikader und Veena D. Sethi 1988 die Illustrationen überarbeitet, sodass die abgebildeten Exemplare von nun an ein breiteres Prosoma und eine zwar vorhandene, aber nicht mehr hakenförmige dorsal-retrolaterale Tibiaabophyse. Außerdem berühren sich nun die Seitenlappen der Epigyne, wie es bei der Warmhaus-Riesenkrabbenspinne der Fall ist. Weitere Eigenschaften, die H. andamanensis mit dieser auf den Illustrationen teilte, sind die Form und der Verlauf des Samenleiters sowie der Spermophoren, was die Synonymisierung bekräftigt.[51]
Tikader beschrieb neben H. andamanensis im gleichen Jahr auch Heteropoda nicobarensis, die, entsprechend der Bezeichnung auf den Nikobaren entdeckt wurde. Sethi und Tikader fertigten 1988 erstmals eine Illustration des weiblichen Holotyps mitsamt der Vulva an. Alle Illustrationen und insbesondere die des Holotyps entsprechen ebenfalls der Warmhaus-Riesenkrabbenspinne. Auch die 1991 von Ai-Hua Li erstbeschriebene Art Heteropoda hainanamensis lässt sich anhand der Illustrationen der drei aus der chinesischen Provinz Hainan weiblichen Holotypen als Synonym der Warmhaus-Riesenkrabbenspinne belegen.[51]
Warmhaus-Riesenkrabbenspinne und Mensch

Es kommt insbesondere in den tropischen Gebieten nicht selten zu einer Begegnung zwischen dem Menschen und der Warmhaus-Riesenkrabbenspinne. Die Art erhält bei ihm deshalb und nicht zuletzt bedingt durch ihre globale Einschleppung einen unterschiedlich ausfallenden Ruf.
Die Warmhaus-Riesenkrabbenspinne als Nützling

Insbesondere in den tropischen Gebieten gilt die Warmhaus-Riesenkrabbenspinne nicht selten als Nützling und als willkommener Gast in Häusern, da sie dort eine Vielzahl von Schädlingen wie Schaben dezimiert.[1][2] Auch auf Bananenplantagen hat sich die Art als nützlich erwiesen und kann dort bei ausreichend hoher Individuendichte die Populationen von Schädlingen erheblich minimieren.[52]
Aufgrund der nomadischen Lebensweise und dem großen Beutespektrum, das viele Schädlinge umfasst, wird die Warmhaus-Riesenkrabbenspinne überdies als nützlicher als andere, insbesondere netzbauende Spinnen betrachtet. Neben Befällen von Schaben sollen sich auch solche von Fliegen mithilfe der Art vergleichsweise leicht bekämpfen lassen. Ein Versuch, der 1990 in Gebäuden in Südafrika durchgeführt wurde, hatte diese Annahme bekräftigt, als in den Gebäuden ausgesetzte Individuen der Warmhaus-Riesenkrabbenspinne innerhalb von zweieinhalb Monaten die gesamten Populationen der darin vorkommenden Fliegen insgesamt um 99 % reduziert haben. Damit sank auch das Vorkommen von gastrointestinalen (den Verdauungstrakt betreffenden) Infektionen auf den Menschen in dieser Region, da die Fliegen als Überträger dieser fast gänzlich dezimiert worden sind.[17]
Als Lebensmittel
Die Warmhaus-Riesenkrabbenspinne zählt zu den essbaren Spinnen.[53] Eine Verzehrshistorie ist wissenschaftlich für Venezuela dokumentiert.
Terraristik
Die Warmhaus-Riesenkrabbenspinne wird, bedingt durch ihr für Spinnen imposantes Erscheinungsbild, auch gelegentlich als Heimtier in der Terraristik gehalten. Die Art gilt aufgrund ihrer Robustheit und Anpassungsfähigkeit als pflegeleicht, jedoch sollte ihre hohe Laufgeschwindigkeit beachtet werden. Nachzuchten gibt es in Gefangenschaft ebenfalls.[54]
Einfuhr durch Bananenfrüchte und Reaktionen

Da Individuen der Warmhaus-Riesenkrabbenspinne sich bedingt durch ihren Körperbau geschickt und nicht selten unbemerkt an Bananenstauden verstecken können, kommt es gelegentlich zu oftmals als unerfreulich betrachteten Einfuhren sowohl von lebendigen als auch verstorbenen Exemplaren der Warmhaus-Riesenkrabbenspinne oder deren Exuvien durch den Import von Bananenfrüchten.[52] Dies hat der Art auch die Bezeichnung „banana spider“ (übersetzt: „Bananenspinne“) eingebracht. Sie sollte jedoch nicht mit den unter der gleichen Bezeichnung bekannten und für den Menschen ebenfalls deutlich gefährlicheren Vertretern der Gattung Phoneutria aus der Familie der Kammspinnen (Ctenidae) verwechselt werden.[2]
Insbesondere in Gebieten, in denen die Warmhaus-Riesenkrabbenspinne zumindest im Freiland nicht etabliert ist, können Funde der Art etwa in Supermärkten durch das imposante und für einige Menschen gefährlich wirkende Erscheinungsbild Panik auslösen. Dies wird durch die Befürchtung verstärkt, dass es sich bei diesen Individuen der Art um wesentlich gefährlichere und in der Vergangenheit ebenfalls durch Bananenstauden exportierte Spinnen, etwa um solche der Brasilianischen Wanderspinne (Phoneutria nigriventer), handeln könne. Ein Beispiel ist ein 2016 in einem Supermarkt der Kette Rewe in der zum oberfränkischen Landkreis Kronach gelegenen Gemeinde Wilhelmsthal gefundenes Exemplar der Warmhaus-Riesenkrabbenspinne, das später sicher als Individuum der Art durch Arachnologen des Senckenberg-Forschungsinstitutes in Frankfurt am Main identifiziert werden konnte.[55]
Bissunfälle und Symptome
Bedingt durch ihre Größe und ihren kräftigen Cheliceren ist es der Warmhaus-Riesenkrabbenspinne möglich, beim Biss die Haut des Menschen zu durchdringen. Die Art ist jedoch nicht aggressiv und beißt nur in größter Not. Ausgenommen sind trächtige Weibchen oder solche, die ihren Eikokon verteidigen.[1] Ansonsten können sich Bissunfälle der Warmhaus-Riesenkrabbenspinne dadurch ergeben, dass Individuen der Art unachtsam gehalten, bedrängt oder eingequetscht werden.[2]
Die Symptome des Bisses gelten als medizinisch nicht relevant. Vermerkt sind lokale Schmerzen und gelegentlich Schwellungen im Bereich der Bisswunde.[2] Die Schmerzen klingen innerhalb weniger Minuten wieder ab.[1]
Bedrohung und Schutz
Die globalen Bestände der Warmhaus-Riesenkrabbenspinne werden von der IUCN nicht erfasst.[56] Demzufolge gibt es keine Angaben über potentielle Gefährdungen der Art und sie unterliegt auch keinem Schutz.
Auch in der Roten Liste gefährdeter Arten Tiere, Pflanzen und Pilze Deutschlands bzw. der Roten Liste und Gesamtartenliste der Spinnen Deutschlands (2016) wird die Art nicht bewertet, da die Warmhaus-Riesenkrabbenspinne in Deutschland nicht heimisch ist und ohnehin nur in beheizten Einrichtungen vorkommt. Hier gilt die Art als sehr selten und ihre Bestände nehmen langfristig zu.[57]
Einzelnachweise
- Heteropoda venatoria (Linnaeus, 1767) bei araneae - Spiders of Europe, abgerufen am 19. Januar 2020.
- University of Florida: Huntsman Spider, Heteropoda venatoria (Linnaeus) (Arachnida: Araneae: Sparassidae). von Glavis Bernard Edwards Jr., abgerufen am 19. Januar 2020.
- Christian Lorenz: The spider Heteropoda venatoria and its visual system. 2012, S. 7, doi:10.25365/thesis.21679., abgerufen am 7. Januar 2021.
- Christian Lorenz: The spider Heteropoda venatoria and its visual system. 2012, S. 7–8, doi:10.25365/thesis.21679., abgerufen am 7. Januar 2021.
- Christian Lorenz: The spider Heteropoda venatoria and its visual system. 2012, S. 8, doi:10.25365/thesis.21679., abgerufen am 7. Januar 2021.
- Peter Jäger: Heteropoda Latreille 1804: new species, synonymies, transfers and records (Araneae: Sparassidae: Heteropodinae). In: Arthropoda Selecta. Band 23, Nr. 2, 2014, S. 153., abgerufen am 30. September 2020.
- Peter Jäger: Selten nachgewiesene Spinnenarten aus Deutschland (Arachnidae: Araneae). In: Arachnologische Mitteilungen. Band 19, Nr. 1, Juni 2000, S. 53., abgerufen am 5. Januar 2021. 24. September 2020.
- Heteropoda venatoria (Linnaeus, 1767) im WSC World Spider Catalog, abgerufen am 19. Januar 2020.
- Jude A. Ewunken, Nelson N. Ntonifor, Mbua Christophe Parr: BIOECOLOGY OF Heteropoda venatoria (Linnaeus) (Araneae: Sparassidae) AND ITS IMPLICATIONS IN A TROPICAL BANANA AGROECOSYSTEM. In: Journal of Global Agriculture and Ecology. Band 5, Nr. 2, 2016, ISSN 2454-4205, S. 164., abgerufen am 24. September 2020.
- Jude A. Ewunken, Nelson N. Ntonifor, Mbua Christophe Parr: BIOECOLOGY OF Heteropoda venatoria (Linnaeus) (Araneae: Sparassidae) AND ITS IMPLICATIONS IN A TROPICAL BANANA AGROECOSYSTEM. In: Journal of Global Agriculture and Ecology. Band 5, Nr. 2, 2016, ISSN 2454-4205, S. 169., abgerufen am 24. September 2020.
- Jude A. Ewunken, Nelson N. Ntonifor, Mbua Christophe Parr: BIOECOLOGY OF Heteropoda venatoria (Linnaeus) (Araneae: Sparassidae) AND ITS IMPLICATIONS IN A TROPICAL BANANA AGROECOSYSTEM. In: Journal of Global Agriculture and Ecology. Band 5, Nr. 2, 2016, ISSN 2454-4205, S. 164., abgerufen am 24. September 2020.
- Jude A. Ewunken, Nelson N. Ntonifor, Mbua Christophe Parr: BIOECOLOGY OF Heteropoda venatoria (Linnaeus) (Araneae: Sparassidae) AND ITS IMPLICATIONS IN A TROPICAL BANANA AGROECOSYSTEM. In: Journal of Global Agriculture and Ecology. Band 5, Nr. 2, 2016, ISSN 2454-4205, S. 173., abgerufen am 24. September 2020.
- Heteropoda venatoria (Linnaeus, 1767) beim Wiki der Arachnologischen Gesellschaft e. V., abgerufen am 6. Januar 2021.
- Peter Jäger: Selten nachgewiesene Spinnenarten aus Deutschland (Arachnidae: Araneae). In: Arachnologische Mitteilungen. Band 19, Nr. 1, Juni 2000, S. 53., abgerufen am 24. September 2020.
- Shichang Zhang, Hong-Lin Chen, Kuan-Yu Chen, Jian-Jun Huang, Chia-Chen Chang, Dakota Piorkowski, Chen-Pan Liao, I-Min Tso: A nocturnal cursorial predator attracts flying prey with a visual lure. In: Animal Behaviour. Band 102, Nr. 1, 2015, S. 123, doi:10.1016/j.anbehav.2014.12.028., abgerufen am 9. Januar 2021.
- Mansur Ahmed, Jinnat Anam, Prasanta Kumar Saikia, Pratisha Kumari Saikia: Role of Heteropoda venotoria in Household pest Control : A comparative study. In: Asian Journal of Biological and Life Sciences. Band 3, Nr. 1, 30. April 2014, S. 21., abgerufen am 7. Januar 2021.
- Mansur Ahmed, Jinnat Anam, Prasanta Kumar Saikia, Pratisha Kumari Saikia: Role of Heteropoda venotoria in Household pest Control : A comparative study. In: Asian Journal of Biological and Life Sciences. Band 3, Nr. 1, 30. April 2014, S. 22., abgerufen am 7. Januar 2021.
- Amit Kumer Neogi: Predation of Common House Gecko Hemidactylus frenatus Schlegel, 1836 by Giant Crab Spider Heteropoda venatoria Linnaeus, 1767. In: Bugs R ALL. Band 23, Nr. 1, 21. August 2017, ISSN 2230-7052, S. 23., abgerufen am 7. Januar 2021.
- Shichang Zhang, Hong-Lin Chen, Kuan-Yu Chen, Jian-Jun Huang, Chia-Chen Chang, Dakota Piorkowski, Chen-Pan Liao, I-Min Tso: A nocturnal cursorial predator attracts flying prey with a visual lure. In: Animal Behaviour. Band 102, Nr. 1, 2015, S. 122–123, doi:10.1016/j.anbehav.2014.12.028., abgerufen am 9. Januar 2021.
- Dr. Rita Bhandari, Sachin R. Patil: NOTE ON REPRODUCTIVE BEHAVIOUR OF THE GIANT CRAB SPIDER, HETEROPODA VENATORIA (LINNAEUS, 1767). In: RESEARCH FIELD: ZOOLOGY. Band 6, Nr. 1, ISSN 0974-5297, S. 121.
- Jude A. Ewunken, Nelson N. Ntonifor, Mbua Christophe Parr: BIOECOLOGY OF Heteropoda venatoria (Linnaeus) (Araneae: Sparassidae) AND ITS IMPLICATIONS IN A TROPICAL BANANA AGROECOSYSTEM. In: Journal of Global Agriculture and Ecology. Band 5, Nr. 2, 2016, ISSN 2454-4205, S. 166., abgerufen am 24. September 2020.
- John Ross, David B. Richman: The life cycle of Heteropoda venatoria (Linnaeus) (Araneae: Heteropodidae). In: Psyche A Journal of Entomology. Band 89, Nr. 3-4, Januar 1982, S. 299, doi:10.1155/1982/26072., abgerufen am 6. Januar 2021.
- Jude A. Ewunken, Nelson N. Ntonifor, Mbua Christophe Parr: BIOECOLOGY OF Heteropoda venatoria (Linnaeus) (Araneae: Sparassidae) AND ITS IMPLICATIONS IN A TROPICAL BANANA AGROECOSYSTEM. In: Journal of Global Agriculture and Ecology. Band 5, Nr. 2, 2016, ISSN 2454-4205, S. 167., abgerufen am 24. September 2020.
- Shichang Zhang, Ho-Yin Yip, Ming-Yu Lee, Li Liu, Dakota Piorkowski, Chen-Pan Liao, I-Min Tso: Vision-mediated courtship in a nocturnal arthropod. In: Animal Behaviour. Band 142, Nr. 1, Juni 2018, S. 187–188, doi:10.1016/j.anbehav.2018.06.016., abgerufen am 9. Januar 2021.
- Shichang Zhang, Ho-Yin Yip, Ming-Yu Lee, Li Liu, Dakota Piorkowski, Chen-Pan Liao, I-Min Tso: Vision-mediated courtship in a nocturnal arthropod. In: Animal Behaviour. Band 142, Nr. 1, Juni 2018, S. 188–189, doi:10.1016/j.anbehav.2018.06.016., abgerufen am 9. Januar 2021.
- Jerome S . Rovner: VIBRATION IN HETEROPODA VENATORIA (SPARASSIDAE) : A THIRD METHOD OF SOUND PRODUCTION IN SPIDERS. In: Journal of Arachnology. Band 8, Nr. 1, 1980, S. 194., abgerufen am 7. Januar 2021.
- Jerome S . Rovner: VIBRATION IN HETEROPODA VENATORIA (SPARASSIDAE) : A THIRD METHOD OF SOUND PRODUCTION IN SPIDERS. In: Journal of Arachnology. Band 8, Nr. 1, 1980, S. 197., abgerufen am 7. Januar 2021.
- Jerome S . Rovner: VIBRATION IN HETEROPODA VENATORIA (SPARASSIDAE) : A THIRD METHOD OF SOUND PRODUCTION IN SPIDERS. In: Journal of Arachnology. Band 8, Nr. 1, 1980, S. 196., abgerufen am 7. Januar 2021.
- Jerome S . Rovner: VIBRATION IN HETEROPODA VENATORIA (SPARASSIDAE) : A THIRD METHOD OF SOUND PRODUCTION IN SPIDERS. In: Journal of Arachnology. Band 8, Nr. 1, 1980, S. 193., abgerufen am 7. Januar 2021.
- Jerome S . Rovner: VIBRATION IN HETEROPODA VENATORIA (SPARASSIDAE) : A THIRD METHOD OF SOUND PRODUCTION IN SPIDERS. In: Journal of Arachnology. Band 8, Nr. 1, 1980, S. 194–195., abgerufen am 7. Januar 2021.
- Jerome S . Rovner: VIBRATION IN HETEROPODA VENATORIA (SPARASSIDAE) : A THIRD METHOD OF SOUND PRODUCTION IN SPIDERS. In: Journal of Arachnology. Band 8, Nr. 1, 1980, S. 195., abgerufen am 7. Januar 2021.
- Jude A. Ewunken, Nelson N. Ntonifor, Mbua Christophe Parr: BIOECOLOGY OF Heteropoda venatoria (Linnaeus) (Araneae: Sparassidae) AND ITS IMPLICATIONS IN A TROPICAL BANANA AGROECOSYSTEM. In: Journal of Global Agriculture and Ecology. Band 5, Nr. 2, 2016, ISSN 2454-4205, S. 168., abgerufen am 24. September 2020.
- John Ross, David B. Richman: The life cycle of Heteropoda venatoria (Linnaeus) (Araneae: Heteropodidae). In: Psyche A Journal of Entomology. Band 89, Nr. 3-4, Januar 1982, S. 300, doi:10.1155/1982/26072., abgerufen am 6. Januar 2021.
- John Ross, David B. Richman: The life cycle of Heteropoda venatoria (Linnaeus) (Araneae: Heteropodidae). In: Psyche A Journal of Entomology. Band 89, Nr. 3-4, Januar 1982, S. 301, doi:10.1155/1982/26072., abgerufen am 6. Januar 2021.
- Yazhou Huang, Xinzhou Wu, Peng Zhang, Zhigui Duan, Xi Zhou: Peptide-rich venom from the spider Heteropoda venatoria potently inhibits insect voltage-gated sodium channels. In: Toxicon. Band 125, Januar 2017, S. 44, doi:10.1016/j.toxicon.2016.11.252.
- M. C. Sanguinetti, J. H. Johnson, L. G. Hammerland, P. R. Kelbaugh, R. A. Volkmann: Heteropodatoxins: peptides isolated from spider venom that block Kv4.2 potassium channels. In: Molecular Pharmacology. Band 51, Nr. 3, März 1997, ISSN 0026-895X, S. 493, PMID 9058605.
- C. Bernard, C. Legros, G. Ferrat, U. Bischoff, A. Marquardt: Solution structure of hpTX2, a toxin from Heteropoda venatoria spider that blocks Kv4.2 potassium channel. In: Protein Science : A Publication of the Protein Society. Band 9, Nr. 11, November 2000, ISSN 0961-8368, S. 2060, PMID 11152117, PMC 2144494 (freier Volltext).
- Renê de O. Beleboni, Andrea B. Pizzo, Andréia C.K. Fontana, Ruither de O.G. Carolino, Joaquim Coutinho-Netto: Spider and wasp neurotoxins: pharmacological and biochemical aspects. In: European Journal of Pharmacology. Band 493, Nr. 1-3, Juni 2004, S. 5, doi:10.1016/j.ejphar.2004.03.049.
- Yiying Ding, Kezhi Chen, Xuewen Zhang, Tiaoyi Xiao, Jinjun Chen: Molecular diversity and evolutionary trends of cysteine-rich peptides from the venom glands of Chinese spider Heteropoda venatoria. In Review, 24. April 2020, S. 1, doi:10.21203/rs.3.rs-24220/v1.
- Yazhou Huang, Xinzhou Wu, Peng Zhang, Zhigui Duan, Xi Zhou: Peptide-rich venom from the spider Heteropoda venatoria potently inhibits insect voltage-gated sodium channels. In: Toxicon. Band 125, Januar 2017, S. 47, doi:10.1016/j.toxicon.2016.11.252.
- Zhen Xiao, Yunxiao Zhang, Jiao Zeng, Songping Liang, Cheng Tang: Purification and Characterization of a Novel Insecticidal Toxin, μ-sparatoxin-Hv2, from the Venom of the Spider Heteropoda venatoria. In: Toxins. Band 10, Nr. 6, 7. Juni 2018, ISSN 2072-6651, doi:10.3390/toxins10060233, PMID 29880771, PMC 6024679 (freier Volltext).
- Yiying Ding, Kezhi Chen, Xuewen Zhang, Tiaoyi Xiao, Jinjun Chen: Molecular diversity and evolutionary trends of cysteine-rich peptides from the venom glands of Chinese spider Heteropoda venatoria. In Review, 24. April 2020, S. 5, doi:10.21203/rs.3.rs-24220/v1.
- Eugene Grishin: Polypeptide neurotoxins from spider venoms. In: European Journal of Biochemistry. Band 264, Nr. 2, September 1999, ISSN 0014-2956, S. 276–280, doi:10.1046/j.1432-1327.1999.00622.x.
- Yazhou Huang, Xinzhou Wu, Peng Zhang, Zhigui Duan, Xi Zhou: Peptide-rich venom from the spider Heteropoda venatoria potently inhibits insect voltage-gated sodium channels. In: Toxicon. Band 125, Januar 2017, S. 48, doi:10.1016/j.toxicon.2016.11.252.
- Zhen Xiao, Yunxiao Zhang, Jiao Zeng, Songping Liang, Cheng Tang: Purification and Characterization of a Novel Insecticidal Toxin, μ-sparatoxin-Hv2, from the Venom of the Spider Heteropoda venatoria. In: Toxins. Band 10, Nr. 6, 7. Juni 2018, ISSN 2072-6651, S. 1, doi:10.3390/toxins10060233, PMID 29880771, PMC 6024679 (freier Volltext).
- Zhen Xiao, Yunxiao Zhang, Jiao Zeng, Songping Liang, Cheng Tang: Purification and Characterization of a Novel Insecticidal Toxin, μ-sparatoxin-Hv2, from the Venom of the Spider Heteropoda venatoria. In: Toxins. Band 10, Nr. 6, 7. Juni 2018, ISSN 2072-6651, S. 5, doi:10.3390/toxins10060233, PMID 29880771, PMC 6024679 (freier Volltext).
- Yiying Ding, Kezhi Chen, Xuewen Zhang, Tiaoyi Xiao, Jinjun Chen: Molecular diversity and evolutionary trends of cysteine-rich peptides from the venom glands of Chinese spider Heteropoda venatoria. In Review, 24. April 2020, S. 11, doi:10.21203/rs.3.rs-24220/v1.
- Yiying Ding, Kezhi Chen, Xuewen Zhang, Tiaoyi Xiao, Jinjun Chen: Molecular diversity and evolutionary trends of cysteine-rich peptides from the venom glands of Chinese spider Heteropoda venatoria. In Review, 24. April 2020, S. 9, doi:10.21203/rs.3.rs-24220/v1.
- Heteropoda venatoria emarginata (Thorell, 1881) im WSC World Spider Catalog, abgerufen am 9. Januar 2021.
- Heteropoda venatoria foveolata (Thorell, 1881) im WSC World Spider Catalog, abgerufen am 9. Januar 2021.
- Peter Jäger: Heteropoda Latreille 1804: new species, synonymies, transfers and records (Araneae: Sparassidae: Heteropodinae). In: Arthropoda Selecta. Band 23, Nr. 2, 2014, S. 152., abgerufen am 8. Januar 2020.
- Jude A. Ewunken, Nelson N. Ntonifor, Mbua Christophe Parr: BIOECOLOGY OF Heteropoda venatoria (Linnaeus) (Araneae: Sparassidae) AND ITS IMPLICATIONS IN A TROPICAL BANANA AGROECOSYSTEM. In: Journal of Global Agriculture and Ecology. Band 5, Nr. 2, 2016, ISSN 2454-4205, S. 165., abgerufen am 6. Januar 2021.
- Yde Jongema: List of edible insects of the world (Englisch). Universität Wageningen, 1. April 2017, abgerufen am 13. Februar 2021.
- Beschreibung und Haltungsbericht der Warmhaus-Riesenkrabbenspinne auf der Website von "Naturaufnahmen-witt", abgerufen am 20. Januar 2020.
- Focus Online: Hochgiftige Spinne in bayerischem Supermarkt? Verdacht bestätigt sich nicht, abgerufen am 25. September 2020.
- Heteropoda venatoria (Linnaeus, 1767) bei Global Biodiversity Information Facility, abgerufen am 19. Januar 2020.
- Heteropoda venatoria (Linnaeus, 1767) beim Rote-Liste-Zentrum, abgerufen am 7. Januar 2021.
Literatur
- Christian Lorenz: The spider Heteropoda venatoria and its visual system. 2012, S. 1–60, doi:10.25365/thesis.21679.
- Peter Jäger: Heteropoda Latreille 1804: new species, synonymies, transfers and records (Araneae: Sparassidae: Heteropodinae). In: Arthropoda Selecta. Band 23, Nr. 2, 2014, S. 145–188.
- Yazhou Huang, Xinzhou Wu, Peng Zhang, Zhigui Duan, Xi Zhou: Peptide-rich venom from the spider Heteropoda venatoria potently inhibits insect voltage-gated sodium channels. In: Toxicon. Band 125, Januar 2017, S. 44–49, doi:10.1016/j.toxicon.2016.11.252.
- C. Bernard, C. Legros, G. Ferrat, U. Bischoff, A. Marquardt: Solution structure of hpTX2, a toxin from Heteropoda venatoria spider that blocks Kv4.2 potassium channel. In: Protein Science : A Publication of the Protein Society. Band 9, Nr. 11, November 2000, ISSN 0961-8368, S. 2059–2067, PMID 11152117, PMC 2144494 (freier Volltext).
- Peter Jäger: Selten nachgewiesene Spinnenarten aus Deutschland (Arachnidae: Araneae). In: Arachnologische Mitteilungen. Band 19, Nr. 1, Juni 2000, S. 49–57.
- Shichang Zhang, Hong-Lin Chen, Kuan-Yu Chen, Jian-Jun Huang, Chia-Chen Chang, Dakota Piorkowski, Chen-Pan Liao, I-Min Tso: A nocturnal cursorial predator attracts flying prey with a visual lure. In: Animal Behaviour. Band 102, Nr. 1, 2015, S. 119–125, doi:10.1016/j.anbehav.2014.12.028.
- Dr. Rita Bhandari, Sachin R. Patil: NOTE ON REPRODUCTIVE BEHAVIOUR OF THE GIANT CRAB SPIDER, HETEROPODA VENATORIA (LINNAEUS, 1767). In: RESEARCH FIELD: ZOOLOGY. Band 6, Nr. 1, ISSN 0974-5297, S. 119–122.
- Jude A. Ewunken, Nelson N. Ntonifor, Mbua Christophe Parr: BIOECOLOGY OF Heteropoda venatoria (Linnaeus) (Araneae: Sparassidae) AND ITS IMPLICATIONS IN A TROPICAL BANANA AGROECOSYSTEM. In: Journal of Global Agriculture and Ecology. Band 5, Nr. 2, 2016, ISSN 2454-4205, S. 164–175.
- Mansur Ahmed, Jinnat Anam, Prasanta Kumar Saikia, Pratisha Kumari Saikia: Role of Heteropoda venotoria in Household pest Control : A comparative study. In: Asian Journal of Biological and Life Sciences. Band 3, Nr. 1, 30. April 2014, S. 20–23.
- Amit Kumer Neogi: Predation of Common House Gecko Hemidactylus frenatus Schlegel, 1836 by Giant Crab Spider Heteropoda venatoria Linnaeus, 1767. In: Bugs R ALL. Band 23, Nr. 1, 21. August 2017, ISSN 2230-7052, S. 22–24.
- John Ross, David B. Richman: The life cycle of Heteropoda venatoria (Linnaeus) (Araneae: Heteropodidae). In: Psyche A Journal of Entomology. Band 89, Nr. 3-4, Januar 1982, S. 297–305, doi:10.1155/1982/26072.
- Jerome S . Rovner: VIBRATION IN HETEROPODA VENATORIA (SPARASSIDAE) : A THIRD METHOD OF SOUND PRODUCTION IN SPIDERS. In: Journal of Arachnology. Band 8, Nr. 1, 1980, S. 197.
- Shichang Zhang, Ho-Yin Yip, Ming-Yu Lee, Li Liu, Dakota Piorkowski, Chen-Pan Liao, I-Min Tso: Vision-mediated courtship in a nocturnal arthropod. In: Animal Behaviour. Band 142, Nr. 1, Juni 2018, S. 185–190, doi:10.1016/j.anbehav.2018.06.016.
- Zhen Xiao, Yunxiao Zhang, Jiao Zeng, Songping Liang, Cheng Tang: Purification and Characterization of a Novel Insecticidal Toxin, μ-sparatoxin-Hv2, from the Venom of the Spider Heteropoda venatoria. In: Toxins. Band 10, Nr. 6, 7. Juni 2018, ISSN 2072-6651, S. 233, doi:10.3390/toxins10060233, PMID 29880771, PMC 6024679 (freier Volltext).
- Renê de O. Beleboni, Andrea B. Pizzo, Andréia C.K. Fontana, Ruither de O.G. Carolino, Joaquim Coutinho-Netto: Spider and wasp neurotoxins: pharmacological and biochemical aspects. In: European Journal of Pharmacology. Band 493, Nr. 1-3, Juni 2004, S. 1–17, doi:10.1016/j.ejphar.2004.03.049.
- M. C. Sanguinetti, J. H. Johnson, L. G. Hammerland, P. R. Kelbaugh, R. A. Volkmann: Heteropodatoxins: peptides isolated from spider venom that block Kv4.2 potassium channels. In: Molecular Pharmacology. Band 51, Nr. 3, März 1997, ISSN 0026-895X, S. 491–498, PMID 9058605.
- Eugene Grishin: Polypeptide neurotoxins from spider venoms. In: European Journal of Biochemistry. Band 264, Nr. 2, September 1999, ISSN 0014-2956, S. 276–280, doi:10.1046/j.1432-1327.1999.00622.x.
Weblinks
- Heteropoda venatoria im World Spider Catalog
- Heteropoda venatoria (Linnaeus, 1767) bei araneae - Spiders of Europe
- Heteropoda venatoria (Linnaeus, 1767) bei Global Biodiversity Information Facility
- Heteropoda venatoria (Linnaeus, 1767) bei Fauna Europaea
- Heteropoda venatoria (Linnaeus, 1767) beim Rote-Liste-Zentrum
- Heteropoda venatoria (Linnaeus, 1767) beim Wiki der Arachnologischen Gesellschaft e. V.
- University of Florida: Huntsman Spider, Heteropoda venatoria (Linnaeus) (Arachnida: Araneae: Sparassidae). von Glavis Bernard Edwards Jr.






