Seidensekretion
Seidensekretion umfasst die Produktion von Seidekomponenten und deren Sekretion durch ein Tier. Bekannt sind die Seide-Produktion der Seidenraupen. Entsprechendes feinfaseriges Material kann von den meisten Larven der Insekten, von einigen Spinnentieren und von manchen Muscheln durch Spinndrüsen oder durch ein Epithel ausgeschieden werden. Seide ist je nach Aushärtungsgrad eine biologische Kittsubstanz oder eine zähelastische Faser. Sie besteht zu einem großen Anteil aus biopolymeren Strukturproteinen. Perlmutt der Muschelschalen enthält ebenfalls Seidenbestandteile.



_nest_in_Kinnarsani_WS%252C_AP_W_IMG_6012.jpg.webp)




Homologe und analoge Entwicklungen
Die ersten Anlagen zur Seidenproduktion sind bei den gemeinsamen Vorfahren von Weichtieren und Gliedertieren zu suchen. Im Verlauf der weiteren Evolution resultierte daraus eine Heterogenität von Lösungen, die noch nicht vollständig aufgeklärt ist.[1]
Während die wesentliche Seidenkomponente, das Seidenprotein mit mehreren polaren Wiederholungssequenzen und in β-Faltblatt-Konformation,[1] vermutlich homolog ist, haben sich die Seide-produzierenden Gewebe aus ursprünglichen ektodermalen Anlagen mehrmals parallel entwickelt.[2] Dies gilt ebenfalls für die Klasse der Insekten.[1][2]
Auf Basis der verschiedenen anatomischen Gegebenheiten, des molekularen Aufbaus der Seidenkomponenten und der Verwandtschaftsbeziehungen der Insektengruppen wurden 23 unterschiedliche Wege für die Evolution der Seidenproduktion bei Insekten bestimmt.[1]
Seideproduzierende Tiere
Einige Tierbezeichnungen verweisen mit Namenselementen wie Netz, Seide, spinnen oder weben direkt auf die Verwendung endogen erzeugter Fäden:
- Netzspinnen
- Radnetzspinne
- Spinner (mehrere Schmetterlingsfamilien)
- Spinnen
- Spinnmilben
- Seidenspinnen
- Seidenspinner
- Weberameisen
- Webspinnen
Aber: Weberknechte haben keine Seiden- oder Spinndrüsen, sondern Stinkdrüsen. Webervögel produzieren ebenfalls keine Fäden, sondern verflechten gefundenes Nistmaterial kunstvoll.
Zwei rezente Tiergruppen können entweder Seide oder Seidenkomponenten produzieren, oder sie besitzen den Seidendrüsen homologe Organteile: Mitglieder der Weichtiere (Tierstamm Mollusca) und der Gliederfüßer (Tierstamm Arthropoda).
Weichtiere
Viele Schalenweichtiere (Unterstamm Conchifera) einschließlich einiger Kopffüßer (wie Perlboote) bilden Schalen, deren innerste Schicht (das Hypostracum) im Wesentlichen aus Perlmutt besteht, welches Seidenproteine enthält.[3][4]
Muscheln (Klasse Bivalvia, beispielsweise Miesmuscheln) produzieren Muschelseide (Byssus), um sich anzuheften, oft nur im Juvenilstadium. Byssus ist der Seide der Insekten im Aufbau homolog; es enthält die Seidenproteine Fibroin und Sericin.
Gliederfüßer
Die meisten Klassen der Gliederfüßer haben zahlreiche Mitglieder, die zur Produktion von Seide bzw. der Seideproteine Fibroin und Sericin zumindest in bestimmten Altersformen befähigt sind. Von einigen ist die Expression von Seidenproteinen nicht bekannt, oft aber können bei ihnen Organstrukturen erkannt werden, die Seidendrüsen homolog sind:
| Gliederfüßer (Arthropoda) |
| |||||||||||||||
Tausendfüßer
In der Klasse der Tausendfüßer (Myriapoda) produzieren viele Arten seidenähnliche Sekrete, die außerhalb des Körpers aushärten, z. B. Doppelfüßer.[5]
Krebstiere
Eine Produktion von Seidenkomponenten durch Krebstiere (Crustacea) ist kaum bekannt.
Manche Flohkrebse (Amphipoda), z. B. Crassicorophium bonellii tragen Seidendrüsen an ihren Füßen.[6]

Die meisten sessilen Rankenfußkrebse bilden eine Art Zement, um sich anzuheften. Diese Absonderung ist Seidensekreten homolog.[7]
Insekten
Viele Insektenlarven können Seide produzieren, meist um sich während der Verpuppung in einem Kokon zu schützen.
Von Pollenwespen wurde bekannt, dass eine oder mehrere Arten im Gegensatz zu allen anderen untersuchten Insekten als Adulttiere Seide in ihren Munddrüsen produzieren und damit Nester in trockenem Sand bauen können.[8][9]
Kieferklauenträger
Unter den Spinnentieren können nur Mitglieder der Ordnungen der Webspinnen, Spinnmilben und Pseudoskorpione Seide produzieren und daraus Seidenfäden bilden, häufig um daraus Wohnbauten oder Fanggeräte zu bilden. Von anderen Ordnungen der Spinnentiere (z. B. Weberknechte) sind keine Seidensekrete bekannt.[10] Von neun Familien der Spinnmilben (Prostigmata, Acariformes) ist bekannt, dass sie Seide produzieren können, z. B. Tetranychus.[10]
Von Pfeilschwanzkrebsen (Limulidae) sind keine Seidenprodukte bekannt. Jedoch bestehen anatomische Homologien ihrer opisthosomalen Segmente 4 und 5 mit den Spinndrüsen der Spinnentiere.[11]
Anatomische Strukturen zur Seidensekretion
Die Seide-produzierenden Gewebe haben sich aus ursprünglichen ektodermalen Anlagen mehrmals parallel entwickelt.[2]
Die beiden ältesten Fossilfunde von Spinndrüsen stammen aus dem mittleren Devon und sind 386 bzw. 374 Millionen Jahre alt. Sie sind der früheste Beleg für seidenproduzierende Tiere. Diese Spinndrüsen werden der Webspinne Attercopus fimbriunguis zugerechnet.[11]
Nicht alle Organe aller Seide produzierender Tiere sind näher untersucht. Daher werden nur einige gut bekannte anatomische Strukturen exemplarisch dargestellt:
Bei Schalenweichtieren
Schalenweichtiere verschiedener Ordnungen sezernieren die Seidenbestandteile des Perlmutts durch ihr Epithel.[3][12]
Bei Byssus produzierenden Muscheln sitzen Seidendrüsen in deren Fuß.[13]
Bei Flohkrebsen
Marine Flohkrebse (Crassicorophium bonellii) tragen Seidendrüsen an ihren Füßen, die fädige Sekrete abgeben.[6]
Bei Insekten
Die bekannten Spinndrüsen der meisten Insekten(larven) enthalten in der Ultrastruktur ähnliche Zellen[2] und bestehen aus einem meist vielfach gewundenen Schlauch zur Produktion der Seidenkomponenten, dessen hinteres Ende durch eine Spinnwarze oder -düse die flüssig-klebrige Seide absondert. Der Faden erhärtet rasch nach Austritt, auch bei wasserlebenden Formen.
Die Seide-produzierenden Gewebe der Insekten entwickelten sich aus homologen ektodermalen Anlagen mehrmals parallel. Sie gingen aus mindestens vier unterschiedlichen Ausgangsgeweben im Laufe der Phylogenese hervor:[2][1]
- Epidermale Zellen in Verbindung mit dem Borstenorgan
- Akzessorische Drüsen der Geschlechtsorgane
- Malpighische Gefäße der Larven
- Labialdrüsen der Larven von Amphiesmenoptera (d. h. Schmetterlinge und Köcherfliegen)
Bei den Raupen der Schmetterlinge[14][15] und den Larven der Köcherfliegen[16] kann die Labialdrüse zu Spinndrüsen umgewandelt sein, mit denen sie Seidenfäden spinnen können.[2] Die Seidenspinnerraupe ordnet den Seidenfaden um sich herum an, indem sie mit rhythmischen Kopfbewegungen gegenwirkt.
Auch die Larven mancher Hautflügler produzieren Seide mit ihren Labialdrüsen. Ob diese jedoch homolog den Amphiesmenoptera oder parallel entstanden sind, ist ungeklärt.
Opisthosomaldrüsen der Webspinnen

Die gemeinsamen Vorfahren der Webspinnen besaßen 4 Seidendrüsenpaare an ihren 4. und 5. opisthosomalen Segmenten.[11] Während bei rezenten Spinnen solche opisthosomalen Anhänge fehlen, sind homologe Strukturen bei Pfeilschwanzkrebsen (Limulus) vorhanden.[11]
Bei den seideproduzierenden Webspinnen befinden sich 4 bis 6 Seidendrüsen oder Spinndrüsen (je 2 oder 3 Paare) auf der abdominalen Unterseite im vierten und fünften Hinterleibssegment. Sie können unterschiedliche Seidentypen für unterschiedliche Aufgaben (Leimfäden, Kokon, Fesselfäden) bereitstellen. Diese Drüsen sind äußerlich als verdickte Spinnwarzen erkennbar. Die Spinnwarzen sind auf dem gut beweglichen Hinterleib äußerst beweglich, wobei die Muskulatur Beugung und der Hämolymphdruck Streckung bewirkt. Die Spinnwarzen können auch gespreizt werden, um „Seidenkleckse“ als Verankerungspunkte für den Faden zu bilden.
Viele Webspinnen können ihren Spinndrüsen beim Austritt des Seidenfadens unterschiedlich gestaltete Spinnspulen vorlagern. Dies sind winzigen Öffnungen, welche aus feinen Röhrchen bestehen (bei manchen cribellaten Spinnen nur 10 nm Durchmesser). Eine Spinnwarze kann mit mehreren verschiedenen Spinnspulen besetzt sein für die Produktion unterschiedlich dicker Fäden für verschiedene Anforderungen (z. B. für Abseilfäden, Klebefäden, Alarmfäden, Kokons).
Die Spinnplatte einiger Fangwollweber (eine plattenartig umgewandelte Spinnwarze, Cribellum genannt) kann bis zu 50.000 Spinnspulen tragen. Am Metatarsus (letztes Beinglied) des vierten Beinpaares sitzt bei vielen cribellaten Spinnen ein kammähnliches Calamistrum, mit dem ihre sehr feine Seidenwolle gekämmt werden kann. Diese anatomischen Strukturen (Cribellum und Calamistrum) kommen nur bei cribellaten Spinnen vor.
Ecribellate Spinnen besitzen neben ihren Spinndrüsen leimproduzierende Drüsen, mit denen Fäden eingeleimt werden, die dann als besonders klebrige Fangfäden dienen.
Haftsekret an Füßen von Vogelspinnen
Zu Vogelspinnen der Gattung Aphonopelma wurden zusätzliche Spinndrüsen an deren Tarsen berichtet, welche die Haftung verbesserten.[17][18][19][20] Dem steht jedoch entgegen, dass diese Beobachtung falsch sei und die vermeintlichen Spinnspulen tatsächlich Chemosensoren seien.[21][22][23] Die Veröffentlichungen sind kontrovers.[24][25]
Spinnapparat der Pseudoskorpione
Pseudoskorpione besitzen Spinndrüsen in ihren Cheliceren (Mundwerkzeuge).
Physiologie der Seidensekretion
Bereitstellung der löslichen Komponenten
In den Seidendrüsen werden die Bestandteile der Seide in einer wässrigen Salzlösung bereitgestellt. Die Seidenbestandteile liegen solange als wässrige Lösung in der Drüse vor, bis das Sekret ausgepresst wird.
Damit die für die festen Quervernetzungen verantwortlichen Bereiche der Seidenproteine nicht bereits in den Seidendrüsen verklumpen, werden sie zunächst als Präkursor synthetisiert, welche in der wässrigen Form gehalten werden können. "Regulationsbereiche" am C-terminalen Ende des Eiweißmoleküls überdecken diejenigen Bereiche, welche miteinander in Kontakt treten könnten, um dann Quervernetzungen zu bilden. Polare Bereiche des Moleküls sind nach außen gewandt, lipophile Bereiche nach innen. So wird eine gute Löslichkeit im wässrigen Milieu gewährleistet.
Auspressen und Verfestigung
Bei Auspressen durch die Spinndrüsenöffnungen wird Salz zurückgehalten und die Seidenproteine als dünner klebrig-flüssiger Faden sezerniert. Infolge der Reduzierung der Salzkonzentration können sich die Seidenproteine aneinanderlagern und Quervernetzungen aufbauen, aus diesen Molekülverbänden entstehen feste Seidenfibrillen. Je nach Funktion können verbleibende Salze den Faden länger klebrig lassen oder bei sehr niedrigen Salzrückständen eine rasche Aushärtung erfolgen. Die Austrittsöffnung (Spinnspule) bestimmt die Fadendicke.
Beim Austreten der Proteine aus der Seidendrüse finden sie eine erheblich verminderte Salzkonzentration und veränderte -zusammensetzung vor. Die beiden Ionenbindungen der Regulatorbereiche werden instabil, die Moleküle verändern ihre Faltung und die molekularen Kontaktbereiche werden entblößt. Durch die Strömung im engen Spinnkanal treten außerdem starke Scherkräfte auf, wodurch sich die Moleküle einander nähern. Die langen Eiweißketten werden anhand ihrer polaren Cluster parallel zueinander ausgerichtet. Nun liegen die für die Quervernetzung verantwortlichen Bereiche direkt nebeneinander, ein stabiler Seidenfaden entsteht.[26] Die produzierten Fäden sind durch die spezielle molekulare Anordnung der beteiligten Aminosäuren sehr zugfest und gleichzeitig hochelastisch.
Molekularer Aufbau der Seide
Insekten- und Spinnenseide
Die Hauptbestandteile der Seide von Seidenspinnern sind die beiden Strukturproteine Fibroin und Sericin,[27] die in der Seide des Seidenspinners im Verhältnis 7:3 auftreten, ohne größere Massenanteile weiterer Komponenten.[28] Die besonders stabilen Eigenschaften der Seide erklären sich vor allem aus dem molekularen Aufbau des Seidenproteins Fibroin, welches den Hauptanteil der Seide ausmacht. Es ist ein langkettiges Faserprotein (ein β-Keratin). Sericin bildet eine Matrix, in der sich die langen Fibroinmoleküle noch kurz nach dem Auspressen bewegen und aneinander lagern können. Bei Spinnen existieren die verwandten Proteine Spidroin 1 und Spidroin 2.
Forschungsstand
Insekten- und Spinnenseide nur einiger Organismen wurden bisher untersucht und nur wenige Bestandteile molekular charakterisiert. Manche Vorgänge können auch nur für einen einzigen Organismus beschrieben sein. Die spärlichen Erkenntnisse müssen daher meist stellvertretend für die noch nicht näher analysierte Seidenproduktion anderer Organismen stehen.
| Seidenkomponente | Organismus | Veröffentlichung |
|---|---|---|
| Fibroin | Seidenspinner (Bombyx mori) | zahlreiche Untersuchungen |
| Sericin | Seidenspinner | [29] |
| FLAG-Protein | Seidenspinnen (Nephila) | [30] |
| sp160-Protein | Zuckmücken | [31] |
| sp185-Protein | Zuckmücken | [32] |
| sp220-Protein | Zuckmücken | [33] |
Die Anordnung der molekularen Komponenten der Spinnenseide wird auch mittels Röntgenstrukturanalysen untersucht. Sie zeigen, dass Spinnenseide aus geordneten (kristallinen) und ungeordneten (amorphen) Bereichen besteht. Die Kristallite rufen die Streubeiträge (Bragg-Peaks) auf dem Detektor hervor. Ungeordnete Bereiche sind als ringförmiger Streuuntergrund zu sehen (amorphe Halo). Die Auswertung eines solchen Röntgenstreubildes ermöglicht es – unter anderem mit Hilfe der Millerschen Indizes – Form, Ausdehnung und Orientierung der Kristallite zu bestimmen.
Struktur des Fibroins
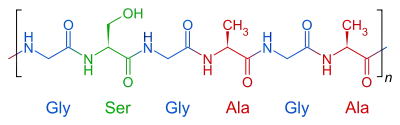
Die Struktur des Seidenproteins Fibroin ergibt sich aus der mehrfachen Faltung und Ausrichtung in vier Strukturebenen.
- Die Primärstruktur des Fibroins sind mehrere polare Wiederholungssequenzen. Die vorherrschend sich wiederholende Sequenz der Aminosäuren im Fibroin der Insekten ist Gly-Ser-Gly-Ala-Gly-Ala. Die Aminosäuresequenz des Spinnen-Fibroins wurde beschrieben mit Polyalanin-Clustern von 8 bis 10 Alaninresten neben glycinreichen Clustern von 24–35 Aminosäureresten.[34]
- Fibroin ist ein β-Keratin. Die im Seidenfaden vorherrschende Sekundärstruktur ist das antiparallele β-Faltblatt.[1][27] Diese Faltblatt-Stapel aus mehreren Clustern bilden kristalline Molekülbereiche.
- Die Tertiärstruktur des Fibroins besteht aus zwei identischen Untereinheiten, welche sich parallel aneinander lagern, aber gegengerichtet. Diese Anordnung wird durch Wasserstoffbrückenbindungen und hydrophobe Wechselwirkungen zwischen den Untereinheiten stabilisiert.
- In der Quartärstruktur werden kristalline Bereiche parallel aneinander ausgerichteter Fibroinmoleküle durch intermolekulare Wasserstoffbrückenbindungen in ihrer Lage zueinander stabilisiert. Hydrophobe Wechselwirkungen zwischen den Faserproteinen tragen weiter zur Stabilisierung des Seidenfadens bei.[35]
Fibroin des Seidenspinners kann in mindestens drei Konformationen vorkommen, woraus unterschiedliche Qualitäten des Seidenfadens resultieren: Seide I, II und III. Seide I ist der natürliche Zustand des Fadens, Seide II findet sich im gespulten Seidenfaden.[36] Seide III bildet sich in wässrigem Zustand an Grenzflächen.
Glanz
Die Fibroin-Moleküle ordnen sich bei Austritt aus der Seidendrüse im Seidenfaden parallel (paarige β-Faltblätter) an. Zwischen dafür vorgesehenen Bereichen bilden sich feste Quervernetzungen aus. Der Glanz der Seide beruht auf Reflexion des Lichtes an diesen mehrfachen molekularen Parallelschichtungen. Diese optisch aktive Struktur wird aber nicht für den irisierenden Glanz des Perlmutt verantwortlich gemacht, sondern dessen schichtweiser Feinaufbau.
Additive
In der Insektenseide sind neben Faserproteinen auch lösliche (löslich in Propylenglycol oder Glycerin) Skleroproteine sowie weitere Anteile enthalten:
Spinnenseide enthält zur Gestaltung von Behausungen häufig antimikrobiell wirksame Komponenten. Oft sind der Seide Pheromone beigemischt, was eine Art- oder Geschlechtererkennung erlaubt. Fangfäden sind oft mit klebenden Zusatzstoffen oder Leimtröpfchen bestückt. Der Feuchthaltung von Seide oder Klebsubstanzen dienen Salze, welche Luftfeuchtigkeit adsorbieren.
Muschelseide
Byssus ist aufgrund seines Ursprungs in bivalven Mollusken anders aufgebaut als Seiden aus Arthropoden. Byssus enthält mindestens neun charakterisierbare Proteine.[37][38]
Seide der Flohkrebse
Die seidigen Fäden der Flohfußkrebse bestehen aus Mucopolysacchariden und Proteinen. Diese besitzen einen hohen Grad an β-Faltblatt Sekundärstrukturen mit einem deutlichen Gehalt an polaren Aminosäuren.[6]
Zement der Rankenfußkrebse
Die Seidenbestandteile des Zementes der Rankenfußkrebse (z. B. Megabalanus rosa) enthalten unlösliche Proteine, reich an polaren Aminosäuren. Daraus wurde das fibroinähnliche Protein Mrcp-20k (M. rosa cement protein mit einer molaren Masse von 20 kDa) charakterisiert, welches aus sechs Wiederholungsclustern von je etwa 30 Aminosäuren aufgebaut ist. Das codierende Gen enthält 902 Basenpaare, das Präkursor-Protein besteht aus 202 Aminosäuren (20.357 Da), einschließlich einer cysteinreichen Signalsequenz von 19 Aminosäuren. Das funktionale Zementprotein enthält jedoch kein Cystein und keine Disulfidbindungen.[7]
Funktionen der Seidensekretion
Seide ist ein hoch zähelastisches Material mit sehr geringem Eigengewicht. Sie ist viermal belastbarer als Stahl und kann in der Länge um das Dreifache gedehnt werden, ohne zu reißen.
Bei Weichtieren
Muscheln nutzen das Seidensekret (Byssus genannt), um sich auf festem Untergrund durch Haftfäden anzuheften, insbesondere in der Brandungszone. Feigenmuscheln spinnen Netze aus Byssusfäden und können damit feste Gegenstände fixieren.
Eikokon
Spinnen und viele andere Gliedertiere umhüllen mit feiner Seide ihre Eier zur Bildung eines Eikokons. Meist dient eine festere Seide als Außenschutz. Weibliche Wolfsspinnen führen ihren Eikokon bei der Jagd mit.
Abseilen
Schmetterlingsraupen vieler Spanner und die meisten Webspinnen können sich an ihrem Seidenfaden abseilen. Beim Klettern ziehen viele Webspinnen einen Faden hinter sich her, der beim Absturz zum Abseilen genutzt wird. Zum Häuten verwenden die meisten Webspinnen ebenfalls einen Spinnfaden zum Abseilen aus der alten Haut (siehe auch: Webspinnen#Wachstum und Häutung).
Flugfaden
Spinnen (Araneae), Spinnmilben (Tetranychidae) und die Larven vieler Nachtfalter (Lepidoptera) produzieren einen Flugfaden (englisch ballooning), an dem sich z. B. die jungen Spinnen im Spätsommer (Altweibersommer) im Wind forttragen lassen (Luftplankton).[39] Charles Darwin berichtete 1832 in seinem Tagebuch, 100 km vor der Küste Südamerikas hätten sich unzählige kleine Spinnen in der Takelage seines Forschungsschiffes verfangen.
Bei Insektenlarven
Viele Insekten produzieren als Larven Seide, um daraus einen Kokon als Schutzhülle für ihre Verpuppung zu bilden. Der Kokon des Seidenspinners besteht aus einem einzigen bis zu 900 m langen Faden.

Schaben und Fangschrecken (zusammen gelegentlich als Oothecaria bezeichnet) legen ihre Eipakete in fest aushärtenden Kokons (Ootheken) ab, in denen die Eier untrennbar miteinander verklebt sind. Ootheken sind ziemlich widerstandsfähig gegen Fressfeinde und gegen mechanische oder chemische Einwirkungen.
Daneben kommen weitere Funktionen der Seidensekretion vor:
- Schmetterlingsraupen vieler Zahnspinner und Pflanzenwespenlarven, z. B. Gespinstblattwespen, bilden gemeinsam ein Gespinst aus Seidenfäden, um sich vor Beutegreifern (z. B. Singvögeln) zu schützen. Einige Arten aus diesen Gruppen bauen kunstvolle Schutznester aus Seide, die als Schlupfwinkel für Ruheperioden dienen (z. B. Prozessionsspinner).
- Wasserlebende Larven der Köcherfliegen kleben mit ihrem Seidensekret artspezifisch Substratpartikel (Sand, Steinchen oder Pflanzenmaterial) zu einem Köcher zusammen, der als transportable Körperhülle dient, welche sie auch zur Verpuppung nutzen. Andere Köcherfliegen bauen Driftnetze oder Fangnetze ähnlich Spinnennetzen quer zur Wasserströmung, um Nahrungspartikel aufzufangen. Andere spinnen Sicherheitsfäden, um zu verhindern, selbst abgedriftet zu werden.
- Weberameisen nutzen das Sekret ihrer Larven, um Blätter durch Nähte zu einem Nest verbinden.

Spermatophore
Wie viele andere Gliedertiere verwenden Spinnenmännchen oft größere Samenpakete (Spermatophoren) zur Übertragung an das Weibchen, da ihnen ein Penis fehlt. Zur Umhüllung der Spermatophoren dient meist Spinnenseide.
Viele Webspinnenmännchen produzieren in Seide gebündelte Spermapakete.
Klebende Fanggeräte
Viele Webspinnen können Ihre Beute mit klebender Seide fesseln.
Viele Webspinnen produzieren außerdem Fanggeräte aus Spinnenseide.
Radnetze sind aus verschiedenen Fadentypen unterschiedlicher Stärke und Klebkraft zusammengesetzt. Stabile nichtklebende Fäden bilden das Netzgrundgerüst und werden beim Bau zuerst angelegt. Eine nichtklebende Hilfsspirale gibt die Struktur vor. Darauf wird die eng gezogene Fangspirale aus Klebefäden angebracht.
Zitterspinnen und Kugelspinnen bauen unregelmäßige Raumnetze, aus welchen mit Leimtröpfchen besetzte Fangfäden hängen.
Ecribellate Spinnen verwenden leimbesetzte Fangfäden.


Nichtklebende Fanggeräte
Trichterspinnen lauern in einem mit Seide ausgekleideten Bodentrichter auf Beute.
Falltürspinnen und Gliederspinnen lauern in ihrer Wohnröhre auf Berührungssignale ihrer Alarm- und Stolperfäden.
Tapezierspinnen bauen einen meist gut getarnten Fangschlauch und lauern in ihrer Wohnröhre.
Die feine Fangwolle der cribellaten Spinnen besitzt keine Klebkraft, wird aber zur Erzeugung sehr wirkungsvoller Fallen genutzt: Die Grundkonstruktion besteht aus starken Achsfäden, auf die die äußerst feine Fangwolle aufgebürstet wird, in welche sich Beutetiere heillos verstricken.
Wurfnetzspinnen benutzen Wurfnetze. Manche Spinnen (z. B. Dinopsis) besitzen nur winzige Netze zum Einfangen ihrer Beute wie mit einem Kescher.
Wohnbaue
Viele Webspinnen kleiden ihre Wohnhöhlen mit ihrer Seide aus oder bauen damit freie Wohngespinste.

Wasserbewohnende Wasserspinnen halten mit ihren Unterwassergespinsten einen Luftvorrat, welchen sie zuvor portionsweise in ihren Körperborsten dorthin transportierten. Verbrauchter Sauerstoff der Luftblase regeneriert sich aus dem Wasser, denn die Luftblase fungiert als "physikalische Kieme" oder Plastron.[40] Umgekehrt gibt das Plastron Kohlendioxid an das Wasser ab.
Seide zur Kommunikation
Bei einigen Radnetzspinnen dürfen sich paarungswillige Männchen erst nähern, nachdem sie über Zupfsignale eine spezifische Vibration ausgelöst haben. Springspinnen und Lycosoidea nutzen Seide und deren Vibrationen ebenfalls für Balz und Kommunikation.
Bei Pseudoskorpionen
Pseudoskorpione legen 5 bis 7 mm große Gespinstnester für Ruhephasen und zur Überwinterung an. Für die Eiablage legen weibliche Pseudoskorpione Gespinste oder spezielle mehrkammrige Brutkammern an.[10]
Bei Spinnmilben
Spinnmilben benutzen ein Gespinst, um sich darin auf der Unterseite von Pflanzen zu behausen, z. B. Tetranychus, oder um sich vom Wind treiben zu lassen. Cunixidae und Bdellidae produzieren Gespinste zur Eiablage und bilden Fangnetze aus Seide, manchmal auch für ihre Spermatophoren oder für Markierungen bei der innerartlichen Kommunikation.[10]
Nutzung durch den Menschen
Menschen verwenden oder verwendeten Seide von Maulbeerspinner, Tussa, Webspinnen (z. B. der Kreuzspinnen) oder der im Mittelmeer lebenden Edlen Steckmuschel (Pinna nobilis L.), um daraus Seidengarne durch Spinnen zu gewinnen, zur Herstellung von Textilgeweben, Seilen oder schusshemmender Kleidung.
Die Haltung der Seidenraupen und Gewinnung der Rohseide wird als Serikultur bezeichnet und soll seit 4800 Jahren betrieben werden. Sie produziert etwa 95 % aller Naturseiden.

Gewebe aus Muschelseide oder Steckmuschelwolle werden als Byssus bezeichnet, jedoch wird die Bezeichnung auch für Leinengewebe[41] und Byssos für Baumwollgewebe[42] verwendet. Byssos-Gewebe ist feiner als Seide, wegen seiner Haltbarkeit und der aufwändigen Gewinnung war es sehr wertvoll und vor allem im Mittelalter unter hohen Würdenträgern sehr begehrt.
Fossile Belege
Fossilfunde von Seidenprodukten sind selten. Fossilierungsexperimente mit Seide zeigten jedoch, dass Tuffbildung durch Seide von Wasserinsektenlarven möglich ist, insbesondere im Winter durch Köcherfliegen, im Sommer durch Kriebelmücken.[43]
In Bernstein wurden vereinzelt Seidenfäden, auch mit anhaftenden Leimtröpfchen bzw. eingeschlossener Beute, aus Spinnnetzen der frühen Kreidezeit (etwa 130,[44] 110[45] und 40 Millionen Jahre alt) gefunden.
Einzelnachweise
- Tara D. Sutherland, et al.: Insect silk: one name, many materials. In: Annual review of entomology. 55, 3. September 2009, S. 171–188. doi:10.1146/annurev-ento-112408-085401.
- František Sehnal, Hiromu Akai: Insect silk glands: their types, development and function, and effects of environmental factors and morphogenetic hormones on them. In: International Journal of Insect Morphology and Embryology. 19, Nr. 2, 1990, S. 79–132. doi:10.1016/0020-7322(90)90022-H.
- Katharina Gries: Untersuchungen der Bildungsprozesse und der Struktur des Perlmutts von Abalonen. Dissertation, Universität Bremen, 2011 (PDF; 25,4 MB)
- Katharina Gries: Elektronenmikroskopische Untersuchungen des Polymer/Mineral-Verbundmaterials Perlmutt. Diplomarbeit, Universität Bremen, 2007 — (Memento des Originals vom 26. Dezember 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 4,1 MB)
- www.diplopoda.de Zur Eiablage der Diplopoden
- Katrin Kronenberger, Cedric Dicko and Fritz Vollrath: A novel marine silk. In: Naturwissenschaften. 2012, S. 1–8. doi:10.1007/s00114-0853-5.
- Kei Kamino: Novel barnacle underwater adhesive protein is a charged amino acid-rich protein constituted by a Cys-rich repetitive sequence. In: Biochemical Journal. 356, Nr. Pt 2, 2001, S. 503. PMC 1221862 (freier Volltext).
- Dominique Zimmermann, Susanne Randolf, Volker Mauss: Morphological adaptations to silk production by adult females in the pollen wasp genus Quartinia (Masarinae, Vespidae) – a keystone character for ground nesting in dry sand habitats. In: Arthropod Structure & Development, Band 62, Mai 2021, Artikel 101045.
- F. W. Gess: Ethology of three Southern African ground nesting Masarinae, two Celonites species and a silk-spinning Quartinia species, with a discussion of nesting by the subfamily as a whole (Hymenoptera : Vespidae). In: Journal of Hymenoptera Research, Band 1, 1992, S. 145–155.
- Jacqueline Kovoor: Comparative structure and histochemistry of silk-producing organs in arachnids. In: Ecophysiology of spiders. Springer, Berlin Heidelberg 1987, IV, S. 160–186 (englisch, springer.com [abgerufen am 16. März 2013]).
- P. A. Selden, W. A. Shear, M. D. Sutton: Fossil evidence for the origin of spider spinnerets, and a proposed arachnid order. In: Proceedings of the National Academy of Sciences. Band 105, Nummer 52, Dezember 2008, ISSN 1091-6490, S. 20781–20785, doi:10.1073/pnas.0809174106, PMID 19104044, PMC 2634869 (freier Volltext).
- Monika Fritz, Universität Bremen in Spiegel Online (abgerufen 27. Februar 2013)
- Hilary Ann Price: Structure and formation of the byssus complex in Mytilus (mollusca, bivalvia)
- Stichwort „Labialdrüse.“ In: Herder-Lexikon der Biologie. Spektrum Akademischer Verlag GmbH, Heidelberg 2003. ISBN 3-8274-0354-5.
- Robert Fedic, Michal Zurovec and Frantisek Sehnal: The silk of Lepidoptera. In: Journal of Insect Biotechnology and Sericology. 71, 2002. Abgerufen am 15. März 2013.
- Jai-Hoon Eum, et al.: Characterization of a novel repetitive secretory protein specifically expressed in the modified salivary gland of i Hydropsyche sp.(Trichoptera; Hydropsychidae). In: Insect biochemistry and molecular biology. 35, Nr. 5, Mai 2005, S. 435–441. doi:10.1016/j.ibmb.2005.01.009.
- Seidendrüsen lassen Spinnenbeine besser haften .
- Stanislav N. Gorb et al.: Biomaterials: silk-like secretion from tarantula feet. In: Nature, Band 443, Nr. 7110, 2006, S. 407–407 (PDF).
- F. Claire Rind et al.: Tarantulas cling to smooth vertical surfaces by secreting silk from their feet. In: J. Exp. Biol., Band 214, Nr. 11, 2011, S. 1874–1879.
- Michael Reilly: Silky-footed tarantulas don't come unstuck. In: New Scientist, Band 191, Nr. 2571, 2006, S. 12.
- F. Pérez-Miles, A. Panzera, D. Ortíz-Villatoro, C. Perdomo: Silk production from tarantula feet questioned. In: Nature, Band 461, 2009, S. E9–E10 (PDF).
- Rainer Foelix, Bastian Rast, Anne M. Peattie: Silk secretion from tarantula feet revisited: alleged spigots are probably chemoreceptors. In: J. Exp. Biol., Band 215, 2012, S. 1084–1089.
- Fernando Pérez-Miles, David Ortíz-Villatoro: Tarantulas do not shoot silk from their legs: experimental evidence in four species of New World tarantulas. In: J. Exp. Biol., Band 215, Nr. 10, 2012, 1749–1752.
- Stanislav N. Gorb et al.: Gorb et al. reply. In: Nature, Band 461, Nr. 7267, 2009, S. E9–E10.
- R. Foelix, B. Rast, B. Erb, B. Wullschleger: Spinnspulen auf den Tarsen von Vogelspinnen? Eine Gegendarstellung. In: Arachne, Band 16, S. 4–9, 2011.
- Scinexx.de Wissen aktuell
- U. Albrecht: Dreidimensionale Struktur von Proteinen - 2. Faserproteine (PDF; 8,2 MB), Abschnitt B.
- K. Zhang, H. Wang, C. Huang, Y. Su, X. Mo, Y. Ikada: Fabrication of silk fibroin blended P(LLA-CL) nanofibrous scaffolds for tissue engineering. In: J Biomed Mater Res. Band 43, 2009, S. 114–119.
- Sericin. In: Cytokines and Cells Online Pathfinder Encyclopedia. Januar 2008. Abgerufen am 27. April 2012.
- J. M. Gosline: The mechanical design of spider silks: from fibroin sequence to mechanical function. (PDF; 324 kB)
- C. Y. Hayashi, N. H. Shipley, R. V. Lewis: Hypotheses that correlate the sequence, structure, and mechanical properties of spider silk proteins. In: International journal of biological macromolecules. Band 24, Nummer 2–3, 1999 Mar-Apr, ISSN 0141-8130, S. 271–275, PMID 10342774.
- Regina Valluzzi, Samuel P. Gido, Wayne Muller, David L. Kaplan: Orientation of silk III at the air-water interface. In: International Journal of Biological Macromolecules. 24, Nr. 2–3, 1999, S. 237–242. doi:10.1016/S0141-8130(99)00002-1.
- Christine V. Benedict and J. Herbert Waite: Location and analysis of byssal structural proteins of Mytilus edulis. In: Journal of Morphology. 189, 1986, S. 171, doi:10.1002/jmor.1051890207.
- J.P Pujol et al.: Comparative study of the amino acid composition of the byssus in some common bivalve molluscs.
- J. R. Bell, D. A. Bohan, E. M. Shaw, G. S. Weyman: Ballooning dispersal using silk: world fauna, phylogenies, genetics and models. (PDF) In: Bulletin of Entomological Research, Band 95, Nr. 02, 2005, S. 69–114. doi:10.1079/BER2004350.
- Hans Thiele: Wasserspinne (Argyroneta aquatica), Atmung nach dem Prinzip der physikalischen Kieme
- Wörterbücher EWNT; Bauer/Aland zum Wort.
- Franz Olck, Art. Byssos, PWRE III,1 (1897) 1108–1114.
- Renata Matoničkin Kepčija, et al.: The role of simuliid and trichopteran silk structures in tufa formation during the Holocene of the Plitvice Lakes (Croatia). In: 1st International Symposium on Travertine, Ankara. 2005, S. 96–101.
- Samuel Zschokke: Palaeontology: Spider-web silk from the Early Cretaceous. In: Nature. 424, Nr. 6949, 2003, S. 636–637. doi:10.1038/424636a.
- Enrique Peñalver, David A. Grimaldi and Xavier Delclòs: Early Cretaceous spider web with its prey. In: Science. 312, Nr. 5781, 2006, S. 1761-1761. doi:10.1126/science.1126628.