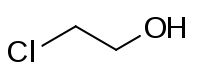
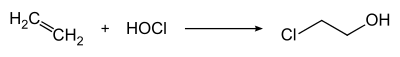2-Chlorethanol
2-Chlorethanol, häufig auch als Ethylenchlorhydrin bezeichnet, ist ein Chlor-Derivat des Ethanols und gehört zu den giftigsten organischen Halogen-Verbindungen.[8]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Chlorethanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H5ClO | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit etherischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 80,51 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,21 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
129 °C (1013 hPa)[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser[1] | ||||||||||||||||||
| Brechungsindex |
1,4419 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−295,4 kJ/mol[7] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
2-Chlorethanol kann in Lebensmitteln entstehen, vor allem in Gewürzen, die mit Ethylenoxid sterilisiert wurden. In Deutschland war die Begasung mit Ethylenoxid bis 1981 zugelassen, um Viren, Bakterien und Pilze abzutöten. Seither ist diese Art der Sterilisation im Lebensmittelbereich verboten,[9] da man inzwischen weiß, dass sowohl Ethylenoxid als auch sein Umwandlungsprodukt 2-Chlorethanol hochgiftig und erbgutverändernd sind. Allerdings ist in vielen Drittländern die Begasung mit Ethylenoxid, beispielsweise vor dem Schiffsversand, immer noch das Mittel der Wahl.[10][11]
Herstellung
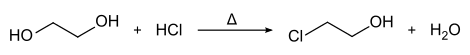
Im Labor kann 2-Chlorethanol aus Ethylenglycol durch Erhitzen mit Chlorwasserstoff hergestellt werden.
Technisch wird es durch Chlorhydrinierung von Ethen mit Hypochloriger Säure (HOCl) erzeugt.[12]
Die HOCl kann dabei aus Chlorkalk mit Chlorgas in wässriger Phase oder direkt durch Einleiten von Chlor in Wasser unter Druck gebildet werden.[8]
Eigenschaften
Physikalische Eigenschaften
Die farblose Flüssigkeit hat einen schwachen, angenehm süßen Geruch, der an Ether erinnert. 2-Chlorethanol siedet unter Normaldruck bei 129 °C. Die molare Verdampfungsenthalpie beträgt am Siedepunkt 45,7 kJ·mol−1.[13] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,44166, B = 2082.063 und C = −18.844 im Temperaturbereich von 269 bis 402 K.[13] Die Verbindung ist mit vielen Alkoholen und Wasser mischbar.
Sicherheitstechnische Kenngrößen
2-Chlorethanol bildet oberhalb der Flammpunktstemperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 55 °C.[1][14] Der Explosionsbereich liegt zwischen 5,0 Vol.‑% (160 g/m3) als untere Explosionsgrenze (UEG) und 16,0 Vol.‑% (540 g/m3) als obere Explosionsgrenze (OEG).[1][14] Die Zündtemperatur beträgt 425 °C.[1][14] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
2-Chlorethanol findet eine recht vielseitige Anwendung bei der Synthese von Farbstoffen, Insektiziden, Anästhetika und Weichmachern. Dabei vor allem als Reagenz für die Hydroxyethylierung.[8]
Primär wird es zu Herstellung von Ethylenoxid verwendet. Gelegentlich wird es als Lösungsmittel für Celluloseacetat und Ethylcellulose eingesetzt. Der Handel mit und der Transport von 2-Chlorethanol haben nur ein recht geringes Volumen. Meist wird es unmittelbar vor Ort erzeugt und direkt weiterverarbeitet.
Toxikologie
2-Chlorethanol ist ein gefährliches Gift, da nach Hautkontakt mit der Flüssigkeit meist eine örtliche Reizwirkung fehlt, die als Warnzeichen dienen könnte. Jeder Kontakt mit den Dämpfen oder der Flüssigkeit muss deshalb unbedingt vermieden werden. Die Aufnahme über die Haut hat mehrfach zu Todesfällen geführt. Dämpfe von 2-Chlorethanol reizen die Augen und die Atemwege. Das Zentralnervensystem wird gelähmt und es entstehen Leber- und Nierenschäden.[8] Bei der Verbrennung entstehen unter anderem Chlorwasserstoff und das hochgiftige Phosgen.
Auch wenn in älteren Quellen[8] von einer kanzerogenen Wirkung im Tierversuch berichtet wird, so zeigen neuere Untersuchungen, dass dies nicht der Fall ist. In den Versuchen zeigt die Substanz allerdings ein mäßig mutagenes Potenzial.[15][16][17]
Literatur
- Wallace L.Guess: Tissue reactions to 2-chloroethanol in rabbits. In: Toxicology and Applied Pharmacology. Band 16, Nr. 2, 1970, S. 382–390, doi:10.1016/0041-008X(70)90009-8.
- J. V. Bruckner, Wallace L. Guess: Morphological skin reactions to 2-chloroethanol. In: Toxicology and Applied Pharmacology. Band 22, Nr. 1, 1983, S. 29–44, doi:10.1016/0041-008X(72)90222-0.
Einzelnachweise
- Eintrag zu 2-Chlorethanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-100.
- Eintrag zu 2-chloroethanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt 2-Chlorethanol bei Sigma-Aldrich, abgerufen am 25. Januar 2020 (PDF).
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 107-07-3 bzw. 2-Chlorethanol), abgerufen am 31. März 2021.
- Universität Würzburg: Betriebsanweisung 2-Chlorethanol, abgerufen am 6. Juli 2007 (Memento vom 30. September 2007 im Internet Archive)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- Eintrag zu Ethylenchlorhydrin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. August 2016.
- Max Daunderer: Handbuch der Umweltgifte. Verlagsgruppe Hüthig Jehle Rehm, Ausgabe 6/2006
- Gewürze – Scharf und giftig. (Memento vom 30. September 2007 im Internet Archive) ÖKO-TEST November 95, abgerufen am 6. Juli 2007.
- J. Fowles, J. Mitchell, H. McGrath: Assessment of cancer risk from ethylene oxide residues in spices imported into New Zealand. In: Food and Chemical Toxicology. Band 39, Nr. 11, 2001, S. 1055–1062, doi:10.1016/S0278-6915(01)00052-7.
- L. Smith, S. Skyle: "Die Bildungsweise der Chlorhydrine. VIII. Über die Addition von unterchloriger Säure an eine Doppelbindung.", in Acta Chem. Scand. 1950, 4, S. 39–44. doi:10.3891/acta.chem.scand.04-0039
- Stull, D.R.: Vapor Pressure of Pure Substances. Organic and Inorganic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- C. Malaveille, H. Bartsch, A. Barbin, A. M. Camus, R. Montesano, A. Croisy, P. Jacquignon: Mutagenicity of vinyl chloride, chloroethyleneoxide, chloroacetaldehyde and chloroethanol. In: Biochemical and Biophysical Research Communications. Band 63, Nr. 2, 1975, S. 363–370, doi:10.1016/0006-291X(75)90697-X.
- Ada G. A. C. Knaap, C. E. Voogd, P. G. N. Kramers: Comparison of the mutagenic potency of 2-chloroethanol, 2-bromoethanol, 1,2-epoxybutane, epichlorohydrin and glycidaldehyde in Klebsiella pneumoniae, Drosophila melanogaster and L5178Y mouse lymphoma cells. In: Mutation Research/Genetic Toxicology. Band 101, Nr. 3, 1982, S. 199–208, doi:10.1016/0165-1218(82)90153-7.
- Hiroki Sakai, Tetsuya Tsukamoto, Masami Yamamoto, Kiyoshi Kobayashi, Hirofumi Yuasa, Toshio Imai, Tokuma Yanai, Toshiaki Masegi, Masae Tatematsu: Distinction of carcinogens from mutagens by induction of liver cell foci in a model for detection of initiation activity. In: Cancer Letters. Band 188, Nr. 1-2, 2002, S. 33–38, doi:10.1016/S0304-3835(02)00009-5.