Chloracetaldehyd
Chloracetaldehyd ist eine chemische Verbindung aus der Gruppe der Aldehyde. Er ist neben dem Dichloracetaldehyd und Trichloracetaldehyd einer der drei möglichen chlorierten Acetaldehyde. Die Verbindung bildet ein relativ stabiles Aldehydhydrat ClCH2CH(OH)2.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
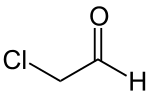 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chloracetaldehyd | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H3ClO | ||||||||||||||||||
| Kurzbeschreibung |
leicht flüchtige, farblose Flüssigkeit mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 78,50 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,19 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
leicht in Wasser unter Hydratbildung (443 g·l−1 bei 20 °C)[2][1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 1 ml·m−3 bzw. 3 mg·m−3[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung und Gewinnung
Beim Wacker-Hoechst-Verfahren zur Herstellung von Acetaldehyd aus Ethen fällt Chloracetaldehyd als Nebenprodukt an.[7] Wasserfreier Chloracetaldehyd kann durch die Oxidation von α-Chlorhydrin mittels Periodat erhalten werden.[3][8] Ebenfalls kann der Aldehyd auch in guter Ausbeute durch die Pyrolyse von Chlorethylencarbonat gewonnen werden.[7][9]
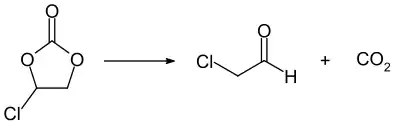
Eine gezielte Synthese durch die α-Chlorierung von Acetaldehyd ist ebenfalls bekannt.
Eigenschaften
Chloracetaldehyd ist eine farblose, stechend riechende Flüssigkeit, die unter Normaldruck bei 85 °C siedet. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in Torr, T in °C) mit A = 7,26359, B = 1338,8586 und C = 220,432 im Temperaturbereich von −7 bis 107 °C.[10] Die kritischen Größen lauten für die kritische Temperatur 282 °C, für den kritischen Druck 53,7 bar, für das kritische Volumen 0,201 l·mol−1 und für die kritische Dichte 0,3905 g·cm−3.[11] Die Verbindung ist in Wasser unter Hydratbildung sowie in üblichen organischen Lösungsmitteln gut löslich.[2] In Wasser wird ein auch als Hemihydrat bezeichnetes dimeres Acetal, chemisch 1,1'-Dihydroxy-2,2'-dichlordiethylether gebildet.[7] Diese Verbindung bildet farblose Kristalle, die zwischen 43 und 50 °C schmelzen und bei 84 °C scheinbar sieden, wobei der Zerfall in den Ausgangsaldehyd und Wasser erfolgt.[7]
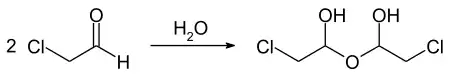
Die Löslichkeit in Wasser ist durch den Gehalt an der Hemihydratverbindung bestimmt.[7]
Löslichkeit des Hemihydrats in Wasser[7] Temperatur in °C 1 10 20 30 40 Konzentration in Ma% 13,35 22,2 44,3 62,7 81,5
Die Hemihydratverbindung lässt sich in Gegenwart von konzentrierter Schwefelsäure zum Trichlorparaldehyd (2,4,6-Trichlormethyl-1,3,5-trioxan), dem Trimeren des Chloracetaldehyds, zyklisieren.[7][12] Das Trimer bildet farblose Kristalle, die bei 88–89 °C schmelzen.[7]
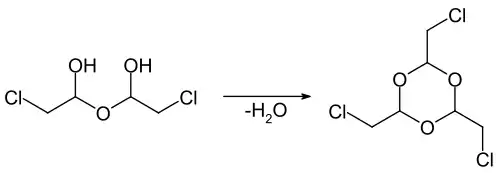
Durch eine azeotrope Dehydratisierung kann aus der Hemihydratverbindung das Tetramer Tetrachlormetaldehyd (2,4,6,8-Tetrakis(chlormethyl)-1,3,5,7-tetroxocan) erhalten werden.[13][7] Die Verbindung bildet farblose Kristalle, die bei 65–67 °C schmelzen bzw. sich bei einem Druck von 1,3 Pa bei 127–130 °C verdampfen lassen.[7]
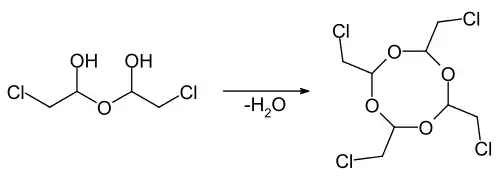
Die wasserfreien Verbindung neigt bei der Lagerung bei Raumtemperatur zur Bildung von Trimeren, Tetrameren und Polymeren mit einer Polyoxymethylenstruktur.[7]
Chloracetaldehyd bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Mit einem Flammpunkt von 70 °C gilt die Substanz als schwer entflammbar.[1] Der Explosionsbereich liegt zwischen 3,9 Vol.‑% als untere Explosionsgrenze (UEG) und 9,0 Vol.‑% als obere Explosionsgrenze (OEG).[1]
Toxikologie und Arbeitsschutz
Der Kontakt mit der Verbindung in flüssiger oder dampfförmiger Form kann zu einer zu starken Reizung bis zu einer Verätzung der Augen, der Atemwege und der Haut führen. Die Bildung eines Lungenödems kann nicht ausgeschlossen werden. Der LD50-Wert (Ratte, oral) beträgt 75 mg·kg−1.[2]
Verwendung
Chloracetaldehyd wird als vielseitiges Start- oder Zwischenprodukt in der organischen Synthese verwendet.[3] In der Synthese von Heterocyclen wie z. B. für Pyrrole[14], Furane[15][16][17], Thiophene[18][19], Imidazole[20][21], Oxazoline[22], Thiazoline[23], Thiazole[24][25] oder Indole[26] ist die Verbindung eine wichtige Ausgangssubstanz. Chloracetaldehyd kommt als Rohstoff für die Herstellung von Arzneimitteln, Insektiziden, Fungiziden, Desinfektionsmitteln, Farbstoffen, Härtern von Epoxidharzen und Antistatika zum Einsatz.[2]
Einzelnachweise
- Eintrag zu Chloracetaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Eintrag zu Chloracetaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. April 2015.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Chloroacetaldehyde, abgerufen am 4. November 2015.
- Eintrag zu Chloroacetaldehyde im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt Chloroacetaldehyde solution, produced by Wacker Chemie AG, Burghausen, Germany, ≥45.0% in H2O bei Sigma-Aldrich, abgerufen am 11. April 2015 (PDF).
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 107-20-0 bzw. Chloracetaldehyd), abgerufen am 2. November 2015.
- Jira, R.; Kopp, E.; McKusick, B.C.; Röderer, G.; Bosch, A.; Fleischmann, G.: Chloroacetaldehydes in Ullmann's Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a06_527.pub2.
- Hatch, L. F.; Alexander, H. E.: Preparation of Chloroacetaldehyde Hydrate in J. Am. Chem. Soc. 67 (1945) 688–688, doi:10.1021/ja01220a504.
- Gross, H.: Über α-Halogenäther. XVI. Monochloracetaldehyd bzw. Derivate des Glykolaldehyds und Glyoxals aus α-Halogenäthern in J. prakt. Chem. 21 (1963) 99–102, doi:10.1002/prac.19630210115.
- Yaws, C.L.: The Yaws Handbook of Vapor Pressure: Antoine Coefficients, 2nd edition, Elesevier 2015, ISBN 978-0-12-802999-2.
- Carl L. Yaws, Prasad K. Narasimhan: Critical Properties and Acentric Factor - Organic Compounds. In: Carl L. Yaws (Hrsg.): Thermophysical Properties of Chemicals and Hydrocarbons. Elsevier, 2009, ISBN 978-0-8155-1596-8.
- Natterer, K.: Über Monochloraldehyd in Monatsh. Chem. 3 (1882) 442–464, doi:10.1007/BF01516819.
- Kopp, E.; Smidt, J.: Reaktionen mit Chloracetaldehyd und 2.4-Dichlor-crotonaldehyd in Justus Liebigs Ann. Chem. 693 (1966) 117–127, doi:10.1002/jlac.19666930110.
- Quijano, M. L.; Nogueras, M.; Sanchez, A.; Alvarez de Cienfuegos, G.; Melgarejo, M.: Synthesis, anticancer and antimicrobiological activities of pyrrolo[2,3-d]pyrimidines in J. Heterocyclic Chem. 27 (1990) 1079–1083, doi:10.1002/jhet.5570270449.
- Bisagni, E.; Rivalle, C.: in Bull. Soc. Chim. Fr. 1974, 519.
- Padwa, A.; Gasdaska, J. R.: Generation of sulfur ylides by the desilylation of α-trimethylsilylbenzyl sulfonium salts in Tetrahedron 44 (1988) 4147–4156, doi:10.1016/S0040-4020(01)86662-X.
- Matsumoto, M.; Wanatabe, N.: in Heterocycles 22 (1984) 2313.
- Hirota, K.; Shirahashi, M.; Senda, S.; Yogo, M.: Pyrimidines. 65. Synthesis of 6-substituted thieno[2,3-d]pyrimidine-2,4(1H,3H)-diones in J. Heterocyclic Chem. 27 (1990) 717–721, doi:10.1002/jhet.5570270345.
- Aldvogel, E.: Synthese von 2-substituierten und 2,3-disubstituierten Alkyl- und Aryl-thiophenen und 2,3-anellierten Thiophen-Derivaten aus Ketonen als C2-Bausteine und Carbonodithiosäure-O-ethyl-S-(2-oxoethyl)ester als C2S-Baustein in Helv. Chim. Acta 75 (1992) 907–912, doi:10.1002/hlca.19920750325.
- Kluge, A. F.: Synthesis of an imidazo[1,2-c]pyrimidine analog of a thiamine antagonist coccidiostat and a comparison of several methods for the preparation of imidazo[1,2-c]pyrimidines in J. Heterocyclic Chem. 15 (1978) 119–121, doi:10.1002/jhet.5570150125.
- Senga, K.; Robins, R. K.; O’Brien, D. E.: Synthesis of certain imidazo[2,1-f] pyrazolo[3,4-d] pyrimidines in J. Heterocyclic Chem. 12 (1975) 1043–1044, doi:10.1002/jhet.5570120547.
- Maya Weber, Jürgen Jakob, Jürgen Martens: Synthese und Reaktivität von 3-Oxazolinen. In: Liebigs Annalen der Chemie. 1992, S. 1–6, doi:10.1002/jlac.199219920102.
- Jürgen Martens, Heribert Offermanns, Paul Scherberich: Einfache Synthese von racemischem Cystein. In: Angewandte Chemie. 93, 1981, S. 680–683, doi:10.1002/ange.19810930808.
- Begtrup, M.; Hansen, L. B. L.: New Methods for the Introduction of Substituents into Thiazoles in Acta Chem. Scand. 46 (1992) 372–383, doi:10.3891/acta.chem.scand.46-0372.
- Brandsma, L.; De Jong, R. L. P.; VerKruijsse, H. D.: An Efficient Synthesis of 1,3-Thiazole in Synthesis 1985, 948–949, doi:10.1055/s-1985-31396.
- Wender, P. A.; White, A. W.: Methodology for the facile and regio-controlled synthesis of indoles in Tetrahedron 39 (1983) 3767–3776, doi:10.1016/S0040-4020(01)88618-X.



