Methylketone
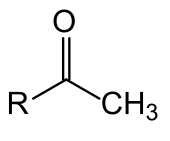
Methylketone, sind Ketone, welche als Reste einer nicht endständigen Carbonylgruppe mindestens eine Methylgruppe enthalten. Methylketone haben somit die allgemeine Formel CH3–C(O)–R. Methylketone sind z. B.:
- Aceton, als einfachstes Methylketon mit zwei Methylgruppen.
- Butanon, auch Methylethylketon, ist ein Methylketon.
- Acetophenon, als einfachstes aromatisches Methylketon.
Vorkommen
Einige Mikroorganismenarten, wie zum Beispiel Schimmelpilzarten wie Penicillium roqueforti bilden Methylketone, was zur Aromaerzeugung von Blauschimmelkäse genutzt wird.[1] Homologe Methylketone finden sich als Nebenprodukte der Autooxidation von Fetten und werden für die "Parfümranzigkeit" verantwortlich gemacht.[2]
Eigenschaften
Niedermolekulare Methylketone sind farblose, leichtbewegliche Flüssigkeiten und aufgrund der Polarität der Carbonylgruppe in Wasser löslich. Niedermolekulare Methylketone zeichnen sich durch einen meist angenehmen, fruchtig-blumigen Geruch aus.[3] Höhermolekulare Methylketone sind Feststoffe.
Methylketone besitzen auf Grund des +I-Effekts der Alkylsubstituenten am Carbonyl-Kohlenstoffatom eine niedrigere Reaktionsfreudigkeit als Aldehyde und neigen nicht zur Polymerisation. Im Unterschied zu den Aldehyden erfolgt mit Ketonen keine Reaktion bei der Fehling- und Tollens-Probe, da die Ketongruppe unter Erhalt des Kohlenstoffgerüsts nicht weiter oxidiert werden kann.
Herstellung
Die Herstellung erfolgt durch Oxidation von sekundären Alkoholen.
Verwendung
Methylketone werden in der organischen Chemie in den verschiedensten Sektoren eingesetzt, z. B. in der Haloform-Reaktion, bei der der Methylrest gewissermaßen abgespalten wird und durch eine Hydroxygruppe ersetzt wird. Hierbei entsteht die entsprechende Carbonsäure und aus dem Methylrest wird das entsprechende Trihalogenmethan gebildet.[4][5] Speziell Aceton wird als Lösungsmittel und als Reinigungsmittel eingesetzt.
Spektroskopie
Da es sich bei den Methylketonen um eine Untergruppe der Ketone handelt, findet sich in IR-Spektren die charakteristischen Bande der C=O-Valenzschwingung im Bereich von 1690 bis 1750 cm−1.[6]
Einzelnachweise
- J. Schormüller: Lehrbuch der Lebensmittelchemie. Springer-Verlag, 2013, ISBN 978-3-642-65778-8, S. 73 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ludwig Acker, Gerhard Bressau, Georg Benedikt Brubacher, Karl Maximilian Bürger, Stefan Diemair, Willibald Diemair, Klaus Doerffel, Rudi Franck, Hansfriedel Gudjons, Paul Joppien, Ludwig Kotter, Ernst Kröller, Hermvn Libert, Helmut Mühlschlegel, Titus Niedermaier, Konrad Pfeilsticker, Gerhard Pfleiderer, Wilhelm Postel, Hanspeter P. Probst, W. Rödder, Werner Schäfer, Leopold Schmid, Erich Schneider, Artur Seher, Hans Sommer, Helmut Thaler, Jean Paul Vuilleumier, Herbert Woidich: Analytik der Lebensmittel Nachweis und Bestimmung von Lebensmittel-Inhaltsstoffen. Springer-Verlag, 2013, ISBN 978-3-642-46069-2, S. 655 (eingeschränkte Vorschau in der Google-Buchsuche).
- H.-D. Belitz, W. Grosch: Lehrbuch der Lebensmittelchemie. Springer-Verlag, 2013, ISBN 978-3-662-08306-2, S. 186 (eingeschränkte Vorschau in der Google-Buchsuche).
- F. A. Carey, R. J. Sundberg: Organische Chemie, Wiley-VCH Verlag 2004, ISBN 3-527-29217-9.
- Louis F. Fieser und Mary Fieser: Organische Chemie, 2. Auflage, Verlag Chemie 1982, S. 405–406, ISBN 3-527-25075-1.
- Kurt Peter C. Vollhardt, Neil E. Schore: Organische Chemie. John Wiley & Sons, 2011, ISBN 3-527-32754-1, S. 873 (eingeschränkte Vorschau in der Google-Buchsuche).