Uranylverbindungen
Uranylverbindungen sind Verbindungen, die das Uranyl(VI)-Ion (UO22+) und/oder das Uranyl(V)-Ion (UO2+) enthalten. Das Uranylion ist die am weitesten verbreitete Form in Uranverbindungen.[1] Feste Uranylverbindungen besitzen meist eine gelbe Farbe, wobei auch rote, orange oder grüne Farbanteile vorkommen. Bekannte Verbindungen sind z. B. Uranylacetat und Uranylnitrat. Sie sind wasserlösliche Uransalze und kommerziell erhältlich. Alle Uranylverbindungen sind sehr giftig und radioaktiv.

Vorkommen und Minerale

Uranylverbindungen kommen in der Natur meistens in der Form von Uranylmineralen in oxidierten Teilen von Uranlagerstätten vor. Häufig vorkommende Uranylminerale sind beispielsweise:[2]
- Tyuyamunit, Ca(UO2)2V2O8 · 8 H2O
- Autunit, Ca(UO2)2(PO4)2 · 8–12 H2O
- Torbernit, Cu(UO2)2(PO4) · 8–12 H2O
- Uranocircit, Ba(UO2)2(PO4)2 · 12 H2O
- Uranophan, (H3O)2Ca(UO2)2(SiO4) · 3 H2O
Bereits im Jahre 2005 waren mehr als 200 verschiedene Uranminerale bekannt.[3] Die Website "Mineralienatlas" listet zur Zeit (Stand 2016) über 300 Uranminerale.[4] Siehe auch: Liste der Uranminerale
Uranylminerale, die Uran der Oxidationsstufe +4 enthalten, können dabei helfen, die Entstehung von Uranlagerstätten und die Wechselwirkungen zwischen Wasser und der jeweiligen Erzparagenese zu verstehen, die an den Rändern uranreicher Vorkommen auftreten.
Eine Oxidation einer Uranverbindung an der Luft kann zu einer Uranylverbindung führen.[5] Eine Kontamination durch Uranylionen wurde auf und um Übungsziele gefunden, die mit Uranmunition beschossen wurden.[6] Auch durch Leckagen von Behältern für Uranhexafluorid werden Uranylverbindungen in die Umwelt gebracht.[7] Das Uranhexafluorid hydrolysiert unter anderem zu Uranylfluorid und bildet mit den im Boden enthaltenen Komponenten weitere Uranylverbindungen in verschiedenen Zusammensetzungen.
Struktur
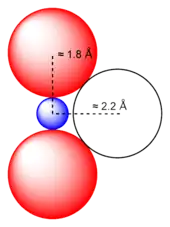
Der geometrische Aufbau des UO22+-Ions ist linear. Mit diesen trans-Oxo-Gruppen unterscheidet sich das Uranyl(VI)-Kation damit grundlegend von den Oxo-Kationen der Gruppe VI, Molybdyl (MoO22+) und Tungstyl (WO22+), deren Sauerstoffatome in cis-Konfiguration, d. h. gewinkelt, zueinander stehen. Denning konnte 2007 zeigen, dass die Bindungen der Sauerstoffatome an das Uranatom mit einer Bindungslänge von ca. 179 pm[8] formal einer Dreifachbindung entsprechen.[9]
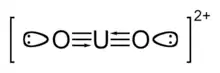 Das Uranyl(VI)-Ion mit Veranschaulichung des dreifachen U–O-Bindungsverhältnisses.
Das Uranyl(VI)-Ion mit Veranschaulichung des dreifachen U–O-Bindungsverhältnisses.
Aufgrund der linearen Geometrie des UO22+-Kations können sich weitere Liganden (L) lediglich in der äquatorialen Ebene anordnen. Sie befinden sich bei natürlichen Uranylmineralen häufig in einem Abstand von ca. 240 pm und sind damit erheblich weiter vom Uranatom entfernt, als die Uranyl-Sauerstoffatome.[2] Damit ist, wie in der rechts nebenstehenden Abbildung gezeigt, auch eine Anbindung eines dritten oxidischen Sauerstoffatoms ausgeschlossen. Diese trans-Anordnung führt daher dazu, dass die Koordinationsgeometrie des Uranyl-Ions in Komplexen entweder trigonal-bipyramidal, quadratisch-bipyramidal (oktaedrisch), pentagonal-bipyramidal oder hexagonal-bipyramidal ist.[10] Natürliche Beispiele für diese Koordinationsgeometrie sind die Minerale Autunit (oktaedrisch), Oursinit (pentagonal-bipyramidal) und Studtit (hexagonal-bipyramidal).
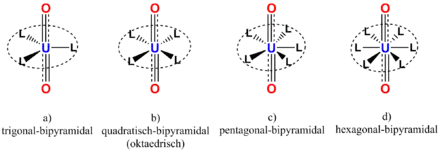 Koordinationsgeometrien des Uranyl-Ions (L = Ligand)
Koordinationsgeometrien des Uranyl-Ions (L = Ligand)
Trotz dieser formalen Dreifachbindung wird in diesem Artikel, wie in der Fachliteratur auch, die "klassische" Lewis-Formel als [O=U=O]2+ verwendet.
Eigenschaften
Die Uranchemie hat traditionell mit der Flüssigkeitschemie des Uranylions zu tun und hängt mit der Molekularchemie zusammen. Einen wichtigen Nutzen liefert die Uranchemie bei der Herstellung von Urandioxid, welches in Form von Brennstoffpellets in Leichtwasserreaktoren zum Einsatz kommt. Oft zerlegt sich das Spaltmaterial auf chemischem Weg, bevor es aufgebraucht ist.
Wässrige Chemie
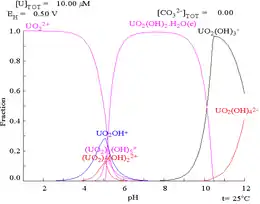
Die wässrige Chemie des Urans ist bestimmt durch das zweifach positiv geladene Uranyl(VI)-Ion UO22+; das Uranyl(V)-Ion UO2+ ist in wässriger Lösung instabil und zerfällt zu Uranyl(VI) und Uran(IV).[1] Das Uranyl(VI)-Kation kann als Produkt der Hydrolyse des hypothetischen, sechsfach positiv geladenen Uran(VI) U6+-Ions angesehen werden, das wie folgt formuliert werden kann:
- [U(H2O)n]6+ → [UO2(H2O)4]2+ + 4 H+ + (n − 4) H2O
Die Triebkraft dieser Reaktion ist eine Verringerung der Ladungsdichte am Uranatom. Dies zeigt sich auch in der Anzahl und Art der äquatorial koordinierten Liganden. Theoretische Untersuchungen zeigen die Abhängigkeit zwischen Ladungsdichte und Bindungslängen in Uranyl(VI)-Komplexen. Mit der Koordination stärkerer Lewis-Basen in äquatorialer Position wird die positive Ladungsdichte am Uranatom verringert, und die Bindungslänge des Uranatoms zu den axialen Uranyl-Sauerstoffatomen wird länger. Die Stabilität bezüglich der äquatorial gebundenen Liganden nimmt in folgender Reihe zu: H2O < Cl− < F− < OH− < CO32− < O22−. Die zugrundeliegenden physikalischen Wechselwirkungen sind für die Liganden aqua (H2O), tetrafluoro (F−)4, tetrachloro (Cl−)4 und tetrahydroxo (OH−)4 elektrostatischer Natur, wohingegen peroxo (O22−) und carbonato (CO32−) deutliche Kovalenzanteile zeigen.[11] Die Anzahl der äquatorial gebundenen Wassermoleküle am Uranyl(VI)-Ion ist häufig fünf.[12] Die Ladungsdichte wird durch weitere Hydrolyse reduziert, beispielsweise wenn ein H2O-Ligand ein Proton abgibt und zu einem OH−-Liganden wird:
In wässriger Lösung kann das Uranyl(VI)-Ion daher als schwache Säure bezeichnet werden.
Mit ansteigendem pH-Wert bilden sich vermehrt polymere Ionen mit der Stöchiometrie [(UO2)2(OH)2]2+ und [(UO2)3(OH)5]+, bevor Uranylhydroxid [UO2(OH)2] ausfällt.[14]
Das Uranyl(VI)-Ion kann durch geeignete Reduktionsmittel im wässrigen Medium zum grünen Uran(IV)-Ion U4+ reduziert werden. Die weitere Reduktion zum Uran(III)-Ion U3+ kann durch Reduktion von Uran(IV)-Ionen mit Zinkamalgam erfolgen; es wird aber in wässriger Lösung sehr leicht oxidiert und ist nur in völlig sauerstofffreien Lösungen stabil.
Wässrige Komplexchemie
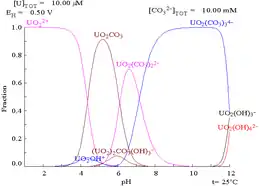
Das Uranyl(VI)-Ion verhält sich im Sinne des HSAB-Konzepts als harte Säure und bildet schwächere Bindungen zu den schwächeren Liganden (z. B. Stickstoffbasen) als mit harten Liganden wie Fluorid (F−) oder sauerstoffhaltigen Basen wie Oxid (O2−), Hydroxid (OH−), Carbonat (CO32−), Nitrat (NO3−), Sulfat (SO42−), Phosphat (PO43−) oder Carboxylat (R–COO−). Durch die gute Löslichkeit einiger Uranyl-Carbonato-Komplexe kann das Uranylion von anderen begleitenden Schwermetallionen gut abgetrennt werden, wohingegen Uranyl-Phosphat-Komplexe wenig löslich sind. Uranyl(VI)-phosphate bilden daher auch eine wichtige Gruppe bei den Uranmineralien (z. B. Autunit, Torbernit, Uranocircit u. a.). Weitere Uranmineralien bestehen aus Uranyl-Arsenat-Komplexen (z. B. Zeunerit) und noch komplizierteren Uranyl-Hydroxid-Phosphat-Komplexen (z. B. Renardit). Ferner ist das wichtige Mineral Carnotit zu nennen, das aus einem Uranyl-Vanadat-Komplex vom Kalium besteht.[15]
Beispiele für basische Uranyl(VI)-Komplexe in wässriger Lösung:
- UO2(OH)2
- UO2(CO3)22−
- UO2(CO3)34−
- UO2(OH)42−, isoliert als [Co(NH3)6]2[UO2(OH)4]3 · x H2O[16]
Pilze
Uranylverbindungen spielen auch in der Biochemie eine Rolle. An den Pilzen Aspergillus niger und Paecilomyces javanicus konnte mittels Röntgenpulverdiffraktometrie beispielsweise gezeigt werden, dass, wenn sie auf einem Medium mit einer organischen Phosphatquelle (hier: Glycerin-2-phosphat (G2P)) wachsen, diese die Uranylphosphate Metaankoleit [(K1,7Ba0,2)(UO2)2(PO4)2 · 6 H2O bzw. K(UO2)(PO4) · 3 H2O)], Uramphit (NH4UO2PO4 · 3 H2O), wasserhaltiges Uranylphosphat [(UO2)3(PO4)2 · 4 H2O], wasserhaltiges Kaliumuranylphosphat (KUO2PO4 · 3 H2O) und Chernikovit [(H3O)2(UO2)2(PO4)2 · 6 H2O] abscheiden.[17] Gleichermaßen ist der acidophile Pilz Coniochaeta fodinicola in der Lage, Uran in Form von Uranyl(VI)-Ionen aus dem Wasser einer Uranmine zu binden.[18]
Bakterien
An Citrobacter-Bakterien konnte gezeigt werden, dass diese in der Lage sind, ein Vielfaches ihres Eigengewichts an Uranyl aufzunehmen und als saures Uranylphosphat (HUO2PO4) an der Zelloberfläche durch Biomineralisation abzuscheiden.[19][20] Mehrere weitere Bakteriengattungen sind dazu in der Lage, Uranyl(VI) enzymatisch zu reduzieren. Die mesophilen Gattungen Geobacter, Shewanella, und Desulfotomaculum sind dazu in der Lage, aus der Reduktion des Uranyl(VI) Energie für ihr Wachstum zu gewinnen. Andere Bakterien, beispielsweise die thermophilen Bakterien Thermus scotoductus, Pyrobaculum islandicum und Thermoanaerobacter sp., können lösliche Uranyl(VI)-Verbindungen reduzieren, jedoch dient dies nicht der Energiegewinnung. Am thermophilen Bakterium Thermoterrabacterium ferrireducens konnte gezeigt werden, dass dieses auch unlösliche U(VI)-Verbindungen verstoffwechseln kann.[21]
Uranyl(V)
-Al_Pacman_Complex.jpg.webp)
Die Einelektronenreduktion des Uranyl(VI)-Dikations (UO22+) führt zur Darstellung des Uranyl(V)-Monokations (UO2+). Dies ist in wässriger Lösung instabil und disproportioniert zu U4+ und UO22+:[1]
- UO2+ + 4 H+ → U4+ + UO22+ + 2 H2O
Die synthetische Darstellung von Uranyl(V)-Komplexen war daher lange Zeit nicht möglich. Im Jahre 2003 gelang es jedoch, die erste Uranyl(V)-Verbindung darzustellen und röntgenkristallographisch zu untersuchen. Berthet et al. synthetisierten durch Zufall das Kation [UO2(OPPh3)4]+ (Ph = Phenyl) in Form des Triflat-Salzes.[22] Das Uranyl(V)-Ion unterscheidet sich zum Uranyl(VI) durch seine längeren U–O-Bindungen, sowie eine höhere Lewis-Basizität der Uranyl-Sauerstoffatome, bedingt durch die geringere Ladungsdichte am Uranatom.[11] Seine Elektronenkonfiguration lautet daher [Rn] 5f1, d. h., es besitzt ein einzelnes f-Elektron und ist daher paramagnetisch.[1] Seither sind verschiedene Ligandsysteme erprobt worden, in denen gezielt, unter Ausschluss von Luftsauerstoff und Feuchtigkeit, eine Darstellung von Uranyl(V)-Komplexen erfolgen kann. Die erhöhte Basizität der Uranyl-Sauerstoffatome führt schließlich häufig zur Koordination von Heteroatomen, so zum Beispiel in einem polymeren Uranyl(V)-Komplex {[UO2py5][KI2py2]}n (py = Pyridin), dessen äquatoriale Ebene von Pyridin-Liganden und dessen Uranyl-Sauerstoffatome von K+-Ionen koordiniert werden.[23] In ähnlicher Weise kann die Einelektronenreduktion von Uranyl(VI)-Pacman-Komplexen mit Hilfe von Diisobutylaluminiumhydrid durchgeführt werden, so dass ein Uranyl(V)-Aluminium(III)-Komplex entsteht, in dem das Aluminiumatom direkt an den Uranyl-Sauerstoff gebunden ist.[24]
Uranylverbindungen
Folgende Uranyl(VI)-Verbindungen sind unter anderem bekannt:
- Uranylhalogenide
- Uranylfluorid, UO2F2
- Uranylchlorid, UO2Cl2
- Uranylbromid, UO2Br2
- Uranyliodid, UO2I2
- Weitere Uranylsalze und -verbindungen:
- Uranylcarbonat, UO2CO3
- Uranylacetat, UO2(C2H3O2)2
- Uranylnitrat, UO2(NO3)2
- Uranylsulfat, UO2SO4
- Uranylhydroxid, UO2(OH)2 bzw. (UO2)2(OH)4 im wässrigen Medium
- Uranylperoxid, UO2O2
- Urantrioxid, UO3
Uranylnitrat und Uranylacetat sind lösliche Uransalze. Diese Salze sind kommerziell erhältlich und entsprechen in ihrer Giftigkeit anderen Schwermetallnitraten- und acetaten.
 Uranylcarbonat
Uranylcarbonat
Synthese
Die Laborsynthese von Uranyl(VI)-Verbindungen kann auf verschiedene Weise erfolgen, z. B. die Oxidation von UCl4 bei 300–350 °C zu UO2Cl2. Es hat sich aber als zweckmäßig erwiesen, die kostengünstigen oder häufig in alten Chemikalienbeständen vorhandenen Uranylsalze wie Uranylacetat in entsprechende hydrolyse- und luftempfindlichen Uranylhalogenide (UO2X2 (X = (F), Cl, Br, I)),[25] Uranyltriflat (UO2(OTf)2) oder Uranylbis(hexamethyldislilyamid) (UO2{N(Si(CH3)3)2}2)[26] zu überführen.
Die Synthese von Uranylchlorid aus Uranylacetat erfolgt beispielsweise durch Rühren des Acetats in einem Überschuss (exc. = Exzess) konzentrierter Salzsäure im Stickstoffstrom bis zur Trockene. Das Rohprodukt wird in Tetrahydrofuran (THF) gelöst und ein Überschuss Chlortrimethylsilan (TMSCl) zugesetzt, um restliches Wasser zu entfernen. Das Lösungsmittel wird anschließend entfernt, das Produkt im Vakuum getrocknet und unter Stickstoffatmosphäre gelagert.
- UO2(CH3COO)2 + exc. HCl (aq) → UO2Cl2(aq)3 + 2 CH3COOH
- UO2Cl2(aq)3 + exc. THF + exc. TMSCl → UO2Cl2(thf)3 + 6 HCl + 3 (TMS)2O[25]
Spektroskopie

Infrarot-Spektroskopie
Das Uranylion zeichnet sich durch typische IR-Banden aus, die zwischen 920 und 980 cm−1 liegen, und der antisymmetrischen O=U=O-Streckschwingung zugeschrieben werden. Die symmetrische Streckschwingung kann mit Hilfe der Raman-Spektroskopie bei 860 cm−1 gefunden werden. In Uranyl(V)-Komplexen sind diese zu geringeren Wellenzahlen (897 bis 912 cm−1) verschoben. Die Analyse dieser Schwingungen ist ein wichtiges Hilfsmittel bei der Charakterisierung von Uranyl-Komplexen, da ihre Werte antiproportional zur Donorstärke der äquatorialen Liganden sind.[8][27]
Elektromagnetische Spektroskopie
Das Uranyl(V)-Ion ist, aufgrund seines einzelnen f-Elektrons geeignet, mit Hilfe von Elektronenspinresonanz (ESR) untersucht zu werden. Gleichermaßen erzeugt dieses freie Elektron in Uranyl(V)-Komplexen eine paramagnetische Verschiebung der Resonanzen in der NMR-Spektroskopie.[28]
Die magnetischen Eigenschaften von Uranyl(V)-Komplexen können weiterhin durch SQUID-Magnetometrie ermittelt werden.[29][30]
Optische Spektroskopie
Das Uranyl(VI)-Ion hat eine charakteristische Absorptionsbande bei 25 000 cm−1 (400 nm), was blauviolettem Licht entspricht. Als Resultat erscheinen viele Uranverbindungen mit der Komplementärfarbe gelb.[5] Häufig haben Uranylkomplexe auch eine hellgrüne Fluoreszenz unter UV-Licht, die mittels Laser-Fluoreszenzmethoden auch als analytisches Hilfsmittel genutzt werden kann, so zum Beispiel in der TRLFS (Time-Resolved Laser-Induced Fluorescence Spectroscopy).[31] Das Uranyl(V)-Ion besitzt aufgrund seines freien f-Elektrons den Grundterm 2F, der weiter in 2F7/2 und 2F5/2 aufgespalten ist, so dass häufig im elektromagnetischen und nah-infraroten Spektrum vier Übergänge beobachtet werden können.[5]
Verwendung
Laboranwendungen
Lösliche Uranylsalze wie Uranylacetat werden zur Negativkontrastierung in der Transmissions-Elektronenmikroskopie (TEM) eingesetzt. Nach Spreitung eines DNA-Moleküls kann dieses ebenfalls mittels Uranylacetat im TEM sichtbar gemacht werden.[32] Eine Lösung von Uranylacetat in Eisessig sowie eine Lösung von Magnesiumacetat in Eisessig wird in vereinigter Form zum Nachweis von Natrium verwendet. Dabei bilden sich schwach gelbe Oktaeder oder Dodekaeder mit rhombischer Struktur. Es handelt sich um die schwerlösliche Verbindung Magnesium-natrium-triuranyl-nonaacetat [MgNa(UO2)3(CH3COO)9 · 9 H2O].[33]
Industrielle Anwendungen
Ein industriell wichtiger Komplex ist das Uranylnitrat, [UO2(NO3)2] · 2 H2O, das in der äquatoriellen Ebene sechs Donoratome koordiniert, von denen vier Sauerstoffatome von den zwei zweizähnigen Nitrat-Ionen stammen, sowie zwei Sauerstoffatome von den zwei koordinierten Wassermolekülen. Das Uranatom weist demnach eine hexagonal-bipyramidale Koordinationsgeometrie auf.[34] Ladungsneutrale Komplexe wie Uranylnitrat können ebenfalls in organische Lösungsmittel wie Diethylether extrahiert werden. Die zuvor koordinierten Wassermoleküle werden dabei durch Diethylethermoleküle verdrängt. Der Komplex wird hydrophob und geht in die organische Phase über. Da Nitrat stärkere Komplexe zu den Actinoiden als zu den Lanthanoiden und Übergangsmetallen bildet, wird dieser Synergie-Effekt bei der Aufarbeitung von Kernbrennstoff genutzt, indem Uranyl zusammen mit Plutonyl(VI) (PuO22+) gemeinsam extrahiert wird.[35]
Konkret wird in der Aufarbeitung von Kernbrennstoff das Uranylnitrat mit Tributylphosphat (TBP, (CH3CH2CH2CH2O)3PO) als Ligand und Kerosin als Lösungsmittel extrahiert. Durch Behandlung mit Salpetersäure entsteht in einem späteren Schritt der Nitrato-Komplex [UO2(NO3)4]2−, der besser in Wasser löslich ist und so zurückgewonnen wird. Durch Verdampfen des Wassers wird das Uranylnitrat als Feststoff erhalten.[34]
Gesundheits- und Umweltgefahren
| Uranylverbindungen | ||||
| GHS- Kennzeichnung[36] |
| |||
| H- und P-Sätze | 330‐300‐373‐411 | |||
| ? | ||||
Uranylverbindungen sind hochgiftige Verbindungen und sollten nicht in den Körper gelangen. Sie verursachen starke Nierenschäden und töten die Zellen der Nierenkanälchen (Tubuli), durch die der Primärharn fließt. Außerdem können sie Leukämie auslösen. Meist werden Nieren, Leber, Lunge und das Gehirn geschädigt. Häufungen von Uranylionen im menschlichen Gewebe, einschließlich der Keimzellen[37] rufen Erbkrankheiten hervor, und sind in weißen Blutkörperchen die Ursache für Erkrankungen des Immunsystems.[38] Uranylverbindungen sind außerdem starke Nervengifte.
Alle Uranylverbindungen sind radioaktiv. Die Aktivität ist von der Isotopenzusammensetzung des Urans abhängig. Die Toxizität löslicher Uranylsalze ist proportional zur Geschwindigkeit ihrer Aufnahme in menschlichem Gewebe im Falle einer Inkorporation.
Einzelnachweise
- P. L. Arnold, J. B. Love, D. Patel: Pentavalent uranyl complexes, In: Coordination Chemistry Reviews, 2009, Band 253, S. 1973–1978, doi:10.1016/j.ccr.2009.03.014.
- P. C. Burns, R. C. Ewing, F. C. Hawthorne: The crystal chemistry of hexavalent uranium: polyhedron geometry, bond-valence parameters, and polymerization of polyhedra, In: The Canadian Mineralogist, 1997, Band 35, S. 1551–1570. PDF 1,7 MB (englisch)
- P. C. Burns: U6+ Minerals and Inorganic Compounds: Insights into an expanded structural hierarchy of crystal structures In: The Canadian Mineralogist, 2005, Band 43, S. 1839–1894. (Abstract) (englisch)
- Mineralsuche auf Mineralienatlas.de
- S. Cotton: Lanthanides and Actinides. Oxford University Press, New York 1991, ISBN 978-0-19-507366-9, S. 128.
- B. Salbu, K. Janssens, O. C. Linda, K. Proost, L. Gijsels, P. R. Danesic: Oxidation states of uranium in depleted uranium particles from Kuwait. In: Journal of Environmental Radioactivity. Band 78, 2004, S. 125–135, doi:10.1016/j.jenvrad.2004.04.001.
- Assessment of the Public Health Impact From the Accidental Release of UF6 at the Sequoyah Fuels Corporation Facility at Gore, Oklahoma (Memento des Originals vom 15. September 2006 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 3,1 MB); Docket No. 40-8027. License No. SUB-1010. Manuscript Completed: March 1986; Date Published: March 1986. Ad Hoc Interagency Public Health Assessment Task Force, U.S. Nuclear Regulatory Commission; Washington, D.C. 20555.
- D M. P. Mingos (Series Editor), T. E. Albrecht-Schmitt (Volume Editor): Organometallic and Coordination Chemistry of the Actinides. Springer, Berlin, Heidelberg 2008, S. 135.
- R. G. Denning: Electronic Structure and Bonding in Actinyl Ions and their Analogs, In: The Journal of Physical Chemistry A, 2007, Band 111, 20, S. 4125–4143, doi:10.1021/jp071061n.
- S. V. Krivovichev, P. C. Burns, I. G. Tananaev (Editors): Structural Chemistry of Inorganic Actinide Compounds. Elsevier, 2007, S. 33.
- V. Vallet, U. Wahlgren, I. Grenthe: Probing the Nature of Chemical Bonding in Uranyl(VI) Complexes with Quantum Chemical Methods, In: The Journal of Physical Chemistry A, 2012, Band 116 (50), S. 12373–12380, doi:10.1021/jp3091123.
- D. Hagberg, G. Karlström, B. O. Roos, L. Gagliardi: The Coordination of Uranyl in Water: A Combined Quantum Chemical and Molecular Simulation Study, In: Journal of the American Chemical Society, 2005, Band 127 (41), S. 14250–14256, doi:10.1021/ja0526719.
- IUPAC SC-Database A comprehensive database of published data on equilibrium constants of metal complexes and ligands. In: Academic Software.
- J. C. Taylor: Synergic Effects in Solvent Extraction, In: Acta Crystallographica Section B, 1971, B27, S. 1088–1091. (Abstract) (englisch)
- J. Rösler: Lehrbuch der Mineralogie. Leipzig 1981, S. 649–652.
- D. L. Clark, S. D. Conradson, R. J. Donohue, W. D. Keogh, D. E. Morris, P. D. Palmer, R. D. Rogers, C. D. Tait: Chemical Speciation of the Uranyl Ion under Highly Alkaline Conditions. Synthesis, Structures, and Oxo Ligand Exchange Dynamics, In: Inorganic Chemistry, 1999, Band 38, S. 1456–11466, doi:10.1021/ic981137h.
- X. Liang, S. Hillier, H. Pendlowski, N. Gray, A. Ceci, G. M. Gadd: Uranium phosphate biomineralization by fungi, In: Environmental Microbiology, 2015, Band 17 (6), S. 2064–2075, doi:10.1111/1462-2920.12771.
- X. Vázquez-Campos, A. S. Kinsela, R. N. Collins, B. A. Neilan, N. Aoyagi, T. D. Waite: Uranium Binding Mechanisms of the Acid-Tolerant Fungus Coniochaeta fodinicola, In: Environmental Science and Technology, 2015, Band 49 (14), S. 8487–8496, doi:10.1021/acs.est.5b01342.
- L. E. Macaskie, R. M. Empson, A. K. Cheetham, C. P. Grey, A. J. Skarnulis: Uranium bioaccumulation by a Citrobacter sp. as a result of enzymically mediated growth of polycrystalline HUO2PO4, In: Science, 1992, Band 257 (5071), S. 782–784, doi:10.1126/science.1496397.
- L. E. Macaskie, K. M. Bonthrone,P. Yong, D. T. Goddard: Enzymically mediated bioprecipitation of uranium by a Citrobacter sp.: a concerted role for exocellular lipopolysaccharide and associated phosphatase in biomineral formation, In: Microbiology, 2000, Band 146, S. 1855–1867, doi:10.1099/00221287-146-8-1855.
- T. V. Khijniak, A. I. Slobodkin, V. Coker, J. C. Renshaw, F. R. Livens, E. A. Bonch-Osmolovskaya, N.-K. Birkeland, N. N. Medvedeva-Lyalikova and J. R. Lloyd: Reduction of Uranium(VI) Phosphate during Growth of the Thermophilic Bacterium Thermoterrabacterium ferrireducens, In: Applied and Environmental Microbiology, 2005, Band 71 (10), S. 6423–6426, doi:10.1128/AEM.71.10.6423-6426.2005.
- J.-C. Berthet, M. Nierlich, M. Ephritikhine: Isolation of a Uranyl [UO2] Species: Crystallographic Comparison of the Dioxouranium(V) and (VI) Compounds [UO2(OPPh3)4](OTf)n (n=1, 2), In: Angewandte Chemie International Edition, 2003, Band 42 (17), S. 1952–1954, doi:10.1002/anie.200250506.
- L. Natrajan, F. Burdet, J. Pécaut, M. Mazzanti: Synthesis and Structure of a Stable Pentavalent-Uranyl Coordination Polymer, In: Journal of the American Chemical Society, 2006, Band 128, S. 7152–7153, doi:10.1021/ja0609809.
- M. Zegke, G. S. Nichol, P. L. Arnold, J. B. Love, D. Patel: Catalytic one-electron reduction of uranyl(VI) to Group 1 uranyl(V) complexes via Al(III) coordination, In: Chemical Communications, 2015, Band 51 (27), S. 5876–5879. PDF 2,0 MB (englisch)
- M. P. Wilkerson, C. J. Burns, R. T. Paine, B. L. Scott: Synthesis and Crystal Structure of UO2Cl2(THF)3: A Simple Preparation of an Anhydrous Uranyl Reagent, In: Inorganic Chemistry, 1999, Band 38 (18), S. 4156–4158, doi:10.1021/ic990159g.
- D. M. Barnhart, C. J. Burns, N. N. Sauer, J. G. Watkin: Synthesis of Neutral and Anionic Uranyl Aryloxide Complexes from Uranyl Amide Precursors: X-ray Crystal Structures of UO2(O-2,6-i-Pr2C6H3)2(py)3 and [Na(THF)3]2[UO2(O-2,6-Me2C6H3)4], In: Inorganic Chemistry, 1995, Band 34 (16), S. 4079–4084, doi:10.1021/ic00120a011.
- A. Barkleit, H. Foerstendorf, B. Li, A. Rossberg, H. Moll, G. Bernhard: Coordination of uranium(VI) with functional groups of bacterial lipopolysaccharide studied by EXAFS and FT-IR spectroscopy, In: Dalton Transactions, 2011, Band 40, S. 9868–9876. (Abstract) (englisch)
- G. Nocton, P. Horeglad, V. Vetere, J. Pécaut, L. Dubois, P. Maldivi, N. M. Edelstein, M. Mazzanti: Synthesis, Structure, and Bonding of Stable Complexes of Pentavalent Uranyl, In: Journal of the American Chemical Society, 2010, Band 132 (2), S. 495–508, doi:10.1021/ja9037164.
- V. Mougel, L. Chatelain, J. Pécaut, R. Caciuffo, E. Colineau, J.-C. Griveau, M. Mazzanti: Uranium and manganese assembled in a wheel-shaped nanoscale single-molecule magnet with high spin-reversal barrier, In: Nature Chemistry, 2012, Band 4, S. 1011–1017. (Abstract) (englisch)
- J. D. Rinehart, J. Long: Exploiting single-ion anisotropy in the design of f-element single-molecule magnets, In: Chemical Science, 2011, Band 2, S. 2078–2085. (Abstract) (englisch)
- T. Reitz, A. Rossberg, A. Barkleit, R. Steudtner, S. Selenska-Pobell, M. L. Merroun: Spectroscopic study on uranyl carboxylate complexes formed at the surface layer of Sulfolobus acidocaldarius, In: Dalton Transactions, 2015, Band 44, S. 2684–2692. (Abstract) (englisch)
- R. Zobel, M. Beer: Electron stains: I. Chemical Studies on the Interaction of DNA with Uranyl Salts. In: The Journal of Biophysical and Biochemical Cytology, 1961, Band 10, S. 335–346. (Abstract) (englisch)
- Jander, Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie, 12. Auflage, S. Hirzel Verlag, Stuttgart 1983, S. 235.
- N. N. Greenwood, A. Earnshaw: Chemistry of the Elements (2. Ausgabe), Butterworth-Heinemann, 1997, ISBN 0-08-037941-9, S. 1273–1274.
- H. Irving: Synergic Effects in Solvent Extraction, In: Angewandte Chemie International Edition, 1965, Band 4 (1), S. 95–96, doi:10.1002/anie.196500951.
- Eintrag zu Uranverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. September 2016. (JavaScript erforderlich)
- D. P. Arfsten, K. R. Still, G. D. Ritchie: A review of the effects of uranium and depleted uranium exposure on reproduction and fetal development. In: Toxicology and Industrial Health. Band 17, 2001, S. 180–191, doi:10.1191/0748233701th111oa.
- H. Schröder, A. Heimers, R. Frentzel-Beyme, A. Schott, W. Hoffman: Chromosome Aberration Analysis in Peripheral Lymphocytes of Gulf War and Balkans War Veterans. In: Radiation Protection Dosimetry. Band 103, 2003, S. 211–219, PMID 12678382.
Literatur
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium. In: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements. Springer, Dordrecht 2006, ISBN 1-4020-3555-1, S. 253–698, doi:10.1007/1-4020-3598-5_5.


