Magnesiumacetat
Magnesiumacetat ist eine chemische Verbindung aus der Gruppe der Magnesiumverbindungen und Acetate. Es ist das Magnesiumsalz der Essigsäure mit der Konstitutionsformel Mg(CH3COO)2.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
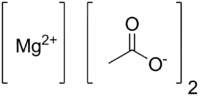 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Magnesiumacetat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H6MgO4 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer, hygroskopischer[2], geruchloser Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 142,39 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,45 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
> 135 °C (Zersetzung)[2] | |||||||||||||||||||||
| Löslichkeit |
sehr gut löslich in Wasser (1200 g·l−1 bei 15 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Magnesiumacetat kann durch Reaktion von Magnesium oder Magnesiumoxid mit Essigsäure hergestellt werden.
Eigenschaften
Magnesiumacetat liegt als weißer, geruchloser, hygroskopischer Feststoff vor. Bei Temperaturen über 135 °C zersetzt sich die Verbindung. Sie kommt auch als Tetrahydrat vor, welche in einer monoklinen Kristallstruktur analog zu Nickelacetat vorliegt. Die Raumgruppe ist P21/c (Nr. 14) und zwei Molekülen in einer Gruppe mit einer Kantenlänge von a = 475 pm, b = 1179 pm, c = 852 pm und β = 94°54'.[4]
Verwendung
Magnesiumacetat-Tetrahydrat wird bei der Herstellung anderer chemischer Verbindungen und zur Analyse verwendet.[3] In Kombination mit Calciumacetat (Calciummagnesiumacetat) wird es als Streusalz eingesetzt. Weiterhin kann es bei der Färbung von Textilien, als Katalysator bei der Polyester-Produktion, bei der Herstellung von Zigarettenpapier und beim Offset-Druck verwendet werden. Medizinisch reines Magnesiumacetat kann in Dialyselösungen verwendet werden.[5]
In der klinischen Chemie wird es zusammen mit Phosphorwolframsäure als Fällungsreagenz für ApoB-haltige Lipoproteine verwendet.[6]
Einzelnachweise
- Eintrag zu MAGNESIUM ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 2. Juli 2020.
- Eintrag zu Magnesiumacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Dezember 2019. (JavaScript erforderlich)
- Datenblatt Magnesiumacetat (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Jagdish Shankar, P. G. Khubchandani, V. M. Padmanabhan: The crystal structure of magnesium acetate-tetrahydrate Mg(CH3COO)2·4 H2O. In: Proceedings of the Indian Academy of Sciences - Section A. Band 45, Nr. 2, 1957, S. 117–123, doi:10.1007/BF03052789.
- Todd S. Ing, Mohamed A. Rahman, Carl M. Kjellstrand (Hrsg.): Dialysis: History, Development and Promise. World Scientific, Singapur 2012, ISBN 978-981-4289-75-7, S. 817 (eingeschränkte Vorschau in der Google-Buchsuche).
- Axel M. Gressner, Torsten Arndt (Hrsg.): Lexikon der Medizinischen Laboratoriumsdiagnostik. 2. Auflage. Springer, Berlin / Heidelberg 2013, ISBN 978-3-642-12921-6, S. 1074, doi:10.1007/978-3-642-12921-6.