Uranylnitrat
Uranylnitrat (UO2(NO3)2) ist ein wasserlösliches gelbes Uransalz. Es kann durch Umsetzung von Uransalzen mit Salpetersäure erhalten werden.


| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
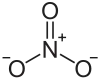  | ||||||||||
| Allgemeines | ||||||||||
| Name | Uranylnitrat | |||||||||
| Summenformel |
| |||||||||
| Kurzbeschreibung |
zitronengelber, gelbgrün fluoreszierender Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | ||||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
2,81 g·cm−3 (13 °C)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
gut in Wasser (550 g·l−1 bei 20 °C, Hexahydrat)[1] | |||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||

Radioaktiv | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Eigenschaften
Uranylnitrat löst sich sehr gut in Wasser, zudem in Ethanol, Aceton und Ether, jedoch nicht in Benzol, Toluol oder Chloroform. Die gelbgrünen Kristalle des Uranylnitrat-Hexahydrat sind tribolumineszent.[4] Bei höheren Temperaturen zersetzt es sich zu Urantrioxid (UO3).
Verwendung
Zusammen mit Uranylacetat findet Uranylnitrat Verwendung zur Negativkontrastierung in Elektronenmikroskopen.
Bei der Wiederaufarbeitung entsteht Uranylnitrat beim Auflösen des abgebrannten nuklearen Brennstoffs (zumeist UO2) bzw. von Yellowcake in Salpetersäure. Es wird dann in weiteren Schritten zu Uranhexafluorid umgesetzt, welches zur Isotopentrennung und zur Produktion von angereichertem Uran dient.
Sicherheitshinweise
Uranylnitrat ist eine oxidierende und giftige Verbindung. Außerdem besteht die Gefahr der Anreicherung im menschlichen Körper, was vor allem die Leber und die Nieren betrifft. Für Wasserorganismen ist es ebenfalls giftig und kann Langzeitschäden in der Wasserwelt verursachen. Wie alle Uranverbindungen ist es radioaktiv. Die Aktivität ist von der Isotopenzusammensetzung des Urans abhängig. Zudem wirkt sich Uranylnitrat brandfördernd aus und kann beim Erhitzen im Kontakt mit oxidierbaren Substanzen zu Explosionen führen.
Einzelnachweise
- Eintrag zu Uranylnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. Januar 2017. (JavaScript erforderlich)
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- D. E. Roberts, T. S. Modise: „Laser removal of loose Uran compound contamination from metal surfaces“, in: Applied Surface Science, 2007, 253, S. 5258–5267; doi:10.1016/j.apsusc.2006.11.050.
Literatur
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 253–698; doi:10.1007/1-4020-3598-5_5.


