Uranylhydroxid
Uranylhydroxid ist ein Hydroxid des Urans mit der chemischen Formel UO2(OH)2 in der monomeren und (UO2)2(OH)4 in der dimeren Form. Beide Isomere können im normalen wässrigen Medium existieren. Uranylhydroxidhydrat wird als ein gallertartiger Yellowcake aus oxidierten Uranlaugen bei etwa neutralem pH-Wert ausgefällt.
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
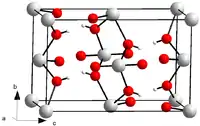 | |||||||||||||
| _ U6+ _ O2− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Uranylhydroxid | ||||||||||||
| Andere Namen |
Dihydroxidioxiuran | ||||||||||||
| Verhältnisformel | UO2(OH)2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 304,04 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt |
> 400 °C[2] | ||||||||||||
| Gefahren- und Sicherheitshinweise | |||||||||||||

Radioaktiv | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Eigenschaften
Uranylhydroxid leitet sich wie die Uranate von der hypothetischen Uransäure ab, die sowohl als Base wie auch als Säure reagieren kann. Als Base werden die Uranyl-Verbindungen und als Säure die Uranate gebildet. Letztere sind jedoch nicht stabil und wandeln sich in die Di-uranate (U2O72−) um. Die entsprechenden Reaktionsgleichungen sind wie folgt:[6]
Auf Grund dieser Reaktionen können Uranate und Uranylsalze leicht in die jeweils andere Form umgewandelt werden.
Modifikationen
Die Modifikationen wurden mit folgenden Eigenschaften beschrieben:[1]
| Modifikation | Farbe | Raumgruppe | Kristallsystem | Gitterkonstanten | Dichte /g·cm−3 | ||||
|---|---|---|---|---|---|---|---|---|---|
| a /Å | b /Å | c /Å | β /° | Z | |||||
| α‐UO2(OH)2 | grünlich gelb | Cmce[7] (Nr. 64) | Orthorhombisch | 4,242 | 10,302 | 6,868 | 4 | 6,73 | |
| β‐UO2(OH)2 | gelb-grün | Pbca (Nr. 61) | Orthorhombisch | 5,6438 | 6,2867 | 9,9372 | 4 | 5,73 | |
| γ‐UO2(OH)2 | grau chamois | P21/c (Nr. 14) | Monoklin | 6,419 | 5,518 | 5,561 | 112,77 | 2 | 5,56 |
| UO2(OH)2 · H2O | hellgelb | Pbna (Nr. 60, Stellung 5) | Orthorhombisch | 13,977 | 16,696 | 14,672 | 32 | 5 | |
Verwendung
Uranylhydroxid wurde früher in der Glas- und Keramikherstellung genutzt, um die Glasphasen einzufärben und Pigmente für das Hochtemperaturbrennen herzustellen. Durch Einleitung von alkalischen Diuranaten in Glas entsteht ein Gelbton im Glas und eine grüne Reflexion. Außerdem strahlt dieses Glas unter ultraviolettem Licht Kaltlicht ab und fluoresziert. Das Uranylhydroxid leitet Protonen, wenn es stetig stärker zusammengepresst wird und anschließend langsam wieder entspannt wird; und es findet Anwendung als Bauteil von Brennstoffzellen.[8]
Auswirkungen auf die Gesundheit
Uranylhydroxid schädigt das Erbgut, führt zu Fehlbildungen und ist radioaktiv; daher sollte es mit äußerster Vorsicht behandelt werden.
Einzelnachweise
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 253–698; doi:10.1007/1-4020-3598-5_5.
- Henry Enfield Roscoe: Ausführliches Lehrbuch der Chemie. Vieweg, 1879, S. 617 (books.google.com).
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Uranverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 37.–39. Auflage. Walter de Gruyter, Berlin 1956, S. 519.
- Die ehemalige Bezeichnung dieser Raumgruppe lautete Ccma.
- Patent US4179491A: Electrical device with separator as conductor for hydrogen cations. Angemeldet am 20. Januar 1978, veröffentlicht am 18. Dezember 1979, Anmelder: National Research Development Corp, Erfinder: Arthur T. Howe, Mark G. Shilton.
Literatur
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 253–698; doi:10.1007/1-4020-3598-5_5.
- C. A. Alexander: „Volatilization of urania under strongly oxidizing conditions“, in: Journal of Nuclear Materials, 2005, 346, S. 312–318; doi:10.1016/j.jnucmat.2005.07.013.


