Uranylchlorid
Uranylchlorid, (UO2)Cl2 ist eine instabile, hellgelbe chemische Verbindung des Urans. Es bildet große sandartige Kristalle.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Uranylchlorid | ||||||||||||||||||
| Andere Namen |
Dichlordioxyuran | ||||||||||||||||||
| Summenformel | (UO2)Cl2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 340,90 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Gefahren- und Sicherheitshinweise | |||||||||||||||||||

Radioaktiv | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Die Verbindung bildet sich, indem Chlorgas über rotglühendes Urandioxid geleitet wird[8]:
oder als kristallwasserhaltige Verbindung, wenn man Urantrioxid in Salzsäure löst und die Lösung anschließend im Vakuum bis zur Kristallisation einengt[3]:
Eine wässrige Lösung der Verbindung kann erhalten werden, indem man eine Lösung von Uranylsulfat mit einer Bariumchloridlösung behandelt und das ausfallende Bariumsulfat abtrennt[3]:
Eigenschaften
Das hygroskopische Uranylchlorid und seine beiden Hydrate ((UO2)Cl2 · H2O / (UO2)Cl2 · 3 H2O) zersetzen sich unter Lichteinwirkung, was 1804 von Adolph Ferdinand Gehlen festgestellt wurde. Diese Lichtempfindlichkeit erregte zeitweise wissenschaftliche Aufmerksamkeit und weckte zahlreiche erfolglose Bemühungen, die Salze für neue fotografische Anwendungen zu nutzen. Wie viele andere Uranverbindungen zeigt Uranylchlorid Fluoreszenz unter ultraviolettem Licht, verglichen mit anderen Uranylsalzen ist sie jedoch schwach.[2]
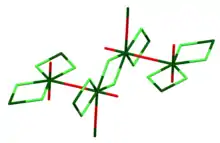
Kristallstruktur
Die Kristallstruktur von solvensfreiem Uranylchlorid wurde erstmals 1968 durch Debets bestimmt.[9] In der Kristallstruktur ist die Kation-Kation-Wechselwirkung ersichtlich, die charakteristisch für Uranylverbindungen ist. Eine Uranyleinheit koordiniert dabei in der äquatorialen Position ein Sauerstoffatom einer weiteren Uranyleinheit, sodass sich ein dreidimensionales Netzwerk ergibt. Die Chloratome verbrücken zwei benachbarte Uranyleinehiten zusätzlich in der äquatorialen Ebene.
Industrielle Bedeutung
Das Unternehmen Indian Rare Earths Limited (IREL) hat eine Möglichkeit entwickelt, Uran aus den östlichen und westlichen Küstendünen Indiens zu gewinnen. Nach der Vorbearbeitung mit starken Magnetabscheidern und dem Pulverisieren werden die mineralhaltigen Sande (Monazite) mit Natriumhydroxid und Wasser bei etwa 120 °C unter Druck aufgespalten. Die Hydroxidlösung wird anschließend mit konzentrierter Salzsäure versetzt, um die Hydroxide in eine gesättigte Lösung aus Uranchlorid und anderen Chloriden der Seltenerdmetalle (einschließlich Thorium) umzuwandeln. Danach wird aus der Lösung das Lösungsmittel extrahiert, wodurch Uranylchlorid und Thoriumoxalat entsteht. Die unreine Uranylchloridlösung wird nun durch Fällung und Extraktion der Fremdstoffe in Nitratlösung auf kerntechnische Reinheit veredelt.
Gesundheits- und Umweltgefahren
Uranylchlorid ist hochtoxisch beim Einatmen und Verschlucken. Außerdem besteht die Gefahr der Anreicherung im menschlichen Körper, was vor allem die Leber und die Nieren betrifft. Für Wasserorganismen ist es ebenfalls giftig und kann Langzeitschäden in der Wasserwelt verursachen. Wie alle Uranverbindungen ist es radioaktiv. Die Aktivität ist von der Isotopenzusammensetzung des Urans abhängig.
Weblinks
- Nuclear Chemistry (Memento vom 14. September 2008 im Internet Archive) (engl.)
Literatur
- Leonhard Ochs, Fritz Strassmann, Darstellung, Schmelzpunkt und spezif. Leitfähigkeit von UO2Cl2. Zeitschrift für Naturforschung, Band 7b, S. 637–639 (1952)
- T. K. Mukherjee: The Role of IREL in the Indian Nuclear Energy Programme. In: An International Journal of Nuclear Power. Band 18, Nr. 2-3, 2004, S. 81–83 (PDF).
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium. In: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements. Springer, Dordrecht 2006, ISBN 1-4020-3555-1, S. 253–698; doi:10.1007/1-4020-3598-5_5 (PDF).
Einzelnachweise
- N. Kumar, Dennis G. Tuck: The direct electrochemical synthesis of neutral and anionic halogen complexes of uranium(IV) and uranium(VI). In: Inorganica Chimica Acta. Band 95, Nr. 4, 1984, S. 211–215, doi:10.1016/S0020-1693(00)87469-1.
- B. S. Satyanarayana: The fluorescence of the uranyl compounds and the raman spectrum of the uranyl ion. In: Proceedings Mathematical Sciences. Band 15, Nr. 5, 1942, S. 414–416, doi:10.1007/BF03046037.
- Georg Brauer: Uranylchlorid. In: Handbuch der Präparativen Anorganischen Chemie. Ferdinand Enke Verlag, Stuttgart 1954, S. 1076.
- Afif M. Seyam: Observations on the reaction of uranium tetrachloride and dichlorodioxouranium(VI) with lithium alkyls. In: Inorganica Chimica Acta. Band 10, Nr. 2, 1985, S. 123–126, doi:10.1016/S0020-1693(00)84567-3.
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Uranverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- Joseph A. Leary and John F. Suttle: Uranyl chloride [Uranium(VI) Dioxydichloride]. In: Therald Moeller (Hrsg.): Inorganic Syntheses. Band 5. McGraw-Hill, Inc., 1957, S. 148–150 (englisch).
- P. C. Debets: The Structures of Uranyl Chloride and its Hydrates In: Acta Crystallographica, Section B24. 1968, S. 400.