Pikrinsäure
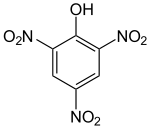
Pikrinsäure (altgriechisch πικρός pikrós ‚bitter‘) ist der Trivialname für 2,4,6-Trinitrophenol (TNP). Die Säure besteht aus einem Benzolring, an den eine Hydroxygruppe (–OH) und drei Nitrogruppen (–NO2) als Substituenten gebunden sind. Sie gehört damit zur Stoffgruppe der Trinitrophenole. Ihre Salze heißen Pikrate.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Pikrinsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H3N3O7 | |||||||||||||||||||||
| Kurzbeschreibung |
leuchtend gelbe blatt- oder prismaförmige Kristalle, die extrem bitter schmecken und beim raschen[2] Erhitzen verpuffen[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 229,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,76 g·cm−3[4] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
0,29[5] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 0,1 mg·m−3 (gemessen als einatembarer Staub)[11] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte

Durch Behandlung von Indigo mit Salpetersäure konnte Peter Woulfe als erster 1771 Pikrinsäure darstellen. Neben der Gelbfärbung von Seide hatte sie zunächst noch keine Bedeutung.[12]
Die Substanz war das erste detonierende, brisante Geschoss-Füllmittel und wurde als Lyddit, Ekrasit, Schimose oder Melinit ab 1886 so verwendet, nachdem der Franzose Eugène Turpin die Sprengstoffeigenschaft der Pikrinsäure entdeckt hatte.[12]
1864 verfasste der deutsche Arzt Wilhelm Erb eine Arbeit über Physiologische und therapeutische Wirkungen der Pikrin-Säure. 1865 habilitierte er sich auch mit einer Arbeit zu dieser Thematik.[13]
Bei der katastrophalen Halifax-Explosion im Jahre 1917 detonierten unter anderem 2300 Tonnen Pikrinsäure.[14]
Im ausgehenden 19. Jahrhundert wurde Pikrinsäure verbreitet zum Färben von Backwaren verwendet und war als Weltersches Bitter[1] bekannt. Dies wurde nach zahlreichen Vergiftungsfällen jedoch unterbunden.
Pikrinsäure wurde im Ersten und z. T. auch im Zweiten Weltkrieg als Sprengladung für Granaten verwendet.[15] Wegen der unkontrollierten Bildung von sehr stoßempfindlichen Schwermetallpikraten ersetzte man die Pikrinsäure durch TNT.
Darstellung und Gewinnung
Die Pikrinsäure wird über die Sulfonierung von Phenol zu Phenol-2,4-disulfonsäure und nachfolgende Behandlung mit Salpetersäure hergestellt.[12]
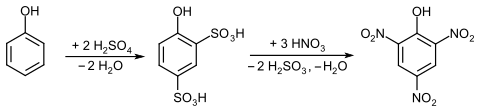
Alternativ bietet sich die Darstellung aus Chlorbenzol über 2,4-Dinitrochlorbenzol, 2,4-Dinitrophenol und dessen erneute Nitrierung an.[16] Eine direkte Herstellung der Substanz gelingt durch die Oxynitrierung von Benzol durch konzentrierte Salpetersäure in Gegenwart von Quecksilber(II)-nitrat.[12] Früher wurde Pikrinsäure auch aus Akaroidharz hergestellt.
Eigenschaften
Pikrinsäure bildet leuchtend gelbe, stark bitter schmeckende Kristalle. Sie ist nur schwer in kaltem Wasser löslich, besser löslich in siedendem Wasser und leicht löslich in Ethanol und Benzol. Bedingt durch die Häufung elektronenziehender Nitrogruppen (–NO2) reagiert die phenolische Hydroxygruppe der Pikrinsäure stark sauer (pKs = 0,29).
An der Luft verbrennt Pikrinsäure mit starker Rauchentwicklung; bei sehr raschem Erhitzen oder Initialzündung erfolgt Detonation. Pikrinsäure ist empfindlich gegen thermische (Hitze, Feuer) und mechanische (Schlag, Reibung) Belastung und gilt im Sinne des Sprengstoffgesetzes als explosionsgefährlicher Stoff. Für den Versand zur Verwendung als Laborchemikalie (siehe unten) wird die kristallisierte Säure durch Zugabe von etwa 30–50 % Wasser stabilisiert („phlegmatisiert“).
Tabelle mit wichtigen explosionsrelevanten Eigenschaften: Bildungsenergie −865,9 kJ·kg−1[17] Bildungsenthalpie −936,2 kJ·kg−1[17] Sauerstoffbilanz −45,4 %[17] Stickstoffgehalt 18,34 %[17] Normalgasvolumen 881 l·kg−1[17] Explosionswärme 3546 kJ·kg−1 (H2O (l))
3465 kJ·kg−1 (H2O (g))[17]Spezifische Energie 1033 kJ·kg−1 (105,3 mt/kg)[17] Bleiblockausbauchung 31,5 cm3·g−1[17] Detonationsgeschwindigkeit 7350 m·s−1 Stahlhülsentest Grenzdurchmesser 4 mm[17] Schlagempfindlichkeit 7,4 Nm[17] Reibempfindlichkeit bis 353 N keine Reaktion[17]
Pikrinsäure bildet mit zahlreichen anorganischen und organischen Basen Salze, die als Pikrate bezeichnet werden. Als starke Säure greift sie in wässriger Lösung zudem unedle Metalle unter Pikratbildung an. Einige der Salze z. B. Bleipikrat sind extrem empfindlich gegenüber Schlag, Reibung und Funken. Sie verhalten sich somit wie Initialsprengstoffe. Ammoniumpikrat wurde als Sprengstoff verwendet.
Ebenfalls als Pikrate bezeichnet werden die Charge-Transfer-Komplexe, die Pikrinsäure mit Aromaten bildet. Diese Feststoffe sind oft schwerlöslich und farbig. Wegen der charakteristischen und scharfen Schmelzpunkte (z. B. Benzol-Pikrat 84 °C,[5] Toluol-Pikrat 88 °C,[5] Anthracen-Pikrat 138 °C[5]) wurde Pikrinsäure vor allem früher als Nachweisreagenz zur Identifikation von Aromaten verwendet.
Pikrinsäure kristallisiert in der orthorhombischen Raumgruppe Pca21 mit a = 9,13 Å, b = 18,69 Å, c = 9,79 Å und α = β = γ = 90°.[18]
Pikrinsäure ist giftig. Auf der Haut kann sie starke allergische Reaktionen hervorrufen. Die Kontamination mit Stäuben und Dämpfen ist daher zu vermeiden.
Pikrinsäure wird in aller Regel mit mindestens 30 % Wasser phlegmatisiert gelagert und gilt dann nicht mehr als explosionsgefährlich, die GHS Kennzeichnung lautet dann wie folgt:
| Pikrinsäure mit > 30 % Wasser | |||
| GHS- Kennzeichnung |
| ||
| H-Sätze | 228‐302‐311+331[19] | ||
| P-Sätze | 210‐261‐280‐302+352+312‐304+340+311‐403+233[19] | ||
Verwendung
Primär dient die Pikrinsäure der Farbstoffindustrie zur Herstellung von 2-Amino-4,6-dinitrophenol (Pikraminsäure). Sie wurde früher zusammen mit Gummi arabicum und destilliertem Wasser zur Herstellung gelber Tinte verwendet. Ein weiteres Einsatzgebiet ist die organische Analytik zum Nachweis von Aminen, Alkaloiden und Kreatinin. Diese basischen Stoffe bilden gelbe Salze, welche durch ihren Schmelzpunkt charakterisiert wurden (Derivat-Bildung).
In der Histologie wird Pikrinsäure in dem Fixiergemisch nach Bouin (Bouinsche Lösung) verwendet.
In der Mikroskopie verwendet man Pikrinsäure als Bestandteil von Fixierflüssigkeiten (zur Konservierung zellulärer Strukturen) und zum Anfärben von Präparaten. Ein weiteres Einsatzgebiet von Pikrinsäure ist die Metallografie. Hier wird die Substanz zum Ätzen metallischer Oberflächen verwendet, z. B. bei der Präparation von Magnesiumlegierungen oder bei Seigerungsuntersuchungen an Stählen. Die Ätzung der Stähle wird mit Igeweskys-Reagenz, einer fünfprozentigen Lösung von Pikrinsäure in wasserfreiem Alkohol, durchgeführt. Pikrinsäure dient auch der Kreatinin-Konzentrationsmessung: Kreatinin bildet in alkalischer Lösung mit Pikrinsäure einen Meisenheimer-Komplex (Jaffé-Reaktion), dessen rote Farbe photometrisch gemessen wird.
Amine bilden mit Pikrinsäure Salze, die einen scharfen, charakteristischen Schmelzpunkt haben. Früher (und heute noch in der Chemieausbildung) wurden Amine so nachgewiesen und identifiziert.
Pikrinsäure bildet mit Cyanwasserstoff (HCN) rotes Isopurpurat. Durch photometrische Messung des resultierenden Farbstoffs kann Pikrinsäure zur Quantifizierung von Cyanwasserstoff verwendet werden.[20]
Rechtliches
Pikrinsäure ist im Sinne des deutschen Sprengstoffgesetzes als explosionsgefährlicher Stoff der Stoffgruppe A (trocken) bzw. C (mit 25 % Wasser angefeuchtet) gemäß § 1 Abs. 3 Sprengstoffgesetz eingestuft.[21] Für Privatpersonen ist trockene Pikrinsäure somit nach § 27 SprengG erlaubnispflichtig. Trocken ist Pikrinsäure in Lagergruppe 1.1 oder I bzw. als Gefahrgut in Klasse 1.1 (Stoffe, die massenexplosionsfähig sind) eingestuft,[4] angefeuchtet mit 30 % Wasser in Lagergruppe 1.4.[22]
Als handelsübliches Produkt ist Pikrinsäure mit > 30 % Wasser angefeuchtet und damit phlegmatisiert.[4] Angefeuchtet (> 30 % Wasser) verhält sich Pikrinsäure wie ein entzündlicher Feststoff und wird zum Transport als Entzündbarer fester Stoff der Gefahrgutklasse 4.1 nach ADR gekennzeichnet.[23]
Literatur
- Louis F. Fieser, Mary Fieser: Lehrbuch der Organischen Chemie. übersetzt und bearbeitet von Hans R. Hensel. Verlag Chemie, Weinheim 1954, S. 663–665.
Weblinks
Einzelnachweise
- Weltersches Bitter. In: Brockhaus' Kleines Konversations-Lexikon. 5. Auflage. Band 2, Leipzig 1911, S. 970.
- D`Ans, Ellen Lax, Taschenbuch für Chemiker und Physiker, Band II, Springer-Verlag 1964.
- A. Bernthsen: Kurzes Lehrbuch der organischen Chemie. Friedr. Vieweg & Sohn, Braunschweig 1914.
- Eintrag zu Pikrinsäure, angefeuchtet mit mindestens 30 Masse% Wasser in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- CRC Handbook of Tables for Organic Compound Identification. 3. Auflage. 1984, ISBN 0-8493-0303-6.
- A. Koffler; M. Brandstätter: Zur isomorphen Vertretbarkeit von H, OH, Cl: s-Trinitrobenzol, Pikrinsäure, Pikrylchlorid. In: Monatshefte Chem. 78, 1948, S. 65–70. doi:10.1007/BF00942489.
- Henry Watts: A Dictionary of Chemistry and the Allied Branches of Other Sciences ... Longmans, 1883, S. 402 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Picric acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Pikrinsäure, trocken oder mit weniger als 30 % Wasser angefeuchtet in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. Januar 2021. (JavaScript erforderlich)
- Datenblatt Picric acid bei Sigma-Aldrich, abgerufen am 11. Mai 2011 (PDF).
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 88-89-1 bzw. Pikrinsäure), abgerufen am 2. November 2015.
- Eintrag zu Pikrinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- W. Erb: Die physiologischen und therapeutischen Wirkungen der Pikrinsäure. In: Archiv Pharm. 181, 1867, S. 123–124. doi:10.1002/ardp.18671810180
- Jay White: Exploding Myths: The Halifax Explosion in Historical Context. In: Alan Ruffman, Colin D. Howell (Hrsg.): Ground Zero: A Reassessment of the 1917 explosion in Halifax. Nimbus Publishing, 1994, ISBN 1-55109-095-3, S. 266.
- Arbeitshilfe für die Untersuchung von Sprengplätzen, PDF-Datei auf www.lfu.bayern.de
- Hans Beyer, Wolfgang Walter: Organische Chemie. 22. Auflage. S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0485-2, S. 504–505.
- J. Köhler, R. Meyer, A. Homburg: Explosivstoffe. 10., vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7, S. 234.
- V. Bertolasi, P. Gilli, G. Gilli: Hydrogen Bonding and Electron Donor-Acceptor (EDA) Interactions Controlling the Crystal Packing of Picric Acid and Its Adducts with Nitrogen Bases. Their Rationalization in Terms of the pKa Equalization and Electron-Pair Saturation Concepts. In: Cryst. Growth Des. 2011, 11, 2724–2735, doi:10.1021/cg101007a.
- Eintrag zu Pikrinsäure, angefeuchtet mit mindestens 30 Masse% Wasser in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. Januar 2021. (JavaScript erforderlich)
- Quantification Of Total Cyanide Content In Kernels Of Stone Fruits. In: lernvorsprung.at. Abgerufen am 6. Januar 2021.
- Altstoffliste im Bundesanzeiger Nr. 233 a vom 16. Dezember 1986 nebst Berichtigung BAnz. Nr. 51, S. 2635 vom 14. März 1987.
- Bundesanstalt für Materialprüfung, Lagergruppenzuordnung von anderen explosiven Stoffen, Berlin.
- Hommel: Handbuch der gefährlichen Güter. Springer-Verlag.


