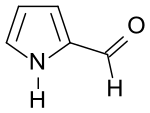
Pyrrol-2-carboxaldehyd
Pyrrol-2-carboxaldehyd ist eine heterocyclische Verbindung aus der Klasse der Pyrrole, die eine Formylgruppe in 2-Stellung trägt. 2-Formylpyrrol ist Ausgangsverbindung für anellierte bicyclische Stickstoff-Heterocyclen, sowie für Polypyrrole, wie z. B. Porphyrine und für 2,2‘-Dipyrromethen, dem Grundgerüst für BODIPY-Fluoreszenzfarbstoffe.[5]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pyrrol-2-carboxaldehyd | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H5NO | ||||||||||||||||||
| Kurzbeschreibung |
hellgelber kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 95,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,3215 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, löslich in Chloroform, Dimethylsulfoxid und Methanol[4] | ||||||||||||||||||
| Brechungsindex |
1,5939 (25 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Pyrrol-2-aldehyd wird in der Natur in Mandeln, Tee, Kaffee und Hülsenfrüchten gefunden.[6]
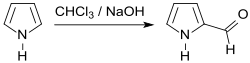
Die chemische Synthese von Pyrrol-2-carboxaldehyd (als α-Pyrrolaldehyd bezeichnet) wurde im Jahr 1900 von Eugen Bamberger beschrieben, der in einer Reimer-Tiemann-Reaktion 2-Formylpyrrol in geringer Ausbeute erhielt.[7]
Wesentlich effizienter ist die Vilsmeier-Haack-Reaktion mit Phosphoroxychlorid (POCl3) und Dimethylformamid DMF in 1,2-Dichlorethan.[3]
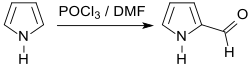
Nach Umkristallisation aus Petrolether wird dabei Pyrrol-2-aldehyd in 78 bis 79 % Reinausbeute erhalten.
Eigenschaften
Pyrrol-2-carboxaldehyd ist ein hellgelber kristalliner Feststoff, der sich praktisch nicht in Wasser löst. Die Verbindung ist löslich in Chloroform, Dimethylsulfoxid und Methanol.[4]
Anwendungen
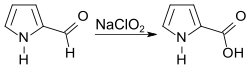
Pyrrol-2-carbaldehyd lässt sich einfach und schonend mit Natriumchlorit (NaClO2) in einem Acetonitril/Wasser-Gemisch zu Pyrrol-2-carbonsäure oxidieren.[8]
In einer Stobbe-Kondensation wird Pyrrol-2-aldehyd mit Bernsteinsäuredimethylester in Gegenwart von starken Basen zum entsprechenden α, β-ungesättigten Ester umgesetzt, der mit Acetanhydrid/Natriumacetat ein Gemisch von Indolen (I) und Indolizinen (II) erzeugt.[9]
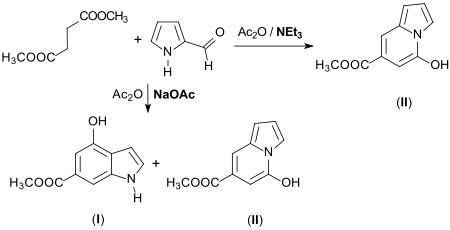
Cyclisierung mit Acetanhydrid/Triethylamin liefert Indolizine (II) in guten Ausbeuten.
Mit 2-Acetylpyridin und wässrigem Ammoniak reagiert Pyrrol-2-carboxaldehyd zu einem pyrrol-funktionalisierten Terpyridin, das am Stickstoff des Pyrrolrings alkyliert werden kann.[10]
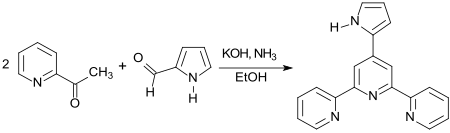
Die (u. a. am N-Atom des Pyrrolrings substituierten) Terpyridine bilden Komplexe, z. B. mit Actinoiden und wurden als Katalysatoren und als Sensibilisatoren in Solarzellen untersucht.
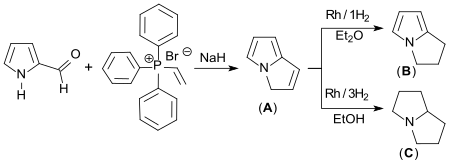
Bei der Reaktion von Pyrrol-2-carboxaldehyd mit Vinyltriphenylphosphoniumbromid[11] in Gegenwart von Natriumhydrid entsteht Pyrrolizin (A) (CAS-Nr. 251-59-2) (Ausbeute 87 %). Katalytische Hydrierung mit Rhodium Rh in Diethylether liefert 2,3-Dihydro-1H-pyrrolizin (B) (CAS-Nr. 13618-87-6) mit 81 % Ausbeute. Bei vollständiger Hydrierung mit Rh entsteht Pyrrolizidin (C) (CAS-Nr. 643-20-9) mit 83 % Ausbeute.[12]
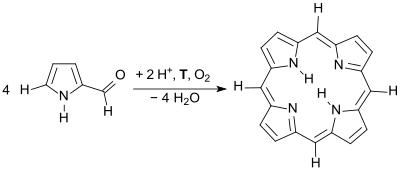
Das nach der Hückel-Regel aromatische cyclische Tetrapyrrol Porphin – das Grundgerüst der Porphyrine – wurde erstmals von Hans Fischer beim 36-stündigen Kochen von α-Formylpyrrol mit Ameisensäure in schlechter Ausbeute erhalten.[13]
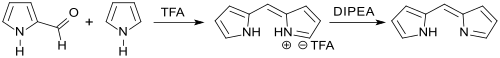
Mit Pyrrol reagiert Pyrrol-2-carboxaldehyd in Gegenwart von Trifluoressigsäure zu protoniertem 2,2'-Dipyrromethen, aus dem mit Diisopropylethylamin (DIPEA, Hünig-Base) das freie, aber oberhalb – 40 °C instabile Dipyrromethen erhalten wird.[5]
Aus 2,2‘-Dipyrromethen bzw. seinen stabileren Salzen, wie z. B. seinem Hydrochlorid, und Bortrifluoriddiethyletherat (BF3·OEt2) in Gegenwart von Triethylamin oder Diazabicycloundecen (DBU) entsteht (in 8 % Reinausbeute) das substituentenfreie Grundgerüst der so genannten BODIPY-Fluoreszenzfarbstoffe (von engl. boron-dipyrromethene),
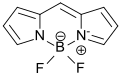
die wegen ihrer optoelektronischen Eigenschaften als biologische Marker oder in Sensoren von Interesse sind.[14]
Einzelnachweise
- Datenblatt Pyrrole-2-carboxaldehyde bei Sigma-Aldrich, abgerufen am 25. Mai 2021 (PDF).
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 65.
- R.M. Silverstein, E.E. Ryskiewicz, C. Willard: 2-Pyrrolealdehyde In: Organic Syntheses. 36, 1956, S. 74, doi:10.15227/orgsyn.036.0074; Coll. Vol. 4, 1963, S. 831 (PDF).
- Datenblatt Pyrrole-2-carboxaldehyde, 99% bei AlfaAesar, abgerufen am 25. Mai 2021 (PDF) (JavaScript erforderlich).
- A. Schmitt, B. Hinkeldey, M. Wild, G. Jung: Synthesis of the Core Compound of the BODIPY Dye Class: 4,4′-Difluoro-4-bora-(3a,4a)-diaza-s-indacene. In: J. Fluoresc. Band 19, 2009, S. 755–758, doi:10.1007/s10895-008-0446-7.
- Fernando Aguilar et al.: Pyridine, pyrrole, indole and quinoline derivatives from chemical group 28 Flavouring Group Evaluation 24, Revision 1 - Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Materials in contact with Food (AFC). In: EFSA Journal. Band 792, 2008, S. 1–63, doi:10.2903/j.efsa.2008.792.
- E. Bamberger, G. Djierdjian: Ueber den Pyrrolaldehyd. In: Ber. Dtsch. Chem. Ges. Band 33, Nr. 1, 1900, S. 536–542, doi:10.1002/cber.19000330185.
- B.R. Babu, K.K. Balasubramaniam: Simple and facile oxidation of aldehydes to carboxylic acids. In: Org. Prep. Proced. Int. Band 26, Nr. 1, 1994, S. 123–125, doi:10.1080/0030494940948021.
- M. Kim, E. Vedejs: A reinvestigation of 4-hydroxyindole-6-carboxylate synthesis from pyrrole-2-carboxaldehyde: A facile synthesis of indoles and indolizines. In: J. Org. Chem. Band 69, Nr. 20, 2004, S. 6945–6948, doi:10.1021/jo040191e.
- J. Husson, L. Guyard: Synthesis of new 4‘-(N-alkylpyrrol-2-yl)-2,2‘:6‘,2‘‘-terpyridines via N-alkylation of a pyrrole moiety. In: Heterocycl. Commun. Band 21, Nr. 4, 2015, S. 199–202, doi:10.1515/hc-2015-0058.
- E.E. Schweizer, R.D. Bach: Vinyl triphenylphosphonium bromide In: Organic Syntheses. 48, 1968, S. 129, doi:10.15227/orgsyn.048.0129; Coll. Vol. 5, 1973, S. 1145 (PDF).
- E.E. Schweizer, K.K. Light: Reactions of phosphorus compounds. IV. Preparation of 3H-pyrrolizine, 1,2-dihydro-3-H-pyrrolizine, and pyrrolizidine. In: J. Amer. Chem. Soc. Band 86, Nr. 14, 1964, S. 2963, doi:10.1021/ja01068a059.
- H. Fischer, W. Gleim: Synthese des Porphins. In: Liebigs Ann. Chem. Band 521, Nr. 1, 1936, S. 157–160, doi:10.1002/jlac.19365210110.
- A. Loudet, K. Burgess: BODIPY dyes and their derivatives: Syntheses and spectroscopic properties. In: Chem. Rev. Band 107, Nr. 11, 2007, S. 4891–4932, doi:10.1021/cr078381n.
