Terpyridin
Terpyridin ist eine heterocyclische chemische Verbindung mit der Summenformel C15H11N3. Sie besteht aus drei Pyridinringen, welche jeweils in den 2-Positionen beziehungsweise 2,6-Positionen miteinander verknüpft sind.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
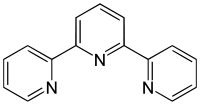 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Terpyridin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C15H11N3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 233,37 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
370 °C[1] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Synthese
Terpyridin wurde erstmals 1932 durch oxidative Kupplung von Pyridin in Gegenwart von Eisen(III)-chlorid bei 340 °C im Autoklaven erhalten. Es entsteht ein Produktgemisch aus verschiedenen Pyridinderivaten, Bipyridinen und Quaterpyridin, welches auch Terpyridin enthält.[1] Durch Reaktion von 2-Brompyridin mit 2,6-Dibrompyridin mit Kupfer im Sinne einer Ullmann-Kupplung kann Terpyridin mit höherer Selektivität hergestellt werden.[4]
Es ist eine Reihe neuerer Synthesewege bekannt, welche oftmals auf Palladium-katalysierten Kupplungsreaktionen beruhen (Hiyama-Kupplung[5], Stille-Kupplung[5], Negishi-Kupplung[6]).
Eigenschaften
Terpyridin ist ein Chelatligand, welcher mit vielen Übergangsmetallen Komplexe der Form [M(Terpy)2]n+ bildet.
Im Rahmen der sicheren Endlagerung radioaktiven Abfalls werden derzeit Verfahren zur Auftrennung (Partitioning) des nuklearen Materials in Elementgruppen untersucht. Hierbei ist die Trennung der chemisch ähnlichen minoren Actinoide und Lanthanoide nötig. Terpyridin war hierzu der erste Ligand, welcher diese Trennung, wenn auch mit einem moderaten Trennfaktor von 7, zu bewerkstelligen vermochte.[7][8] Mittlerweile existieren zu diesem Zweck jedoch deutlich selektivere Extraktionsmittel.[9][10]
Einzelnachweise
- G. T. Morgan, F. H. Burstall: Dehydrogenation of pyridine by anhydrous ferric chloride, in: J. Chem. Soc. 1932, 20–30; doi:10.1039/JR9320000020.
- Datenblatt Terpyridin bei AlfaAesar, abgerufen am 17. April 2010 (PDF) (JavaScript erforderlich).
- Datenblatt 2,2′:6′,2′′-Terpyridine bei Sigma-Aldrich, abgerufen am 10. November 2021 (PDF).
- F. H. Burstall: Researches on the polypyridyls, in: J. Chem. Soc. 1938, 1662–1672; doi:10.1039/JR9380001662.
- Y. Yamamoto, T. Tanaka, M. Yagi, M. Inamoto, in: Heterocycles 1996, 42, 189–194.
- F.-Q. Fang, G. S. Hanan, Rapid and Efficient Synthesis of Functionalized Bipyridines , in: Synlett 2003, 6, 852–854.
- C. Madic, M. J. Hudson High Level liquid Waste Partitioning by Means of completely incinerable Extractants. Final Report, European Commission Contract No. FI2W-CT91-0112, EUR 18038, 1999.
- C. Ekberg, A. Fermvik, T. Retegan, G. Skarnemark, M. R. S. Foreman, M. J. Hudson, S. Englund, M. Nilson, Radiochim. Acta 2008, 96, 225–233.
- Z. Kolarik, U. Müllich, F. Gassner, in: Solvent Extr. Ion Exch. 1999, 17, 23–32.
- S. Trumm, G. Lieser, M. R. S. J. Foreman, P. J. Panak, A. Geist, Th. Fanghänel, A TRLFS study on the complexation of Cm(III) and Eu(III) with 4-t-butyl-6,6-bis-(5,6-diethyl-1,2,4-triazin-3-yl)-2,2-bipyridine in a water/2-propanol mixture, in: Dalton Trans. 2010, 39, 923–929; doi:10.1039/b919247f.

