Stobbe-Kondensation
Die Stobbe-Kondensation, auch Bernsteinsäureester-Kondensation genannt, ist eine Namensreaktion der organischen Chemie. Hans Stobbe hat diese Synthese 1893 entdeckt.[1] Es handelt sich um einen Spezialfall der Kondensation von Estern mit Aldehyden oder Ketonen in Gegenwart einer starken Base.[2]
Übersichtsreaktion
Bei der Stobbe-Kondensation werden Bernsteinsäurediester oder ihre Derivate in einer primären Aldolkondensation über das α-Kohlenstoff-Atom als nucleophiles Zentrum an die Carbonylgruppe des Aldehyds oder Ketons gebunden.
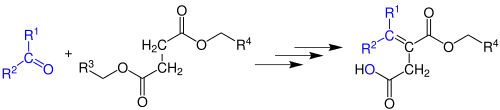
Die Reste R1 und R2 können aliphatisch oder aromatisch sein. Außerdem läuft die Reaktion mit α, β-ungesättigten Aldehyden oder Ketonen, Diketonen sowie Cyanoketonen ab. Die Reste R3 und R4 können Aryl-, Allyl- oder Alkylidengruppen sein.
Eine Besonderheit dieser Reaktion ist, dass auch sterisch gehinderte Ketone reagieren können.
Mechanismus
Der Reaktionsmechanismus der Stobbe-Kondensation könnte wie folgt aussehen.[2] Im folgenden Beispiel ist der einfachste Aldehyd, Formaldehyd, als Reaktionspartner gewählt und ein aliphatisch substituierter Bernsteinsäureester:

Zunächst wird der Bernsteinsäurediethylester (1) von der Base deprotoniert, dabei entsteht ein Carbanion 2. Dieses addiert sich nucleophil an die Carbonylkomponente 3. Das entstandene Sauerstoff-Anion greift dann nucleophil an das benachbarte Kohlenstoff-Atom an. Es entsteht ein cyclisches Molekül 4. Daraufhin wird ein Ethanolation abgespalten und der Lactonring wird geöffnet 5. Die Ringöffnung läuft basenkatalytisch ab. Danach wird das Zwischenprodukt protoniert und es entsteht der α,β-ungesättigte Ester 6.
Anwendung
Die Kondensation findet eine Anwendung bei dem Ersatz der Carbonylgruppe von aromatischen Ketonen durch einen Propionsäurerest. Außerdem können mit dieser Kondensation in Kombination mit der Friedel-Crafts-Reaktion Naphthole, Indone und Tetralone hergestellt werden. Es können auch γ-Ketosäuren synthetisiert werden.[2] Außerdem werden durch die fast irreversible Ringöffnung hohe Ausbeuten erzielt. Zusätzlich kann die Kohlenstoff-Kette um drei Kohlenstoff-Atome gleichzeitig verlängert werden, im Vergleich zur Knoevenagel-Reaktion bei der nur zwei Kohlenstoff-Atome zugefügt werden.[2][3]
Literatur
Einzelnachweise
- H. A. Stobbe: Eine neue Synthese der Teraconsäure. In: Berichte der deutschen chemischen Gesellschaft. Band 26. Weinheim 1893, S. 2312–2319, doi:10.1002/CBER.18930260306.
- W. Uhl, A. Kyritsoulis: Namen- und Schlagwortreaktionen in der Organischen Chemie. Friedr. Vieweg & Sohn Verlag, Braunschweig 1984, ISBN 3-528-03581-1, S. 143–144.
- Louis F. Fieser, Mary Fieser: Lehrbuch der Organischen Chemie. Chemie, Weinheim 1957, S. 805.