Aspartat-Transcarbamoylase
Aspartat-Transcarbamoylase (kurz ATCase) ist ein allosterisch reguliertes Enzym, das den ersten Schritt der Pyrimidinnucleotidbiosynthese katalysiert.[1] Am besten untersucht ist die aus E. coli stammende Aspartat-Transcarbamoylase. In tierischen Zellen ist ATCase Teil des Proteinkomplexes CAD und weist strukturelle Unterschiede zur prokaryotischen ATCase auf.[2]
| Aspartat-Transcarbamoylase | ||
|---|---|---|
| ||
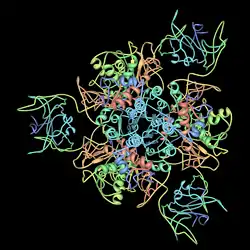
| Aspartat-Transcarbamoylase aus E. coli. | ||
| Andere Namen |
Aspartat-Carbamoyltransferase | |
| Enzymklassifikation | ||
| EC, Kategorie | 2.1.3.2 | |
| Substrat | L-Aspartat + Carbamoylphosphat | |
| Produkte | N-Carbamoyl-L-Aspartat | |
Struktur
Die aus E. coli stammende ATCase ist ein Dodecamer aus sechs katalytischen und sechs regulatorischen Untereinheiten. Die katalytischen Untereinheiten sind in zwei Trimeren organisiert, während die regulatorischen Untereinheiten in Form dreier Dimere vorliegen. Jede katalytische Untereinheit besitzt zwei katalytische Domänen.[1]
Die sechs kleineren regulatorischen Untereinheiten (je 17 kDa) bilden einen "äquatorialen Gürtel" um die sechs größeren katalytischen Untereinheiten (je 34 kDa). Die Gesamtmasse des Proteins beträgt ca. 310 kDa.[4]
Jede regulatorische Untereinheit ist über eine zinkhaltige Strukturdomäne mit einem katalytischen Trimer verbunden. Das in den Strukturdomänen enthaltene Zinkion ist an je vier Cysteinresten gebunden. Durch Quecksilberverbindungen wie p-Hydroxyquecksilberbenzoat kann das Enzym in katalytische und regulatorische Untereinheiten aufgetrennt werden. Quecksilberverbindungen destabilisieren die Strukturdomäne, indem sie mit den Cysteinresten reagieren und das Zinkion durch ein Quecksilberion ersetzen. Die dissoziierten Untereinheiten finden selbständig wieder in die native Quartärstruktur zurück.[1]
Katalysierte Reaktion
Im ersten Schritt der Pyrimidinnucleotidbiosynthese werden die Substrate L-Aspartat und Carbamoylphosphat in die Pyrimidinvorstufe N-Carbamoyl-L-Aspartat umgesetzt. ATCase katalysiert dabei die Übertragung der Carbamoylgruppe (blau) des Carbamoylphosphats auf das Aspartat und gehört somit zur Enzymklasse der Transferasen.[5]

N-Carbamoylaspartat wird anschließend über weitere Syntheseschritte in Pyrimidinnucleotide umgewandelt.
Enzymregulation
Die Bindung von Substraten oder allosterischen Modulatoren nimmt Einfluss auf die Affinität anderer katalytischer oder allosterischer Zentren. Somit weist ATCase kooperatives Verhalten auf. Die Enzymaktivität wird sowohl durch die Substrate selbst (homotrop) als auch durch allosterische Modulatoren (heterotrop) beeinflusst.
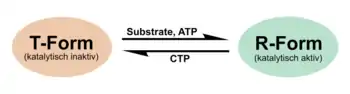
Basierend auf dem "Alles-oder-nichts-Prinzip" kann ATCase in zwei quartären Konformationen vorliegen, die sich in ihrer katalytischen Aktivität unterscheiden: dem hochaffinen R-Zustand und dem niedrigaffinen T-Zustand. Beide Quartärstrukturen liegen in einem Gleichgewicht vor, das je nach wirkenden Regulationsmechanismen in Richtung eines Konformationszustandes verschoben werden kann.
Die Substrate Aspartat und Carbamoylphosphat üben einen positiv homotropen Effekt aus. Durch die Substratbindung wird ATCase in den katalytisch aktiven R-Zustand überführt, wodurch die Bindung weiterer Substratmoleküle begünstigt wird. An der heterotropen Regulation sind die Nucleotide Adenosintriphosphat (ATP) und Cytidintriphosphat (CTP) beteiligt, die um allosterischen Zentren auf den regulatorischen Untereinheiten konkurrieren. CTP, ein Endprodukt der Pyrimidinnucleotidbiosynthese, hemmt die katalytische Aktivität der ATCase, indem es das Gleichgewicht der Konformationszustände in Richtung der T-Form verschiebt. Eine gegensätzliche Wirkung vermittelt der allosterische Aktivator ATP, welcher eine Verschiebung des Gleichgewichts zu Gunsten der katalytisch aktiven R-Form bewirkt.
Die allosterische Regulation hat zum Ziel, die Konzentration an Pyrimidin- und Purinnucleotiden aneinander anzugleichen, damit sie für die DNA-Synthese in äquimolaren Mengen zur Verfügung stehen. Überwiegt die Menge an Pyrimidnnucleotiden, so wird die Biosynthese weiterer Pyrimidnnucleotide durch Cytidintriphosphat gehemmt (Endprodukthemmung). Liegen Purinnucleotide in erhöhter Konzentration vor, so wird die Pyrimidinnucleotidbiosynthese durch den allosterischen Aktivator ATP begünstigt. Zusätzlich gewährleistet der durch ATP ausgeübte allosterische Effekt, dass die aufwändige Synthese von Pyrimidinnucleotid-Vorstufen nur stattfindet, wenn der Zelle ausreichend Energie in Form von ATP bereitsteht.[1]
ATCase gleicht somit einem "molekularen Chip", der neben dem Energiestatus der Zelle auch die Konzentration an Pyrimidin- und Purinnucleotiden erfasst und danach die Synthese von Pyrimidinnucleotid-Vorstufen ausrichtet.[3]
Enzymkinetik
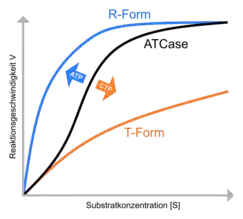
Aufgrund der homotropen Kooperativität kann ATCase in zwei Konformationen unterschiedlicher katalytischer Aktivität vorliegen. Daher verhält sich das Enzym nicht nach der Michaelis-Menten-Kinetik, sondern weist einen sigmoiden Kurvenverlauf auf.
Die sigmoide Kinetik kann als Überlagerung der Michaelis-Menten-Kurve beider Konformationszustände aufgefasst werden. Mit ansteigender Substratkonzentration verschiebt sich das Gleichgewicht von der T- zur R-Form. Daher gleicht die Reaktionskinetik der ATCase anfangs dem des T-Zustandes und nähert sich bei einem weiteren Anstieg der Substratkonzentration dem Kurvenverlauf der R-Form an.
Allosterische Modulatoren bewirken eine seitliche Verschiebung der Kurve. CTP inhibiert die katalytischen ATCase-Aktivität, weshalb der Kurvenverlauf nach rechts verschoben wird und sich der Reaktionskinetik der T-Form annähert. Der allosterische Aktivator ATP hingegen bewirkt eine Verschiebung nach links und damit eine Annäherung an die Michaelis-Menten-Kurve der R-Form.[1]
Literatur
- Lubert Stryer: Biochemie. 7. Auflage. Springer-Verlag, Berlin Heidelberg 2013, ISBN 978-3-8274-2988-9.
- Werner Müller-Esterl: Biochemie. 3. Auflage. Springer Spektrum, Berlin, Heidelberg 2018, ISBN 978-3-662-54850-9.
Einzelnachweise
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 7. Auflage. Springer-Verlag, Berlin Heidelberg 2013, ISBN 978-3-8274-2988-9, S. 293–299.
- J. P. Simmer, R. E. Kelly, J. L. Scully, D. R. Grayson, A. G. Rinker: Mammalian aspartate transcarbamylase (ATCase): sequence of the ATCase domain and interdomain linker in the CAD multifunctional polypeptide and properties of the isolated domain. Juni 1989, ISSN 0027-8424, doi:10.1073/pnas.86.12.4382, PMID 2543974 (nih.gov [abgerufen am 20. August 2021]).
- Werner Müller-Esterl: Biochemie. 3. Auflage. Springer-Verlag, Berlin Heidelberg 2018, ISBN 978-3-662-54850-9, S. 166–167.
- Aspartate Carbamoyltransferase - an overview | ScienceDirect Topics. Abgerufen am 10. August 2021.
- Birgit Weinhold: Aspartat-Transcarbamoylase. In: https://roempp.thieme.de. 2006, abgerufen am 20. August 2021.