Prileschajew-Reaktion
Die Prileschajew-Reaktion (auch Prilezhaev-Reaktion oder Prilezhaev-Epoxidierung) ist eine Namensreaktion aus dem Bereich der Organischen Chemie. Die Reaktion wurde von dem russischen Chemiker Nikolai Alexandrowitsch Prileschajew (1877–1944) im Jahre 1909 entdeckt.
Bei der Prileschajew-Reaktion werden Alkene mit Peroxycarbonsäuren (RCO3H) zu den entsprechenden Epoxiden (Oxiranen) umgesetzt, wobei ebenfalls die zugehörige Carbonsäure (RCO2H) entsteht.
Übersichtsreaktion
Alkene werden mit Peroxycarbonsäuren zu den entsprechenden Epoxiden (Oxiranen) umgesetzt, wobei formal das Peroxysauerstoffatom auf die Doppelbindung des Alkens übertragen wird.
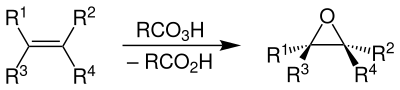
Oftmals wird hierzu im Labor meta-Chlorperbenzoesäure (m-CPBA) eingesetzt, da diese Verbindung im Vergleich zu anderen Persäuren relativ stabil ist und mit den meisten organischen Lösungsmitteln gut mischbar ist. Andere Persäuren wie Peroxyessigsäure oder Peroxyameisensäure sind so instabil, dass sie in situ hergestellt werden müssen. Hierzu wird meist im Lösungsmittel Essigsäure gearbeitet und Peroxyessigsäure durch Zugabe von Wasserstoffperoxid erhalten. Die Methode wird häufig in der Technik als atomökonomischere Variante angewandt.
Reaktionsmechanismus
Das Peroxysauerstoffatom einer Peroxycarbonsäure (2) ist partiell positiv geladen und fungiert somit als elektrophiles Zentrum, welches von der π-Bindung des Alkens (1) angegriffen werden kann. Dieser Schritt funktioniert besonders gut und schnell, wenn die Elektronendichte im Alken hoch ist. Die Prilezhaev-Epoxidierung ist eine typische pericyclische Reaktion, die gleichzeitig über einen fünf- und dreigliedrigen Übergangszustand (3) ("Spiro-Übergangszustand") verläuft, in dem insgesamt vier Elektronenpaare konzertiert verschoben werden. Aufgrund der Gestalt und räumlicher Anordnung wird der Übergangszustand oft als "Schmetterlingübergangszustand" (engl. "butterfly transition state") bezeichnet. Das elektrophile Sauerstoffatom der Persäure wird dabei an die Doppelbindung addiert und das Proton auf die Carbonylgruppe der Peroxysäure übertragen. Es bildet sich schließlich das Epoxid (4) und die entsprechende Carbonsäure (5), die durch eine nachfolgende, leicht basische Aufarbeitung aus dem Produktgemisch entfernt werden muss.
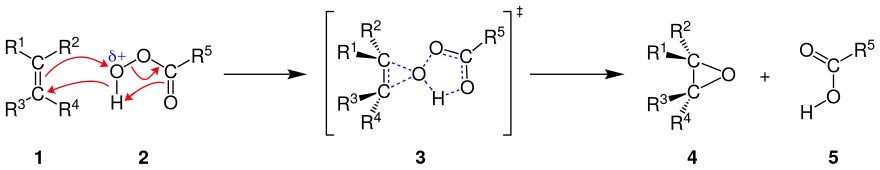
Die Reaktion verläuft stereospezifisch, da aus cis-Alkenen auch nur cis-Epoxide und aus trans-Alkene ausschließlich trans-Epoxide gebildet werden. Weiterhin handelt es sich um eine syn-Addition des Sauerstoffs an die Doppelbindung. Die Epoxidierung verläuft jedoch nicht enantioselektiv, sondern man erhält stets ein racemisches Gemisch. Sind bereits stereogene Zentren im Alken vorhanden, so liefert die Epoxidierung in der Regel gute Diastereoselektivitäten.
Im Allgemeinen läuft die Prileschajew-Reaktion unter milden Bedingungen (bei oder unterhalb von Raumtemperatur) in einem inerten organischen Lösungsmittel wie Chloroform, Dichlormethan, Benzol, Diethylether oder Dioxan ab. Meist wird noch ein leicht basischer Puffer wie Hydrogencarbonate oder Hydrogenphosphate hinzugegeben, damit das entstandene Epoxid nicht durch die ebenfalls gebildete Carbonsäure geöffnet wird.
Literatur
- Beyer-Walter: Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag Stuttgart Leipzig, 1998, ISBN 3-7776-0808-4.
- Reinhard Brückner: Reaktionsmechanismen – Organische Reaktionen, Stereochemie, Moderne Synthesemethoden. 3. Auflage. Springer Spektrum, Berlin-Heidelberg 2015, ISBN 978-3-662-45683-5, S. 120 f.