Pharmaceutical Inspection Co-operation Scheme
Das Pharmaceutical Inspection Co-operation Scheme (PIC/S) ist ein internationaler Zusammenschluss von GMP-Überwachungsbehörden als Nachfolgeprogramm der Pharmaceutical Inspection Convention.[1] PIC/S soll zur Verbesserung der Zusammenarbeit von Regulierungsbehörden und Pharmazeutischer Industrie im Bereich der Guten Herstellungspraxis beitragen.
| Pharmaceutical Inspection Co-operation Scheme (PIC/S) | |
|---|---|
| Rechtsform | Internationale Organisation |
| Gründung | 2. November 1995 |
| Sitz | Genf, Schweiz (⊙) |
| Mitglieder | 52 |
| Website | https://www.picscheme.org/ |
Geschichte
Die Pharmaceutical Inspection Convention wurde im Oktober 1970 von der Europäischen Freihandelsassoziation als Convention for the Mutual Recognition of Inspections in Respect of the Manufacture of Pharmaceutical Products gegründet.[2][3] Gründungsmitglieder waren die damaligen 10 Mitglieder der EFTA. Anfang der 1990er stellte man fest, dass aufgrund einer Inkompatibilität von PIC und Europarecht keine neuen Länder als PIC-Mitglieder aufgenommen werden konnten. Das Europarecht erlaubte es einzelnen EU-Mitgliedsstaaten nämlich nicht, Abkommen mit anderen Staaten zu schließen, die der PIC beitreten wollten. Daher wurde am 2. November 1995 das Pharmaceutical Inspection Co-operation Scheme gegründet. Dabei handelt es sich um eine informelle Vereinbarung zwischen Gesundheitsbehörden und nicht um einen Vertrag zwischen Staaten.[3]
Bis 2003 war PIC/S keine eigene Rechtsperson. Das Sekretariat wurde von der Europäischen Freihandelsassoziation bereitgestellt. Basierend auf einem PIC/S-Treffen im Juni 2003 entschied sich das Komitee, sich selbst als Schweizer Verein nach Artikel 60 des Zivilgesetzbuchs zu konstituieren. Am 1. Januar 2004 hat PIC/S ein eigenes Sekretariat in Genf eingerichtet.[4]
Zweck
PIC/S hat eine Reihe von Bestimmungen, die folgendes erreichen sollen:[5]
- Gegenseitige Anerkennung der Inspektionen zwischen den Mitgliedsländern, sodass eine Inspektion, die von Beamten eines Mitgliedslands durchgeführt wird, von anderen Mitgliedern als gültig anerkannt wird.
- Äquivalente Prinzipien der Inspektionsmethodik, sodass die Inspektoren in jedem Mitgliedsland die gleichen bewährten Vorgehensweisen bei der Durchführung von Inspektionen anwenden.
- Mechanismen zur Ausbildung von Inspektoren.
- Harmonisierung schriftlicher Standards der Guten Herstellungspraxis.
- Kommunikationswege zwischen den Inspektoren/Überwachungsbehörden der Mitgliedsländer.
Mitglieder
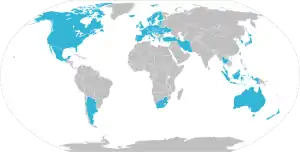
Stand Oktober 2021 hat PIC/S folgende Mitglieder:[6]
| Land | Einrichtung | Beitrittsjahr |
|---|---|---|
| Instituto Nacional de Medicamentos | 2008 | |
| Therapeutic Goods Administration | 1995 | |
| Bundesamt für Sicherheit im Gesundheitswesen | 1999 | |
| Agence Fédérale des Médicaments et des Produits de Santé Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten | 1997 | |
| Agência Nacional de Vigilância Sanitária | 2021 | |
| Health Canada’s Regulatory Operations and Enforcement Branch Santé Canada Direction générale des opérations réglementaires et de l'application de la loi | 1999 | |
| 食品藥物管理署 | 2013 | |
| Agencija za lijekove i medicinske proizvode | 2016 | |
| Φαρμακευτικές Υπηρεσίες | 2008 | |
| Státní Ústav pro Kontrolu Léčiv Ústav pro státní kontrolu veterinárních biopreparátů a léčiv | 1997 2005 | |
| Lægemiddelstyrelsen | 1995 | |
| Ravimiamet | 2007 | |
| Lääkealan turvallisuus- ja kehittämiskeskus Fimea | 1996 | |
| Agence nationale de sécurité du médicament et des produits de santé Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail | 1997 2009 | |
| Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten | 2000 | |
| Εθνικός Οργανισμός Φαρμάκων | 2002 | |
| 香港藥劑業及毒藥管理局 | 2016 | |
| Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet | 1995 | |
| Lyfjastofnun | 1995 | |
| Badan Pengawas Obat dan Makanan | 2012 | |
| سازمان غذا و دارو | 2018 | |
| Health Products Regulatory Authority | 1996 | |
| מכון לביקורת ותקנים של חומרי רפואה | 2009 | |
| Agenzia Italiana del Farmaco Direzione generale della sanità animale e dei farmaci veterinari | 2000 2020 | |
| PMDA | 2014 | |
| Zāļu valsts aģentūra | 2004 | |
| Amt für Gesundheit | 1995 | |
| Valstybinė vaistų kontrolės tarnyba | 2009 | |
| Bahagian Regulatori Farmasi Negara | 2002 | |
| Malta Medicines Authority | 2008 | |
| Comisión Federal para la Protección contra Riesgos Sanitarios | 2018 | |
| Inspectie Gezondheidszorg en Jeugd | 1995 | |
| Medsafe | 2013 | |
| Statens legemiddelverk | 1995 | |
| Główny Inspektorat Farmaceutyczny | 2006 | |
| Autoridade Nacional do Medicamento e Produtos de Saúde IP | 1999 | |
| Agenția Națională a Medicamentului și a Dispozitivelor Medicale din România | 1995 | |
| Health Sciences Authority | 2000 | |
| Státní ústav pro kontrolu léčiv | 1997 | |
| Javna agencija Republike Slovenije za zdravila in medicinske pripomočke | 2012 | |
| South African Health Products Regulatory Authority | 2007 | |
| 대한민국 식품의약품안전처 | 2014 | |
| Agencia Española de Medicamentos y Productos Sanitarios | 1998 | |
| Läkemedelsverket | 1996 | |
| Swissmedic | 1996 | |
| สำนักงานคณะกรรมการอาหารและยา | 2016 | |
| Türkiye İlaç ve Tıbbi Cihaz Kurumu | 2018 | |
| Державна служба України з лікарських засобів та контролю за наркотиками | 2011 | |
| Medicines and Healthcare products Regulatory Agency Veterinary Medicines Directorate | 1999 2014 | |
| Food and Drug Administration | 2011 |
Siehe auch
Einzelnachweise
- Pharmaceutical Inspection Co-operation Scheme Brochure. (PDF) 2019, abgerufen am 30. Dezember 2021.
- History of PIC/S. In: picscheme.org. Abgerufen am 2. Oktober 2021.
- Daniel Brunner: Pharmaceutical Inspection Co-operation Scheme (PIC/S). In: The Quality Assurance Journal. 8, Nr. 3, September 2004, S. 207-211.
- Legal Form. In: picscheme.org. Abgerufen am 2. Oktober 2021.
- Kate McCormick: Quality (Pharmaceutical Engineering Series). Butterworth-Heinemann, 2002, ISBN 978-0-7506-5113-4, S. 158.
- Members. In: www.picscheme.org. Abgerufen am 2. Oktober 2021.