Noscapin
Noscapin ist der internationale Freiname für (−)-α-Narcotin, einem Hauptalkaloid des Opiums (3–10 %),[1] das als Arzneistoff zur Hustenstillung (Antitussivum) verwendet wird. Die für die Biosynthese im Schlafmohn (Papaver somniferum) verantwortlichen zehn Gene wurden identifiziert.[4]

| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
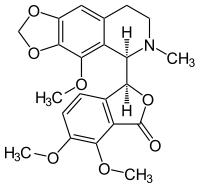 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Noscapin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C22H23NO7 | |||||||||||||||||||||
| Kurzbeschreibung |
weiße Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
R05DA07 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 413,42 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Die Verbindung war als Opium-Auszug schon 1762 Antoine Baumé bekannt[5] (und später Charles Derosne in dem nach ihm benannten Salz) und wurde 1817 von Pierre-Jean Robiquet aus Opium isoliert. Sie weist eine vom 1-Benzyl-1,2,3,4-tetrahydroisochinolin abgeleitete Struktur auf, als Reinstoff bildet sie farblose Prismen aus. Es ist chemisch ein Methoxy-Derivat des Hydrastins.
Das Molekül enthält zwei Chiralitätszentren, so dass vier Stereoisomere existieren. Arzneilich verwendet wird die natürliche, enantiomerenreine (−)-α-Form.
| Stereoisomere des Noscapins[6] | ||
|---|---|---|
| (–)-α-Noscapin | (3S, 5R) | erythro-Form |
| (+)-α-Noscapin | (3R, 5S) | |
| (–)-β-Noscapin | (3R, 5R) | threo-Form |
| (+)-β-Noscapin | (3S, 5S) | |
Beim oxidativen Abbau von Noscapin entstehen die Spaltprodukte Cotarnin und Opiansäure. Methylierung des Stickstoffatoms zum quartären Ammoniumion, Überführung in das Hydroxid und Erhitzen (analog zum Hofmann-Abbau) ergibt Narcein.[7]
(–)-α-Noscapin wirkt antitussiv, aber nicht schmerzstillend, wobei die Wirkung etwas schwächer ausgeprägt ist als beim Codein. Im Gegensatz zu Morphin wirkt Noscapin schwach atemanregend und bronchodilatatorisch. Noscapin hemmt auch die Mitose, spezifisch in Tumorzellen, und ist daher ein potenzieller Wirkstoff gegen Krebs.[1][8]
Die Plasmahalbwertzeit von Noscapin beträgt 2,6 bis 4,5 Stunden. Die Bioverfügbarkeit ist individuell variabel und liegt bei circa 30 %.[9] Schwerwiegende Nebenwirkungen sind nicht bekannt.[10]
Handelsnamen
Capval (D), Tussanil N (CH), Nosca-Mereprin (B, L)
DemoTussil (CH), Hederix (CH), Tossamin (CH), Tuscalman (A)
Einzelnachweise
- Eintrag zu (−)-α-Narcotin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. April 2014.
- Eintrag zu Noscapine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Datenblatt (S,R)-Noscapine bei Sigma-Aldrich, abgerufen am 16. April 2011 (PDF).
- T. Winzer, V. Gazda u. a.: A Papaver somniferum 10-Gene Cluster for Synthesis of the Anticancer Alkaloid Noscapine. In: Science. 336, 2012, S. 1704–1708, doi:10.1126/science.1220757.
- Winfried Pötsch u. a. Lexikon bedeutender Chemiker, Harri Deutsch 1989, Artikel Baumé
- K. Hardtke et al. (Hrsg.): Kommentar zum Europäischen Arzneibuch Ph. Eur. 7.1, Noscapin. Loseblattsammlung, 40. Lieferung 2012, Wissenschaftliche Verlagsgesellschaft Stuttgart.
- Harry Auterhoff, Lehrbuch der pharmazeutischen Chemie, Wissenschaftliche Verlagsgesellschaft Stuttgart, 1968.
- M. Mahmoudian, P. Rahimi-Moghaddam: The anti-cancer activity of noscapine: a review. In: Recent Patents on Anti-Cancer Drug Discovery. Band 4, Nummer 1, Januar 2009, S. 92–97, PMID 19149691. (Review).
- Holz, Schwabe et al.: Taschenbuch der Arzneibehandlung: Angewandte Pharmakologie, 13. Auflage; Springer-Verlag; Berlin, Heidelberg 2005. ISBN 3-540-20821-6.
- Ernst Mutschler, Monika Schäfer-Korting: Lehrbuch der Pharmakologie und Toxikologie. 8.,völlig neu bearbeitete und erweiterte Auflage. Wissenschaftliche Verlagsgesellschaft Stuttgart 2001. ISBN 3-8047-1763-2. S. 224.