Buprenorphin
Buprenorphin ist ein stark wirksames Schmerzmittel (Analgetikum) aus der Gruppe der Opioide. Buprenorphin hat eine partialagonistische Wirkung mit hoher Affinität zu µ-Rezeptoren.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
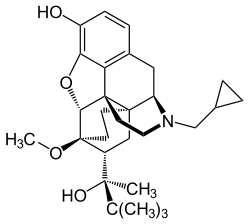 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Buprenorphin | |||||||||||||||||||||
| Andere Namen |
(5R,6R,7R,9R,13S,14S)-17-Cyclopropylmethyl-7-[(S)-3,3-dimethyl-2-hydroxybutan-2-yl]-6-methoxy-4,5-epoxy-6,14-ethanomorphinan-3-ol (IUPAC) | |||||||||||||||||||||
| Summenformel | C29H41NO4 | |||||||||||||||||||||
| Kurzbeschreibung |
Weißes bis fast weißes, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
| |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 467,64 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
8,5; 10,0[3] | |||||||||||||||||||||
| Löslichkeit |
sehr schwer löslich in Wasser, leicht löslich in Aceton, löslich in Methanol, schwer löslich in Cyclohexan[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Es gilt im höheren Alter aufgrund seines guten Sicherheitsprofils als Mittel der ersten Wahl zur Behandlung starker chronischer Schmerzen (etwa bei Schmerzsyndromen).[6] Darüber hinaus wird Buprenorphin hochdosiert seit circa Mitte der 1990er Jahre als Substitutionsmittel in der Therapie einer Abhängigkeit von Opioiden verwendet, 2006 wurde es für diese Anwendung in die Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation aufgenommen.[7]
Buprenorphin wird halbsynthetisch aus dem Opium-Alkaloid Thebain gewonnen und vermittelt seine Effekte als Partialagonist über verschiedene Opioid-Rezeptoren. Sein wichtigstes Abbauprodukt ist das pharmakologisch aktive Nor-Buprenorphin.
Pharmakologische Eigenschaften
Pharmakodynamik (Wirkweise)
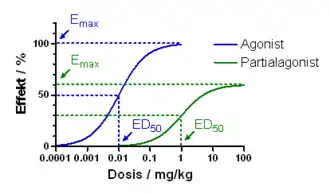
Der Ligand bindet mit hoher Affinität an µ-Opioidrezeptoren und wirkt dort als Partialagonist. Am κ-Opioidrezeptor wirkt er als partieller Agonist und sehr wirksamer Antagonist.[8] Wie andere Opioide besitzt Buprenorphin eine schmerz- und hustenreizstillende, aber auch atemdepressive, brechreizfördernde und obstipierende Wirkung. Seine schmerzstillende Potenz ist etwa die 20- bis 70-fache des Morphins.[9][10][11] Bei gesunden Freiwilligen konnte ein sogenannter Ceiling-Effekt (Sättigungseffekt) für die Atemdepression nachgewiesen werden.[12] Eine Dosissteigerung bewirkt kaum eine Erhöhung des Risikos einer Atemdepression. Bei Personen mit Opioidvorerfahrung aber ohne Abhängigkeit wird bei einer Dosierung von 32 mg pro Tag eine messbare Abnahme der Atemtätigkeit auf vier Atemzüge pro Minute beobachtet. Analgetisch vergleichbare Dosierungen von Morphin (530 mg intramuskulär) oder Methadon (1060 mg oral) wären auf Grund der durch diese Stoffe bedingten starken Atemdepression tödlich.[13] Damit gilt Buprenorphin bei Überdosierung als sicherer im Vergleich zu anderen Opioiden, vor allem nach abgeschlossenem Opioid-Entzug.[14]
Pharmakokinetik
Buprenorphin wird aufgrund seiner hohen Lipophilie[15] im Körper gespeichert und nur langsam aufgrund seiner trägen Rezeptorkinetik sowie des entero-hepatischen Kreislaufs ausgeschieden.
Buprenorphin besitzt nach oraler Gabe eine schlechte Bioverfügbarkeit von nur etwa 6,5 %, bedingt durch einen ausgeprägten First-Pass-Effekt (der unmittelbaren Verstoffwechselung in der Leber nach Aufnahme aus dem Dünndarm). Bei einer Einmalgabe als Sublingualtablette(n) (Einzeldosis: 0,2 bis 0,6 mg[16] bei Erwachsenen) ist die Bioverfügbarkeit durch Umgehung des First-Pass-Effekts etwa doppelt so hoch, bei sublingualer Verabreichung als Flüssigkeit etwa 4- bis 8-mal höher. Bei Einnahme beider Arzneizubereitungen über mehrere Tage erhöht sich allerdings die relative Bioverfügbarkeit der Sublingualtablette.[14][17][18]
Das wichtigste Stoffwechselprodukt (Metabolit) ist Nor-Buprenorphin, für dessen Bildung das Cytochrom-P450-Enzymsystem verantwortlich ist. Nor-Buprenorphin ist ebenfalls pharmakologisch wirksam, jedoch ist seine analgetische Potenz gegenüber seiner Muttersubstanz um den Faktor 50 reduziert.[19] Die Verstoffwechslung erfolgt zu 75 % über die Isoenzyme CYP3A4 und CYP3A5. Buprenorphin selbst hemmt CYP3A4.[20] Buprenorphin-Wechselwirkungen sind daher mit einer Vielzahl an Medikamenten möglich. Die Ausscheidung von Buprenorphin und Nor-Buprenorphin erfolgt nach einer optionalen Glucuronidierung zum überwiegenden Teil über die Galle und damit über die Faeces und nur zu etwa 10 bis 30 % über die Nieren und damit über den Urin.[19]
Die Eliminierungsgeschwindigkeit von Buprenorphin folgt einem komplexen bi- oder triexponentiellen Schema.[21] Als Ursache werden komplexe Verteilungsvorgänge von Buprenorphin im Organismus betrachtet, welche dessen Rückresorption aus dem Magen-Darm-Trakt (enterohepatischer Kreislauf) und eine langsame Diffusion aus dem Fettgewebe einschließen. Zudem hat die Art der Verabreichung Auswirkungen auf das Verteilungsverhalten von Buprenorphin und somit auch auf dessen pharmakokinetische Eigenschaften.[19] Aus diesen Gründen und je nach verwendeter Bestimmungsmethode werden unterschiedliche Plasmahalbwertzeiten für Buprenorphin ermittelt. Diese liegen zwischen 3 und 44 Stunden.[19] Wegen der lang anhaltenden Rezeptorbindung korreliert die Wirkdauer nicht unmittelbar mit Blutkonzentrationen oder der Plasmahalbwertszeit von Buprenorphin. Die Wirkdauer ist mit 24 bis 69 Stunden mindestens ebenso lang wie die von Methadon.[14]
Klinische Angaben
Anwendungsgebiete (Indikationen)
Buprenorphin ist zur Behandlung starker Schmerzen, ausgenommen Zahnschmerzen, Kopfschmerzen und anderen Schmerzen, die nicht mit Hilfe peripher wirkender Analgetika oder Spasmolytika behandelt werden können, zugelassen. Die Anwendungsgebiete von Buprenorphin umfassen insbesondere Schmerzen nach Operationen und Verletzungen, nach einem Herzinfarkt oder chronischen Schmerzen bei Tumorerkrankungen.[22] Für diese Anwendungsgebiete steht Buprenorphin als Injektionslösung, Sublingualtablette oder transdermales Pflaster (Freisetzung von wahlweise 35, 52,6 oder 70 Mikrogramm Buprenorphin pro Stunde) zur Verfügung,[21] für ein weiteres Anwendungsgebiet – die Substitutionstherapie bei Opioidabhängigkeit in Kombination mit anderen medizinischen, sozialarbeiterischen und psychotherapeutischen Maßnahmen – nur als Sublingualtablette.
Schmerztherapie
Buprenorphin hat sich in der Therapie chronischer Schmerzzustände bewährt. Die transdermale Verabreichungsform mittels Schmerzpflaster ist angezeigt bei gleichzeitig bestehenden Schluckstörungen oder nicht gewährleisteter regelmäßiger Einnahme und ermöglicht eine gleichmäßige Freisetzung des Wirkstoffs über einen Zeitraum von bis zu sieben Tagen. Für die Behandlung akuter starker Schmerzen sowie zur Behandlung von Durchbruchschmerzen stehen zusätzlich schnellwirksame Arzneiformen, wie Injektionslösungen und Sublingualtabletten, zur Verfügung. Die intravenöse Verabreichung ist hauptsächlich bei postoperativen Schmerzen, in der Palliativmedizin bei instabilem Schmerz und hohem Opioidverbrauch in Form der patientengesteuerten Schmerzbehandlung indiziert.[23]
Substitution
Bei der Substitutionstherapie opioidabhängiger (meist heroinabhängiger) Patienten mit Buprenorphin ist zu beachten, dass es bei der Umstellung auf Buprenorphin – vor allem wenn noch signifikante Mengen anderer Opioide im Körper sind und Buprenorphin in zu geringer Dosis gegeben wird – aufgrund seines partiell antagonistischen Charakters eine verstärkte Entzugssymptomatik ausgelöst werden kann. Dennoch wird seit einiger Zeit eine Methadon-zu-Buprenorphin-Umstellungsmethode praktiziert, die diesen Aspekt bewusst einkalkuliert, das sogenannte Ravensburger Modell.[24] Bei korrekter Dosierung und einer zeitlichen Differenz von mindestens zweimal der Halbwertszeit des zuletzt konsumierten Opiats zur ersten Gabe von Buprenorphin treten jedoch keine (zusätzlichen) Entzugserscheinungen auf, da diese durch die Vakanz bereits maximal ausgeprägt sind. Die körperlichen Symptome werden nun umgehend vom Liganden beseitigt, während der psychische Entzug noch längere Zeit in Anspruch nehmen kann. Es fehlt das vielzitierte, charakteristische "wie-in-Watte-gepackt-sein" des Heroins bzw. Methadons. Die Einnahme selbst kann theoretisch jeden zweiten Tag (doppelte Menge)[25] oder gar nur jeden dritten Tag (dreifache Menge)[26] erfolgen, wenngleich in den meisten Ländern täglich dosiert wird.
Seine nachgewiesene Wirksamkeit als Substitutionsmittel hat dazu geführt, dass Buprenorphin zusammen mit Methadon von der Weltgesundheitsorganisation (WHO) 2006 in ihre Liste der unentbehrlichen Arzneimittel aufgenommen wurde.[7] 1995 wurden in Frankreich sowohl Methadon als auch Buprenorphin zur Substitutionstherapie zugelassen und ein Jahr später konnten alle zugelassenen Ärzte Buprenorphin verordnen, ohne eine weitere Ausbildung vorweisen zu müssen. Dies führte dazu, dass 1999 zehnmal so viele Patienten mit Buprenorphin wie mit Methadon behandelt wurden, zwölf Prozent der Patienten Buprenorphin von mehr als zwei Verordnern erhielten und 43 Prozent einen Beikonsum von Benzodiazepinen (meist Flunitrazepam) aufwiesen.[27]
Buprenorphin eignet sich gut zur Substitution derjenigen Opiatabhängigen, die auf eine sedierende Wirkung verzichten können oder auch mit der stark sedierenden Wirkung von Methadon oder Morphin (Substitol) ihre Pläne für den Tag (Arbeit, Sport etc.) nicht einhalten können: Am Kappa-Rezeptor wirkt Buprenorphin antagonistisch, d. h., es blockiert die Wirkung an jenem Rezeptor. Da dieser spezielle Rezeptor für die sedierenden und dysphorischen Wirkungen von Vollagonisten wie Morphin verantwortlich gemacht wird, fehlt diese Wirkung bei Buprenorphin oder ist deutlich schwächer ausgeprägt. Die Patienten bleiben tendenziell klarer und sind den Tag über aktiver. Die fehlende Sedierung kann für manche Patienten allerdings auch einen Nachteil bedeuten, da so ungelöste psychische Probleme ungedämpft an die Oberfläche kommen. Der Unterschied zum nüchternen Befinden ist im Vergleich zum Befinden bei Methadon oder Morphin nur marginal. Buprenorphin wird daher vor allem bei jüngeren Patienten mit weniger stark ausgeprägter Symptomatik bevorzugt eingesetzt.[28]
Häufig wird Buprenorphin missbräuchlich nasal konsumiert, um einerseits Suchtdruck entgegenzuwirken und andererseits durch die bessere Ausnutzung der Schleimhäute die Bioverfügbarkeit zu erhöhen. Auf dem europäischen Schwarzmarkt hat Buprenorphin in den letzten Jahren rasante Verbreitung gefunden.[29][30] Anders als Methadon wird es auch immer häufiger von jungen Leuten ohne Heroin-Vorgeschichte konsumiert und muss in diesem Zusammenhang daher nicht als Ersatzstoff, sondern als Hauptdroge gelten. Seit 2007 ist ein Kombinationspräparat aus Buprenorphin und Naloxon auf dem deutschen Markt. Es wird zur Substitution eingesetzt und hat den Vorteil, dass bei missbräuchlicher nasaler oder intravenöser Anwendung der Opioidantagonist Naloxon Entzugssymptome auslöst.[31]
Die Entzugssymptomatik bis zum Erreichen einer normalen Befindlichkeit von Körper und Geist liegt (dosisabhängig) zwischen der von Morphin (etwa ein Monat) und der von Methadon (etwa neun Monate) je nach Konstitution zwischen zwei und fünf Monaten, ist aber meist schwächer ausgeprägt, was man unter anderem auch auf die deutlich längere Halbwertszeit sowie die nur partielle Besetzung der Opioidrezeptoren zurückführt.
Neue Darreichungsformen:
Im November 2018 wurde das erste Buprenorphin-Depot (Handelsname Buvidal) durch die Europäische Arzneimittel-Agentur (EMA) für die Behandlung der Opioidabhängigkeit zugelassen. Medizinisches Fachpersonal kann die in sieben verschiedenen Dosierungen erhältliche Fertigspritze unter die Haut der Patienten injizieren. Wie bei einer Impfung ist keine Betäubung notwendig. Dank der speziellen Eigenschaften der enthaltenen natürlichen Lipide (FluidCrystal-Technologie) bildet sich im Körper bei Kontakt mit dem Gewebswasser ein gelartiger Flüssigkristall, der im Körper kontinuierlich therapeutisch wirksame Mengen an Buprenorphin freisetzt. Die Wirkung hält eine Woche (4 Dosierungen) oder einen Monat (3 Dosierungen) an. Der Flüssigkristall wird im Körper vollständig abgebaut. Die FluidCrystal-Technologie sowie das Depotpräparat wurden von der Camurus AB (Lund, Schweden) entwickelt, die das Produkt auch in derzeit 6 europäischen Ländern (Stand Ende 2019) sowie Australien vertreibt.
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur (EMA) hat bei seinem Meeting im April 2019 ein Buprenorphin-Implantat für die Substitutionsbehandlung zur Zulassung empfohlen (Handelsname: Sixmo). Speziell geschulte Ärzte sollen / können vier kleine Stäbchen unter örtlicher Betäubung in den Oberarm des Patienten applizieren. Das Implantat setzt im Körper kontinuierlich geringe Mengen an Buprenorphin frei. In den USA ist das Implantat seit drei Jahren unter dem Namen Probuphin zugelassen. Es wurde von Titan Pharmaceuticals entwickelt. Der Handelspartner in der EU, der auch den Zulassungsantrag bei der EMA gestellt hat, ist das italienische Unternehmen Molteni Farmaceutici.[32][33] In der Regel folgt die Europäische Kommission einer solchen Empfehlung und erteilt die Zulassung.
Versuchsstadium Depression
Gemäß diverser Studien wurde eine antidepressive Wirkung bei nicht-psychotischen unipolaren Depressionen nachgewiesen. Ein antidepressiver Effekt wurde auch bei jenen Probanden erzielt, welche zuvor weder auf herkömmliche Antidepressiva noch auf eine Elektrokrampftherapie (EKT) angesprochen haben.[34][35][36][37] Aufgrund der unvermeidbaren Entwicklung einer Opioidabhängigkeit ist Buprenorphin in der EU bei Depressionen nicht indiziert.
In den USA hingegen ist ein Medikament auf der Basis von Buprenorphin und Samidorphan, einem μ-Rezeptor-Antagonisten, unter dem Namen ALKS-5461 für nicht-psychotische unipolare und therapieresistente Depressionen entwickelt worden. Das Medikament wurde am 31. Januar 2018 durch die Food and Drug Administration (FDA) für den US-Markt zugelassen.[38]
Gegenanzeigen (Kontraindikationen)
Neben einer bekannten Überempfindlichkeit gelten eine schwere Ateminsuffizienz und eine schwere Leberinsuffizienz als absolute Kontraindikationen. Daher darf Buprenorphin bei diesen Erkrankungen sowie bei gleichzeitiger Verwendung von MAO-Hemmern nicht angewendet werden. Weitere absolute oder relative Kontraindikationen sind Alkoholismus, Delirium tremens, schwere Kopfverletzungen und ein erhöhter Hirndruck. Die Anwendung bei leichten Formen der Atem- und Leberinsuffizienz sowie bei Niereninsuffizienz ist unter Beachtung einer Dosisanpassung und weiterer Vorsichtsmaßnahmen möglich.
Wechselwirkungen
Bei gleichzeitiger Anwendung von Buprenorphin mit anderen Opioiden, Alkohol, Anästhetika, Hypnotika, Sedativa, Antidepressiva, Neuroleptika und weiteren Arzneimitteln mit einer dämpfenden Wirkung auf das Zentralnervensystem kann es zur Verstärkung von zentralnervösen Effekten kommen. Insbesondere bei einer gleichzeitigen Einnahme von Alkohol werden die sedierenden Nebenwirkungen von Buprenorphin verstärkt. Benzodiazepine verstärken insbesondere die atemdepressiven Nebenwirkungen von Buprenorphin. Bei gemeinsamer Anwendung von Buprenorphin mit CYP3A4-Inhibitoren, wie beispielsweise Ketoconazol, Gestoden, Triacetyloleandomycin, Ritonavir, Indinavir und Saquinavir, kann die Wirkung von Buprenorphin verstärkt werden. Eine ausgeprägte Erhöhung des Buprenorphinspiegels ist auch bei gleichzeitigem Konsum mit dem ebenfalls CYP3A4-hemmenden Grapefruitsaft beschrieben worden.[39] Eine eventuelle Interaktion mit CYP3A4-Induktoren, wie beispielsweise Phenobarbital, Carbamazepin, Phenytoin und Rifampicin ist zwar nicht hinreichend untersucht, gilt aber auf Grund der pharmakokinetischen Eigenschaften von Buprenorphin als möglich und kann zu einer Verringerung der Buprenorphinwirkung führen. Zusätzlich ist vereinzelt von einer Verstärkung der Nebenwirkungen von Phenprocoumon durch Buprenorphin berichtet worden.[21][22]
Nebenwirkungen
In der Indikation der analgetischen Therapie hat Buprenorphin unter den Opioiden ein günstigeres Nebenwirkungsprofil – im Vergleich zu z. B. Morphin treten Symptome wie Obstipation und Juckreiz deutlich seltener auf. Initial auftretende Übelkeit bzw. Erbrechen unterliegen schnell einem Toleranzeffekt und können durch prophylaktische Gabe eines Antiemetikums und langsame Dosissteigerung minimiert werden. Da die Ausscheidung überwiegend über die Galle (biliär) erfolgt, besteht keine Notwendigkeit einer Dosisanpassung bei eingeschränkter Nierenfunktion und somit auch kein Risiko einer Substanzkumulation mit Intoxikation bei Patienten mit Nierenfunktionseinschränkung (auch bei älteren Patienten).
Die Nebenwirkungen von Buprenorphin in der Substitutionstherapie sind im Vergleich zu den Nebenwirkungen, die eine Substitution mit Methadon mit sich bringt (z. B. starkes Schwitzen, Wasseransammlungen im Körper, Antriebslosigkeit, Schlafstörungen, Konzentrationsschwäche, vermindertes sexuelles Empfinden, Depression, Obstipation) weniger stark ausgeprägt.
Am häufigsten treten Störungen des Nervensystems, insbesondere Müdigkeit, Schlafstörungen und Benommenheit mit einer Häufigkeit von über 10 % auf. Ebenso können häufig (1 bis 10 %) Schwindel und Kopfschmerzen sowie gelegentlich (0,1 bis 1 %) Erschöpfung, Mundtrockenheit, verwaschene Sprache, Koma, Tremor, Krämpfe und fehlende Muskelkoordination vorkommen. Ebenso können gelegentlich psychiatrische Störungen, wie Verwirrtheit, Desorientierung, Nervosität, Depression, Psychose, Halluzinationen, Depersonalisation, Euphorie, Dysphorie und Unruhe auftreten. Die charakteristische Opioid-Nebenwirkung der Miosis kann bei etwa 1 bis 10 % der Patienten beobachtet werden, während weitere Störungen des Auges, wie beispielsweise Doppeltsehen, Sehstörungen und Konjunktivitis, oder des Ohrs, wie Tinnitus, nur gelegentlich auftreten. Die häufigste Nebenwirkung auf das Herz-Kreislaufsystem ist ein orthostatischer Blutdruckabfall (1 bis 10 %). Gelegentlich treten auch Tachykardie, Bradykardie, Zyanose, AV-Block und Hypotonie auf. Eine Atemdepression kann häufig beobachtet werden, sie steigert sich jedoch nur gelegentlich in eine Atemnot oder einen Atemstillstand. Ein Bronchospasmus tritt nur sehr selten auf (<0,01 %). Übelkeit und Erbrechen können als charakteristische Opioid-Nebenwirkungen häufig beobachtet werden, während Obstipation, Dyspepsie, Appetitlosigkeit und Durchfall nur gelegentlich auftreten. Gelegentlich können auch Miktionsbeschwerden und Harnretention beobachtet werden. Störungen, welche die Haut betreffen, äußern sich häufig in Schwitzen sowie gelegentlich in Parästhesie, Juckreiz, Hautausschlag, Blässe und Urtikaria. Das Quincke-Ödem tritt nur sehr selten auf. Allgemeine Überempfindlichkeitsreaktionen können gelegentlich auftreten, schwere anaphylaktische Reaktionen sind sehr selten.[22]
Da unter der sublingualen hochdosierten Therapie mit Buprenorphin häufig das Auftreten einer Verlängerung des QT-Intervalls beobachtet wurde,[21] sind Vorsichtsmaßnahmen bei Patienten mit bekannter oder vermuteter EKG-Veränderung, einem Elektrolyt-Ungleichgewicht, einer Verlangsamung der Herzfrequenz (Bradykardie) oder bei der gleichzeitigen Behandlung mit Arzneimitteln gegen Herzrhythmusstörungen nötig.[21] Vor und 2 Wochen nach Behandlungsbeginn bzw. Dosiserhöhungen ist daher ein EKG durchzuführen. Verschiedene Studien beschreiben eine sichere Therapie mit Buprenorphin ohne Auswirkungen auf das QT-Intervall.[40][41][42][43][44]
Überdosierung
In jedem Fall treten nach einer Überdosis Buprenorphin ähnliche Symptome auf, wie sie auch bei anderen zentralwirksamen Analgetika zu erwarten sind. Sie umfassen Atemdepression, Sedierung, Somnolenz, Übelkeit, Erbrechen, Kreislaufkollaps und ausgeprägte Miosis. Zu beachten ist, dass Buprenorphin wegen der oben genannten hohen Rezeptoraffinität nur sehr langsam vom Rezeptor dissoziiert, es wirkt also vergleichsweise lange, was bei der Behandlung einer Überdosierung zu beachten ist. Es sollte eine kontinuierliche Infusion mit Naloxon erfolgen, da Naloxon eine viel geringere Halbwertzeit (circa 70 Minuten) und damit kürzere Wirkdauer hat. Des Weiteren muss Naloxon deutlich höher dosiert werden als bei der Antagonisierung von etwa Morphin. Eine Atemdepression kann mit Naloxon nicht sicher aufgehoben werden, so dass eine künstliche Beatmung notwendig werden kann.[45] Zur Atemstimulierung kann ein Analeptikum wie Doxapram eingesetzt werden.[46]
Chemie
Geschichte
Buprenorphin wurde als starkes Analgetikum 1968 von Reckitt & Colman patentiert.[47]
Synthese
Die Ausgangssubstanz für die partialsynthetische Herstellung von Buprenorphin ist das Opium-Nebenalkaloid Thebain. Durch Umsetzung mit Methylvinylketon wird in einem ersten Reaktionsschritt das Cycloadditionsprodukt 7-Acetyl-6,14-endoethenotetrahydrothebain gebildet. Nach Reduktion unter Palladium-Kohle-Katalyse wird das Reaktionsprodukt mit tert-Butylmagnesiumchlorid im Sinne einer Grignard-Reaktion zu 6,14-Endoethano-7-(2-hydroxy-3,3-dimethyl-2-butyl)-tetrahydrothebain umgesetzt. Die tertiäre Aminogruppe dieses Zwischenprodukts wird mit Bromcyan demethyliert und mit Hilfe von Cyclopropylcarbonsäurechlorid unter reduktiven Bedingungen in Gegenwart von Lithiumaluminiumhydrid alkyliert. Nach hydrolytischer Abspaltung der phenolischen Methoxygruppe kann Buprenorphin isoliert werden.[48]
Analytik
Das Europäische Arzneibuch verwendet die IR-Spektroskopie zur Identitätsprüfung von Buprenorphin. Die Gehaltsbestimmung sowohl der Base als auch des Hydrochlorids erfolgt als acidimetrische Titration mit Perchlorsäure in Eisessig und potentiometischer Endpunktanzeige.[49][50]
Für den Nachweis von Buprenorphin im Urin steht ein auf einem Immunoassay basierender Schnelltest zur Verfügung. Zusätzlich kann eine Bestätigungsanalyse auf Buprenorphin mit Hilfe chromatographischer Methoden, wie Hochleistungsflüssigkeitschromatographie mit Fotodiodenzeilendetektion, Gaschromatographie mit Massenspektrometrie-Kopplung oder Flüssigchromatographie mit Massenspektrometrie-Kopplung aus biologischen Proben durchgeführt werden.[51]
Stereochemie
Buprenorphin weist sieben benachbarte Asymmetriezentren auf, von denen vier durch Syntheseschritte eingeführt werden.
Handelsnamen
- Norspan (D, A), Subutex (D, A, CH, FR, BE), Buvidal (D, UK, DK, NO, SW, SF), Bupensan (A), Temgesic (D, A, CH, FR, BE), Transtec (D, A, CH, FR, BE), Triquisic (A) und Generika
- Buprenovet (Veterinärmedizin, D)
- Fixe Kombination mit Naloxon: Suboxone (EU)
Weblinks
- Buprenorphin. In: Erowid. (englisch)
- Suboxone® (Buprenorphin/Naloxon) auf der Website der Europäischen Arzneimittelagentur
- Selected Issue 3: Buprenorphine – Treatment, Misuse and Prescription Practices (PDF; 673 kB). In: Annual Report 2005. European Monitoring Centre for Drugs and Drug Addiction (EMCDDA), Lisbon 2005, ISBN 92-9168-246-2.
Einzelnachweise
- Europäische Arzneibuch-Kommission (Hrsg.): EUROPÄISCHE PHARMAKOPÖE 5. AUSGABE. Band 5.0–5.8, 2006.
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station, NJ 2006, ISBN 0-911910-00-X.
- James Blair Reynolds, William L. Martindale: The extra pharmacopoeia. Pharmaceutical Press, London 1993, ISBN 0-85369-300-5.
- Datenblatt Buprenorphin·Hydrochlorid bei Sigma-Aldrich, abgerufen am 31. Oktober 2021 (PDF).
- Eintrag zu Buprenorphine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- J. Pergolizzi, R. H. Böger, K. Budd u. a.: Opioids and the management of chronic severe pain in the elderly: consensus statement of an International Expert Panel with focus on the six clinically most often used World Health Organization Step III opioids (buprenorphine, fentanyl, hydromorphone, methadone, morphine, oxycodone). In: Pain Pract. Band 8, Nr. 4, 2008, S. 287–313, doi:10.1111/j.1533-2500.2008.00204.x, PMID 18503626.
- Europäische Beobachtungsstelle für Drogen und Drogensucht (EMCDDA): Jahresbericht 2006. Stand der Drogenproblematik in Europa.
- P. Huang, G. B. Kehner, A. Cowan, L. Y. Liu-Chen: Comparison of pharmacological activities of buprenorphine and norbuprenorphine: norbuprenorphine is a potent opioid agonist. In: Journal of Pharmacology and Experimental Therapeutics. Band 297, Nr. 2, Mai 2001, S. 688–695, PMID 11303059.
- D. R. Jasinski, J. S. Pevnick, J. D. Griffith: Human pharmacology and abuse potential of the analgesic buprenorphine: a potential agent for treating narcotic addiction. In: Arch Gen Psychiatry. 35(4), Apr 1978, S. 501–551. PMID 215096
- Eckhard Beubler: Kompendium der medikamentösen Schmerztherapie. Wirkungen, Nebenwirkungen und Komplikationsmöglichkeiten. 6. Auflage. Springer, Berlin/Heidelberg 2016, ISBN 978-3-662-48826-3, S. 62.
- Eberhard Klaschik: Schmerztherapie und Symptomkontrolle in der Palliativmedizin. In: Stein Husebø, Eberhard Klaschik (Hrsg.): Palliativmedizin. 5. Auflage, Springer, Heidelberg 2009, ISBN 3-642-01548-4, S. 207–313, hier: S. 233.
- A. Dahan, A. Yassen, R. Romberg u. a.: Buprenorphine induces ceiling in respiratory depression but not in analgesia. In: Br J Anaesth. Band 96, Nr. 5, Mai 2006, S. 627–632, doi:10.1093/bja/ael051, PMID 16547090.
- S. L. Walsh, K. L. Preston, M. L. Stitzer, E. J. Cone, G. E. Bigelow: Clinical pharmacology of buprenorphine: ceiling effects at high doses. In: Clin Pharmacol Ther. Band 55, Nr. 5, Mai 1994, S. 569–580, PMID 8181201.
- Richard P. Mattick u. a.: Pharmacotherapies for the Treatment of Opioid Dependence: Efficacy, Cost-Effectiveness and Implementation Guidelines. Informa Healthcare, 2009, ISBN 1-84184-400-4.
- Alex Avdeef, David A. Barrett, P. Nicholas Shaw, Roger D. Knaggs, Stanley S. Davis: Octanol-, Chloroform-, and Propylene Glycol Dipelargonat-Water Partitioning of Morphine-6-glucuronide and Other Related Opiates. In: Journal of Medicinal Chemistry. 39, 1996, S. 4377–4381. doi:10.1021/jm960073m
- Eberhard Klaschik: Schmerztherapie und Symptomkontrolle in der Palliativmedizin. 2009, S. 233.
- P. Compton, W. Ling, D. Moody, N. Chiang: Pharmacokinetics, bioavailability and opioid effects of liquid versus tablet buprenorphine. In: Drug Alcohol Depend. Band 82, Nr. 1, 2006, S. 25–31, PMID 16144748.
- E. C. Strain, D. E. Moody, K. B. Stoller, S. L. Walsh, G. E. Bigelow: Relative bioavailability of different buprenorphine formulations under chronic dosing conditions. In: Drug Alcohol Depend. Band 74, Nr. 1, 2004, S. 37–43, PMID 15072805.
- A. Elkader, B. Sproule: Buprenorphine: clinical pharmacokinetics in the treatment of opioid dependence. In: Clin Pharmacokinet. Band 44, Nr. 7, 2005, S. 661–680, PMID 15966752.
- K. E. Thummel, G. R. Wilkinson: In vitro and in vivo drug interactions involving human CYP3A. In: Annu. Rev. Pharmacol. Toxicol. Band 38, 1998, S. 389–430, doi:10.1146/annurev.pharmtox.38.1.389, PMID 9597161.
- Fachinformation Subutex Sublingualtabletten 0,4 mg / 2 mg / 8 mg. Reckitt Benckiser. Stand: Juli 2010.
- Fachinformation Temgesic Ampullen, Sublingualtabletten, Sublingualtabletten forte. Reckitt Benckiser. Stand: Juli 2010.
- Phoebe Washington-Dorando: Kurzanleitung für Schmerztherapeutische Strategien in der ambulanten Palliativmedizin: Die patientenkontrollierte Analgesie PCA. (Memento vom 17. Juli 2007 im Internet Archive) 1. Auflage. Universitätsklinik Heidelberg, 2003.
- Ravensburger Modell. (PDF) In: dgsuchtmedizin.de. Deutsche Gesellschaft für Suchtmedizin, archiviert vom Original am 10. November 2017; abgerufen am 10. November 2017.
- Richard P Mattick, Robert Ali, Jason M White, Susannah O’Brien, Seija Wolk: Buprenorphine versus methadone maintenance therapy: a randomized double-blind trial with 405 opioid-dependent patients. In: Addiction. 98(4), Apr 2003, S. 441–445. PMID 12653814.
- Warren K Bickel, Leslie Amass, John P Crean, Gary J Badger: Buprenorphine dosing every 1, 2, or 3 days in opioid-dependent patients. In: Psychopharmacology. (Berl). 146(2), Sep 1999, S. 111–120. PMID 10525745.
- X. Thirion, V. Lapierre, J. Micallef u. a.: Buprenorphine prescription by general practitioners in a French region. In: Drug Alcohol Dependence. Band 65, Nr. 2, 1. Januar 2002, S. 197–204. PMID 11772481.
- Eugen Davids, Markus Gastpar: Buprenorphine in the treatment of opioid dependence. In: European Neuropsychopharmacology. Band 14, Nr. 3, 2004, S. 209–216, doi:10.1016/S0924-977X(03)00146-9.
- Handel mit Ersatzdrogen floriert. Abgerufen am 10. November 2017.
- Subutex-Schwarzmarkt boomt. In: Nachrichten der Ortenau – Offenburger Tageblatt. (bo.de [abgerufen am 10. November 2017]).
- Matthias Bastigkeit: Sucht: Ersatzdrogen als Drogenersatz. In: Pharmazeutische Zeitung. 2007, abgerufen am 22. April 2018.
- Meeting highlights from the Committee for Medicinal Products for Human Use (CHMP) 23-26 April 2019, PM EMA vom 26. April 2019, abgerufen am 5. Mai 2019
- Opioid-Sucht: EU-Zulassungsempfehlung für Buprenorphin-Implantat, DAZ vom 29. April 2019, abgerufen am 5. Mai 2019
- J. A. Bodkin, G. L. Zornberg, S. E. Lukas, J. O. Cole: Buprenorphine treatment of refractory depression. In: Journal of clinical psychopharmacology. Band 15, Nummer 1, Februar 1995, S. 49–57, PMID 7714228.
- H. M. Emrich, P. Vogt, A. Herz: POSSIBLE ANTIDEPRESSIVE EFFECTS OF OPIOIDS: ACTION OF BUPRENORPHINE. In: Annals of the New York Academy of Sciences. 398, 1982, S. 108, doi:10.1111/j.1749-6632.1982.tb39483.x.
- H. M. Emrich: Endorphins in psychiatry. In: Psychiatric developments. Band 2, Nummer 2, 1984, S. 97–114, PMID 6091098.
- P. W. Nyhuis, M. Gastpar: Opiate treatment in ECT-resistant depression. In: Pharmacopsychiatry. 38, 2005, doi:10.1055/s-2005-918797.
- Alkermes plc: Alkermes Submits New Drug Application To U.S. FDA For ALKS 5461 For The Adjunctive Treatment Of Major Depressive Disorder. Abgerufen am 4. März 2018 (englisch).
- M. A. Russo, J. Wasiak: A clinical snapshot of transdermal buprenorphine in pain management. In: Eur. J. Pain Suppl. Band 1, Nr. 1, 2007, S. 74–77, doi:10.1016/S1754-3207(08)60018-8.
- K. Anchersen, T. Clausen, M. Gossop, V. Hansteen, H. Waal: Prevalence and clinical relevance of corrected QT interval prolongation during methadone and buprenorphine treatment: a mortality assessment study. In: Addiction. 104(6), Jun 2009, S. 993–999. PMID 19392907.
- M. J. Krantz, J. A. Garcia, P. S. Mehler: Effects of buprenorphine on cardiac repolarization in a patient with methadone-related torsade de pointes. In: Pharmacotherapy. 25(4), Apr 2005, S. 611–661. PMID 15977920.
- S. Fanoe, C. Hvidt, P. Ege, G. B. Jensen: Syncope and QT prolongation among patients treated with methadone for heroin dependence in the city of Copenhagen. In: Heart. 93(9), Sep 2007, S. 1051–. PMID 17344330.
- M. Auriacombe, P. Franques, J. Tignol: Deaths attributable to methadone vs buprenorphine in France. In: JAMA. 285(1), 3 Jan 2001, S. 45.
- A. N. Katchman, K. A. McGroary, M. J. Kilborn, C. A. Kornick, P. L. Manfredi, R. L. Woosley, S. N. Ebert: Influence of opioid agonists on cardiac human ether-a-go-go-related gene K(+) currents. In: J Pharmacol Exp Ther. 303(2), Nov 2002, S. 688–694.
- K. Hardtke u. a. (Hrsg.): Kommentar zum Europäischen Arzneibuch Ph. Eur. 6.5, Buprenorphin. Loseblattsammlung, 35. Lieferung 2010, Wissenschaftliche Verlagsgesellschaft Stuttgart.
- F. v. Bruchhausen, S. Ebel, A. W. Frahm, E. Hackenthal: Hagers Handbuch der Pharmazeutischen Praxis. 5. Auflage. (Waren und Dienste), Stoffe A–D, Birkhäuser, 1995, ISBN 3-540-52688-9, S. 560.
- Römpp Lexikon Chemie. 10. Auflage. Georg Thieme Verlag, Stuttgart/ New York 1996, S. 548.
- Victor J. Hruby, Ruben Vardanyan: Synthesis of essential drugs. Elsevier, Amsterdam 2006, ISBN 0-444-52166-6, Buprenorphine, S. 36–37.
- Europäisches Arzneibuch. 6.0 Auflage. Deutscher Apotheker Verlag, Stuttgart (Deutschland) 2008, ISBN 978-3-7692-3962-1, Buprenorphinhydrochlorid, S. 1888–1889.
- Europäisches Arzneibuch. 6.5 Auflage. Deutscher Apotheker Verlag, Stuttgart (Deutschland) 2010, ISBN 978-3-7692-4918-7, Buprenorphin.
- Walter G. Guder, Jürgen Nolte: Das Laborbuch für Klinik und Praxis. Elsevier, Urban & FischerVerlag, 2005, ISBN 3-437-23340-8, Drogenanalyse („Drogenscreening“), S. 663–667.