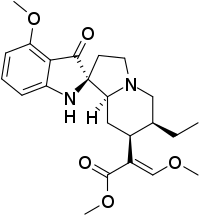
Pseudoindoxylmitragynin
Pseudoindoxylmitragynin (PIM) ist ein potentes atypisches Opioid, das schmerzstillend wirkt und ein drastisch günstigeres Nebenwirkungsprofil als herkömmliche Opioide hat. Es entsteht als metabolisches Umlagerungsprodukt aus dem Kratomalkaloid 7-Hydroxymitragynin.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Pseudoindoxylmitragynin | ||||||||||||
| Andere Namen |
Methyl-(E)-2-((1′S,6′S,7′S,8a′S)-6'-ethyl-4-methoxy-3-oxo-3',5',6',7',8',8a'-hexahydro-2′H-spiro[indolin-2,1'-indolizin]-7'-yl)-3-methoxyacrylat (IUPAC) | ||||||||||||
| Summenformel | C23H30N2O5 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| Wirkstoffklasse | |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 414,5 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Chemie
Präparativ lässt sich Pseudoindoxylmitragynin aus 7-Hydroxymitragynin durch Behandlung mit einer starken Base, z. B. Natriummethylat, darstellen.[1] Seine Molekularstruktur wurde im Jahr 1974 aufgeklärt.[3] Die Partialsynthese von umfunktionalisierten Derivaten ist bekannt.[4]
Pharmakologie
Pseudoindoxylmitragynin bildet sich im Menschen metabolisch aus 7-Hydroxymitragynin (7-HMG), und zwar in einem weit größeren Ausmaß als in anderen Säugetierarten.[5] 7-HMG ist wiederum ein Metabolit des Mitragynins. PIM erzeugt eine μ-Opioidrezeptor (MOR1) vermittelte systemische und zentrale Analgesie. Nach subkutaner Applikation ist es im Maus-Tail-Flick-Test dreimal potenter als Morphin und hat eine kürzere antinozizeptive Wirkdauer als dieses, wobei das Wirkungsmaximum nach 15 Minuten erreicht ist. Es ist peroral wirksam mit einem ED50-Wert in Mäusen von 7,5 mg/kg.[4]
Im Vergleich zu Morphin entwickelt sich eine antinozizeptive Toleranz durch PIM wesentlich langsamer. Symptome einer körperlichen Abhängigkeit zeigten sich im Versuch an Mäusen kaum. Die durch PIM bewirkte Obstipation ist schwach ausgeprägt, genauso wie die Atemdepression vergleichsweise sehr gering ist. Sucht- oder Aversionsverhalten wurde durch PIM nicht erzeugt.[4]
Pharmakodynamik
Pseudoindoxylmitragynin wirkt als MOR-Agonist spezifisch über den G-Protein-Signalweg und unterscheidet sich darin von herkömmlichen Opioiden wie Morphin. PIM ist ein hochaffiner MOR1-Agonist mit Ki 0,8 nM und Emax 84 % (DAMGO als Referenz). Der analgetische Effekt wird gleich dem des Morphins vermittelt über 7TM-Exon1-MOR1. An MOR1 wirkt es als β-Arrestin2-Antagonist. Es ist ein DOR-Antagonist mit Ki 3,0 nM und ein demgegenüber moderater KOR-Antagonist mit Ki 24,0 nM.[4] MOR-DOR-Heterodimere finden sich im ZNS und haben eine Funktion in der Schmerzverarbeitung und der Opioidanalgesie.[6] Dieses Rezeptorheteromer könnte für die PIM vermittelte nebenwirkungsarme Analgesie eine Rolle spielen.
Eine Untersuchung von Struktur-Wirkungsbeziehungen ergab weitere analgetisch wirksame, an der Molekülposition C-9[7] derivatisierte Analoga.[4]
Einzelnachweise
- Takayama H, Ishikawa H, Kurihara M, et al.: Studies on the synthesis and opioid agonistic activities of mitragynine-related indole alkaloids: discovery of opioid agonists structurally different from other opioid ligands. In: J Med Chem. 45, Nr. 9, 2002, S. 1949–56. doi:10.1021/jm010576e. PMID 11960505.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Zarembo JE, Douglas B, Valenta J, Weisbach JA: Metabolites of mitragynine. In: J Pharm Sci. 63, Nr. 9, 1974, S. 1407–15. doi:10.1002/jps.2600630916. PMID 4473532.
- Váradi A, Marrone GF, Palmer TC, et al.: Mitragynine/Corynantheidine Pseudoindoxyls As Opioid Analgesics with Mu Agonism and Delta Antagonism, Which Do Not Recruit β-Arrestin-2. In: J Med Chem. 59, Nr. 18, 2016, S. 8381–97. doi:10.1021/acs.jmedchem.6b00748. PMID 27556704. PMC 5344672 (freier Volltext).
- Kamble SH, León F, King TI, Berthold EC, Lopera-Londoño C, Siva Rama Raju K, Hampson AJ, Sharma A, Avery BA, McMahon LR, McCurdy CR: Metabolism of a Kratom Alkaloid Metabolite in Human Plasma Increases Its Opioid Potency and Efficacy. In: ACS Pharmacol Transl Sci. 3, Nr. 6, 2020, S. 1063–1068. doi:10.1021/acsptsci.0c00075. PMID 33344889.
- Zhang L, Zhang JT, Hang L, Liu T: Mu Opioid Receptor Heterodimers Emerge as Novel Therapeutic Targets: Recent Progress and Future Perspective. In: Front Pharmacol. 11, 2020, S. 1078. doi:10.3389/fphar.2020.01078. PMID 32760281. PMC 7373791 (freier Volltext).
- Lokant hier gemäß CAS, Position 4 gemäß IUPAC