Lofentanil
Lofentanil ist eine synthetisch hergestellte chemische Verbindung aus der Gruppe der Opioide mit hoher Wirksamkeit als Schmerzmittel. Es wurde 1975 durch die Forschungslabors der Janssen Pharmaceutica entwickelt und leitet sich ursprünglich von Fentanyl ab. Die analgetische Wirkung entspricht etwa dem 6000-fachen der von Morphin.[2]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
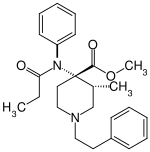 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Lofentanil | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C25H32N2O3 | |||||||||||||||
| Kurzbeschreibung |
weißes, geruchloses Pulver (Lofentanil-Hydrogenoxalat)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 408,53 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Hintergrund und Entwicklung
Untersuchungen der Zusammenhänge von chemischer Struktur und biologischer Wirkung zeigten Anfang der 70er Jahre, dass beim Fentanyl die Einführung einer 3-Methylgruppe die Potenz um das bis zu 19-fache [(+)-cis-3-Methylfentanyl] steigert. Abgesehen von der beachtlichen Steigerung der Potenz wurden andere pharmakologische Eigenschaften weniger stark verändert. Einzig die Wirkungsdauer von 3-Methylfentanyl ist deutlich länger und liegt zwischen Fentanyl und Morphin. Auch der Therapeutische Index (Sicherheitsbreite) von 3-Methylfentanyl ist höher als jener von Fentanyl (1662 : 255). Die Ergebnisse wurden in den Jahren 1973 und 1974 publiziert.
Die Erkenntnisse wurden anschließend auf Carfentanil übertragen: Die Einführung einer 3-Methylgruppe in das Carfentanil-Molekül führt zu vier Isomeren (je zwei optisch aktive cis- und trans-Isomere), die sich signifikant in ihrer Aktivität unterscheiden und getrennt einem pharmakologischen Screening unterzogen wurden. Als potentestes und wirksamstes Isomer wurde (−)-cis-3-Methylcarfentanil identifiziert, das zunächst unter der Nummer R 34995 lief und den Namen LOFENTANIL erhielt. Die erstmalige Erwähnung dieser Substanz in der wissenschaftlichen Literatur erfolgte zusammen mit Carfentanil und Sufentanil im Jahr 1976.
Pharmakologische Eigenschaften
Lofentanil ist ein hochlipophiles (lipophiler als Carfentanil), hochaffines, hochpotentes und extrem lang wirkendes Opioid. Beim Fentanylmolekül steigerte die Einführung einer 3-Methylgruppe die Potenz um das bis zu 19-fache [(+)-cis-3-Methylfentanyl], beim Carfentanil wird die Potenz durch die analoge Substitution leicht vermindert.
Potenz
Für razemisches (±)-cis-3-Methylcarfentanil (R 32792) wird die 0,5–0,7-fache Potenz von Carfentanil und die 4600–5600-fache Morphinpotenz angegeben. Lofentanil (R 34995) ist etwa 1,2-mal potenter als razemisches (±)-cis-3-Methylcarfentanil (R32792) und 5500–6500-mal potenter als Morphin.[5][4] Die Schwellendosis von Lofentanil beim Menschen, bei der erste opioidtypische Effekte wie Übelkeit, Erbrechen, Sedierung und leichte Analgesie auftreten, liegt bei intramuskulärer Injektion im Bereich von 250–750 Nanogramm.[6] Es ist etwas lipophiler als Carfentanil, der Wirkungseintritt erfolgt etwas schneller.[7]
Wirkungsdauer
Wesentlich stärker als die Potenz wird die Wirkungsdauer durch die 3-Methylgruppe beeinflusst. Lofentanil und R 32792 gehören zu den Opioiden mit der längsten Wirkungsdauer, die mit steigender Dosis drastisch auf 72 h und länger ansteigen kann.
Wirkungsdauer bei 4 × ED50: R 32792 > 8 h, Morphin = 2,61 h, Carfentanil = 1,55 h.[4]
Die lange Wirkungsdauer resultiert aus den Bindungseigenschaften und der großen metabolischen Stabilität. Der Lofentanil-µ-Rezeptor-Komplex zeigt eine sehr hohe Stabilität und dissoziiert in Gegenwart großer Mengen Dextromoramid nur sehr langsam. Die µ-Bindungsaffinität wird durch Natrium-Ionen nicht vermindert (unüblich für Opioid-Agonisten; vgl. „Natrium-Index“ von Opioid-Agonisten, Partialagonisten und Antagonisten).[8]
Toxizität und Therapeutischer Index (Sicherheitsbreite)
Auch die Toxizität (Wirkung auf das Atemzentrum) steigt stark an. LD50-Werte: Morphin = 223 mg/kg, Carfentanil = 3,4 mg/kg, R 32792 = 0,2 mg/kg, Lofentanil = 0,066 mg/kg.[4][7]
Folgende Therapeutische Indizes wurden aus Tierversuchen berechnet: Morphin = 69; Lofentanil (R 34995) = 112; Fentanyl = 282; R 32792 ("raz.-Lofentanil") = 285;
(+)-cis-3-Methylfentanyl = 1662; Carfentanil = 10.000.
Rezeptorselektivität
Im Gegensatz zu Carfentanil (ein selektiver µ-Agonist) handelt es sich bei Lofentanil um einen unselektiven Opioidrezeptor-Agonisten, der mit hoher Affinität an den µ-Rezeptor, aber auch signifikant an δ- und κ-Rezeptoren bindet.[9]
Tabelle: Bindungsaffinität (Ki [nM]) von Lofentanil an Opioidrezeptoren im Vergleich mit anderen Fentanyl-Derivaten
| Substanz | µ (DAGO) | δ (DPDPE) | κ (U 69.593) |
|---|---|---|---|
| Lofentanil | 0,023 | 0,24 | 0,60 |
| Carfentanil | 0,024 | 3,3 | 43 |
| Fentanyl | 1,2 | 180 | 290 |
| R 30490 | 0,09 | 23 | 63 |
R 30490 = 4-Methoxymethylfentanyl (Sufentanil-Analogon)
Klinische Studien mit Lofentanil
1983 wurde in einer ersten klinischen Studie (120 Patienten) Lofentanil (250, 500 und 750 Nanogramm i. m.) mit Piritramid (7,5 und 15 mg i. m.) und Placebo verglichen.[6] Im Zeitfenster von 4–6 h nach Applikation waren 15 Milligramm Piritramid bezüglich der schmerzstillenden Wirkung 750 Nanogramm Lofentanil überlegen und zeigten auch eine längere Wirkungsdauer. Die Nebenwirkungen waren in beiden Gruppen vergleichbar (Übelkeit, Erbrechen, Sedierung). 1985 wurde Lofentanil mit Buprenorphin bei postoperativen Schmerzen unter extraduraler Applikation (L3-L4) klinisch getestet.[10] 5 µg Lofentanil zeigten eine längere Wirkungsdauer (bis 72 h) und eine stärkere Wirkung als 300 µg Buprenorphin. Unmittelbar nach der Injektion von Lofentanil wurden einige Patienten schläfrig.
Bei den klinischen Studien zeigte sich, dass die Sensibilität gegenüber Lofentanil individuell sehr stark schwanken kann, was die Ermittlung geeigneter Dosen schwierig gestaltet. Aufgrund der extrem langen Wirkungsdauer und der schwierigen Antagonisierbarkeit (es sind sehr hohe und wiederholte Naloxon-Gaben notwendig) ist die Substanz für die klinische Anwendung völlig ungeeignet.
Sonstiges und Analoga
Lofentanil ist der internationale Freiname für levo-cis-3-Methylcarfentanil ((−)-cis-3-Methylcarfentanil). Allerdings wurde in der Literatur offensichtlich manchmal auch razemisches (±)-cis-3-Methylcarfentanil als Lofentanil bezeichnet. Da in einigen Fällen nicht hervorgeht, ob es sich um razemische oder optisch aktive Substanz handelt, sind Dosisangaben und Angaben zur Potenz daher mit gewisser Zurückhaltung zu diskutieren. (+)-cis-3-Methylcarfentanil (R 34994, das Enantiomer zu Lofentanil) hat im Gegensatz zu Lofentanil nur eine sehr geringe Potenz (ED50 = 2,2 mg/kg und eine kurze Wirkungsdauer (bei 2 × ED50: 30 min); zum Vergleich Fentanyl = 0,011 mg/kg, Lofentanil = 0,00059 mg/kg, Carfentanil = 0,00032 mg/kg) und zeigt sogar teilweise antagonistische Eigenschaften (Partialagonist). Beispielsweise antagonisiert (+)-cis-3-Methylcarfentanil eine durch Fentanyl induzierte Atemdepression bei Ratten mit einer ED50 von 0,45 mg/kg (Naloxon: 0,03 mg/kg).[8]
(±)-trans-3-Methylcarfentanil (R 32812) hat Angaben von Janssen zufolge nur 1/15 der Potenz von (±)-cis-3-Methylcarfentanil und etwa die 1,3-fache Fentanyl-Potenz. Chinesischen Untersuchungen zufolge ist (±)-trans-3-Methylcarfentanil (R 32812) dagegen 0,85-mal so potent wie (±)-cis-3-Methylcarfentanil.[11]
Da sich eine Kombination aus cis-3-Methylgruppe und β-Hydroxygruppe beim Fentanyl extrem stark auf die Potenz auswirkte (Ohmefentanyl), wurden vom 3-Methylcarfentanil ebenfalls einige β-Hydroxy-Isomere und Analoga untersucht. β-Hydroxy-cis-3-methylcarfentanil (keine weiteren Angaben zur Konfiguration, vermutlich Isomerengemisch) hat chinesischen Angaben zufolge etwa die 2-fache Potenz von (±)-cis-3-Methylcarfentanil und die 1,3-fache Potenz von Carfentanil (Maus, hot plate, i.p.).[11] Das National Institute on Drug Abuse (NIDA) gibt dagegen die 0,7-fache Carfentanil-Potenz an (Maus, hot plate, i.v.). Wirkungseintritt und Wirkungsdauer sollen ähnlich Morphin sein. Die Substitutionspotenz beim opioidabhängigen Affen beträgt das 6000-fache des Morphins und damit etwa 1/4 des Carfentanils.[12] Der Analoge Ethylester ((±)-cis-Ethyl{3-methyl-4-[N-(1-oxopropyl)-N-phenylamino]-1-(2-hydroxy-2-phenylethyl)-piperidine-4-carboxylat}) hat beim Affen die 30000-fache Morphinpotenz (Substitution), erreicht bei Mäusen aber je nach Testmethode maximal nur die 2900-fache Morphinpotenz.[13][14]
Ersatz der Propionylgruppe gegen einen Cyclopropancarbonyl-Rest im R 32792 steigert die analgetische Potenz um den Faktor 1,2 (Maus, hot plate, i.p.).[11] Angaben zur Wirkungsdauer und Toxizität sind nicht verfügbar. Beim Carfentanil wird durch eine analoge Strukturvariation die analgetische Potenz etwas verringert, die Toxizität dagegen um das 21-fache erhöht und die Wirkungsdauer nimmt extrem zu und entspricht etwa dem Lofentanil (Ratte, tail withdrawal, i.v.).
Lofentanil war vermutlich die Substanz, mit der 1997 Mossad-Agenten ein Attentat auf den Hamas-Führer Chalid Maschal verübten, wobei ihm von hinten eine Überdosis ins Ohr gesprüht wurde. Es sind aber auch andere Fentanyl-Derivate im Gespräch wie Levofentanyl.[15] Eine Substanz mit der Bezeichnung Levofentanyl ist bei CAS allerdings nicht gelistet. Außerdem ist die Vorsilbe "Levo" an bestimmte strukturelle Voraussetzungen geknüpft, die beim Fentanyl nicht vorhanden sind. Mit Levofentanyl ist vermutlich Lofentanil (levo-cis-3-Methylcarfentanil) gemeint.
Literatur
- J. de Castro, A. Van de Water, L. Wouters, R. Xhonneux, R. Reneman, B. Kay: Comparative study of cardiovascular, neurological and metabolic side effects of 8 narcotics in dogs. Pethidine, piritramide, morphine, phenoperidine, fentanyl, R 39 209, sufentanil, R 34 995. I. Comparative study on the acute toxicity and hemodynamic effects of the narcotics in high and massive doses in curarised and mechanically ventilated dogs. In: Acta Anaesthesiologica Belgica. Band 30, Nr. 1, März 1979, ISSN 0001-5164, S. 5–54, PMID 382728.
- J. de Castro, A. Van de Water, L. Wouters, R. Xhonneux, R. Reneman, B. Kay: Comparative study of cardiovascular, neurological and metabolic side effects of 8 narcotics in dogs. Pethidine, piritramide, morphine, phenoperidine, fentanyl, R 39 209, sufentanil, R 34 995. II. Comparative study on the epileptoid activity of the narcotics used in high and massive doses in curarised and mechanically ventilated dogs. In: Acta Anaesthesiologica Belgica. Band 30, Nr. 1, März 1979, ISSN 0001-5164, S. 55–69, PMID 474064.
- J. de Castro, A. Van de Water, L. Wouters, R. Xhonneux, R. Reneman, B. Kay: Comparative study of cardiovascular, neurological and metabolic side effects of 8 narcotics in dogs. Pethidine, piritramide, morphine, phenoperidine, fentanyl, R 39 209, sufentanil, R 34 995. III. Comparative study of the acute metabolic toxicity of the narcotics used in high and massive doses in curarised and mechanically ventilated dogs. In: Acta Anaesthesiologica Belgica. Band 30, Nr. 1, März 1979, ISSN 0001-5164, S. 71–90, PMID 38620.
- J. E. Leysen, P. M. Laduron: Receptor binding properties in vitro and in vivo of some long-acting opiates. In: Archives internationales de Pharmacodynamie et de Thérapie. Band 232, Nr. 2, April 1978, ISSN 0003-9780, S. 243–246, PMID 209755.
- W. Gommeren, J. E. Leysen: Binding properties of 3H-lofentanil at the opiate receptor. In: Archives internationales de Pharmacodynamie et de Thérapie. Band 258, Nr. 1, Juli 1982, ISSN 0003-9780, S. 171–173, PMID 6291471.
- W. E. Meuldermans, R. M. Hurkmans, J. J. Heykants: Plasma protein binding and distribution of fentanyl, sufentanil, alfentanil and lofentanil in blood. In: Archives internationales de Pharmacodynamie et de Thérapie. Band 257, Nr. 1, Mai 1982, ISSN 0003-9780, S. 4–19, PMID 6214227.
- L. E. Mather: Clinical Pharmacokinetics of Fentanyl and its Newer Derivatives. In: Clinical Pharmacokinetics. Band 8, Nr. 5, Dezember 2012, S. 422–446, doi:10.2165/00003088-198308050-00004.
- T. F. Meert, H. R. Lu, H. van Craenndonck, P. A. Janssen: Comparison between epidural fentanyl, sufentanil, carfentanil, lofentanil and alfentanil in the rat: analgesia and other in vivo effects. In: European Journal of Anaesthesiology. Band 5, Nr. 5, September 1988, ISSN 0265-0215, S. 313–321, PMID 2905988.
Einzelnachweise
- D. Hank Ellison: Handbook of Chemical and Biological Warfare Agents, Second Edition. CRC Press, 2007, ISBN 978-1-4200-0329-1, S. 397 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Lofentanil. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. August 2016.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- W.F.M. Van Bever et al.: N-4-Substituted 1-(2-Arylethyl)-4-piperidinyl-N-phenylpropanamides, a Novel Series of Extremely Potent Analgesics with Unusually High Safety Margin. Arzneimittel Forsch. 1976, 26, 1548. PMID 12771.
- P.G.H. van Daele et al.: Synthetic Analgesics: N-(1-[2-Arylethyl]-4-substituted 4-Piperidinyl) N-Arylalkanamides. Arzneimittel Forsch. 1976, 26, 1521. PMID 12769.
- G. Van den Abeele, F. Camu: Clinical evaluation of the analgesic potency of lofentanil in postoperative pain. In: Acta Anaesthesiologica Belgica. Band 34, Nr. 1, 1983, ISSN 0001-5164, S. 41–47, PMID 6133403.
- H. Waldvogel: Analgetika, Antinozizeptiva, Adjuvanzien, Handbuch für die Pharmazeutische Praxis, Springer (Berlin).
- Alan F. Casy, Robert T. Parfitt: Opioid analgesics: chemistry and receptors. Plenum Press, New York 1986, ISBN 0-306-42130-5.
- Patricia Maguire, Nancy Tsai, John Kamal, Chiara Cometta-Morini, Christopher Upton, Gilda Loew: Pharmacological profiles of fentanyl analogs at μ, δ and κ opiate receptors. In: European Journal of Pharmacology. Band 213, Nr. 2, März 1992, S. 219–225, doi:10.1016/0014-2999(92)90685-W.
- P. Bilsback, G. Rolly, O. Tampubolon: Efficacy of the extradural administration of lofentanil, buprenorphine or saline in the management of postoperative pain. A double-blind study. In: British Journal of Anaesthesia. Band 57, Nr. 10, Oktober 1985, ISSN 1471-6771, S. 943–948, doi:10.1093/bja/57.10.943.
- Wen, Sujei et al.: Synthesis an Analgesic Activity of Analogs of 3-Methyl-4-methoxycarbonylfentanyl. J. China Pharm. University 1992, 23, 196.
- NIDA Res. Mon. 1995, 152, 193.
- NIDA Res. Mon. 1995, 152, 197.
- G.A. Brine et al.: Ohmefentanyl and Its Stereoisomers: Chemistry and Pharmacology. Curr. Med. Chem. 1997, 4, 247.
- Paul McGeough, Kill Khalid, Allen and Unwin 2009