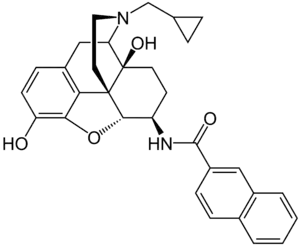
N-Naphthoyl-6β-naltrexamin
N-Naphthoyl-6β-naltrexamin (NNTA) ist ein neuartiges Opioid, dessen Struktur im Zusammenhang mit der Entwicklung hochselektiver µ-Rezeptor-Antagonisten durch Molekulare Modellierung entworfen wurde.[3] NNTA diente ursprünglich nur als Vergleichssubstanz und zeigt selbst nur eine geringe Selektivität für den µ-Rezeptor.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Name | N-Naphthoyl-6β-naltrexamin | |||||||||
| Andere Namen |
17-Cyclopropylmethyl-3,14β-dihydroxy-4,5α-epoxy-6β-[(2′-naphthoyl)amido]morphinan (IUPAC) | |||||||||
| Summenformel | C31H32N2O4 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 496,6 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Eigenschaften
NNTA aktiviert selektiv µ-k-Opioidrezeptor-Heteromere. Die Substanz unterscheidet sich deshalb in ihrem Wirkungsspektrum signifikant von klassischen µ-Agonisten wie beispielsweise Morphin, Methadon oder Fentanyl. NNTA ist ein hochpotenter Agonist – trotz des antagonistischen Strukturfragmentes (N-Cyclopropyl-Rest) – bei Zellen, die µ- und k-Opioidrezeptoren exprimieren, während es an Zellen, die nur µ-Rezeptoren exprimieren wie Naltrexon als Antagonist wirkt.[1]
Die Bindung von µ-Opioidrezeptoren an κ-Opioidrezeptoren hat einen fundamentalen Einfluss auf die Bindung von Liganden und die nach Rezeptoraktivierung ausgelösten intrazellulären biochemischen Signalkaskaden. NNTA zeigt bei Mäusen starke analgetische Wirkung und ist bei intravenöser Applikation 50 mal potenter als Morphin, aber erzeugt im Vergleich zu Morphin keine körperliche Opioid-Abhängigkeit. Ferner führt NNTA bei Mäusen nicht zur Selbstverabreichung, sondern unter höheren Dosen eher zu einer Aversion (typisch für k-Agonisten).[1] Daher wird vermutet, dass NNTA beim Menschen nicht euphorisierend, sondern unter höheren Dosen eher dysphorisierend wirkt und deshalb nicht zum Missbrauch verleitet. Ob die dysphorisierende Wirkung über µ-k-Heterodimere, homodimere k-Rezeptoren oder über andere k-Rezeptor enthaltende Heteromere ausgelöst wird, ist bisher nicht bekannt.
Biochemie
Das klassische Modell G-Protein-gekoppelter Rezeptoren basiert auf der Annahme, dass die Rezeptoren als Monomere vorkommen und die nach Bindung eines Agonisten ausgelöste Signaltransduktion in der Zelle über Monomere erfolgt. Allerdings gibt es bereits seit Mitte der 1970er/Anfang der 1980er Jahre Hinweise, dass Rezeptoren Dimere (Homomere und Heteromere) oder auch Oligomere bilden können, die ebenfalls funktionell aktiv sind (GPCR-Oligomer). Von Opioidrezeptoren sind bisher etwa 12 verschiedene Heteromere bekannt. Die Heteromerisierung kann die Bindung exogener Liganden (Agonisten, Antagonisten) an den Rezeptors beeinflussen, sowie die Kopplung des aktivierten Rezeptors zu verschiedenen intrazellulären Signalproteinen (G-Proteine, β-Arrestine). Dadurch wird die intrazelluläre Signaltransduktion und letztendlich das Wirkungsspektrum (Analgesie, Atemdepression, psychotroper Stimulus, physische Abhängigkeit u.w.) beeinflusst (funktionelle Selektivität, biased agonism).
Analoga
Das Amidfragment (Struktur des Säurerestes) beeinflusst signifikant die Bindung an den jeweiligen Rezeptor und damit die genauen biochemischen Wirkmechanismen ähnlicher Strukturen.
Ein Analogon zum NNTA, das N-Indolyl-6β-naltrexamin (INTA) wirkt offensichtlich als Agonist an µ-κ- und δ-κ-Heteromeren. Es erzeugt ebenfalls keine körperliche Abhängigkeit. Allerdings zeigten Konditionierungsversuche an Tieren (konditionierte Platzpräferenz), dass INTA offensichtlich angenehme psychische Effekte hervorruft, während NNTA eine eher aversive Reaktion auslöst. Aufgrund der Ergebnisse mit NNTA würde man bei Konditionierungsversuchen mit INTA eher eine aversive Reaktion erwarten, wenn die Heteromere unabhängig voneinander wirken. Eine mögliche Erklärung für die unterschiedliche psychotrope Wirkung von INTA im Vergleich zu NNTA könnten Rezeptor-Oligomere höherer Ordnung sein.[4]
Ein weiteres Strukturanalogon, N-Iodbenzoyl-6β-naltrexamin (IBNtxA) wirkt ebenfalls stark analgetisch und bisherigen Versuchen zufolge nicht suchterzeugend, unterscheidet sich aber von NNTA und INTA signifikant auf biochemischer Ebene. IBNtxA wirkt nicht über µ-k-Heteromere, sondern offenbar über eine 6-TM-Splice-Variante des µ-Opioidrezeptors (die Hauptform ist das 7-TM-Protein).[5][6][7] Im Gegensatz zur 7-TM-Hauptform benötigt die 6-TM-Splice-Variante offenbar einen Partner (möglicherweise β2-Adrenozeptoren), um funktionell aktiv zu werden.[8]
Einzelnachweise
- A. S. Yekkirala, M. M. Lunzer, C. R. McCurdy, M. D. Powers, A. E. Kalyuzhny, S. C. Roerig, P. S. Portoghese: N-naphthoyl-beta-naltrexamine (NNTA), a highly selective and potent activator of μ/kappa-opioid heteromers. In: Proceedings of the National Academy of Sciences. Band 108, Nummer 12, März 2011, S. 5098–5103, doi:10.1073/pnas.1016277108, PMID 21385944, PMC 3064379 (freier Volltext).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Li G., Aschenbach L.C., Chen J., Cassidy M.P., Stevens D.L., Gabra B.H., Selley D.E., Dewey W.L., Westkaemper R.B., Zhang Y: Design, synthesis, and biological evaluation of 6alpha- and 6beta-N-heterocyclic substituted naltrexamine derivatives as mu opioid receptor selective antagonists. In: J. Med. Chem. Band 52, Nr. 5, 2009, S. 1416–1427, PMID 19199782.
- M.Le Naour, M.M.Lunzer, M.D.Powers, A.E.Kalyuzhny, M.A.Benneyworth, M.J.Thomas, P.S.Portoghese: Putative Kappa Opioid Heteromers As Targets for Developing Analgesics Free of Adverse Effects. In: J. Med. Chem. Band 57, Nr. 15, 2014, S. 6383–6392, PMID 24978316.
- S.G. Grinnell, S.Majumdar, A. Narayan, V. Le Rouzic, M. Ansonoff, J.E. Pintar, G.W. Pasternak: Pharmacologic characterization in the rat of a potent analgesic lacking respiratory depression, IBNtxA. In: J. Pharmacol. Exp. Ther. Band 350, Nr. 3, 2014, S. 710–718, PMID 24970924.
- S. Majumdar, S. Grinnell, V. Le Rouzic, M. Burgman, L. Polikar, M. Ansonoff, J. Pintar, Y.X. Pan, G.W. Pasternak: Truncated G protein-coupled mu opioid receptor MOR-1 splice variants are targets for highly potent opioid analgesics lacking side effects. In: PNAS. Band 108, Nr. 49, 2011, S. 19778–19783, PMID 22106286.
- Z. Lu, J. Xu, G.C. Rossi, S. Majumdar, G.W. Pasternak, Y.X. Pan: Mediation of opioid analgesia by a truncated 6-transmembrane GPCR. In: J. Clin. Invest. Band 125, Nr. 7, 2015, S. 2626–2630, PMID 26011641.
- Samoshkin A, Convertino M, Viet CT, et al.: Structural and functional interactions between six-transmembrane μ-opioid receptors and β2-adrenoreceptors modulate opioid signaling. In: Scientific Reports. Nr. 5:18198, 2015, doi:10.1038/srep18198, PMC 4676002 (freier Volltext).