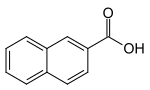
2-Naphthoesäure
2-Naphtoesäure, auch β-Naphthoesäure, gehört zu den Naphthalinderivaten. Diese kommen im Steinkohleteer vor. Sie gehören zur Stoffklasse der kondensierten aromatischen Kohlenwasserstoffe. Diese absorbieren Licht im UV-Bereich und zeigen Fluoreszenz. 2-Naphthoesäure ist isomer zu 1-Naphthoesäure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Naphthoesäure | ||||||||||||||||||
| Andere Namen |
β-Naphthoesäure | ||||||||||||||||||
| Summenformel | C11H8O2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 172,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,08 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung
2-Naphthoesäure kann aus Tetracen-5,12-dion[2] durch Hydrolyse mit KOH synthetisiert werden.[3]
Eine weitere gängige Methode ist die Synthese von 2-Napthoesäure aus Naphthalin: Der erste Schritt ist die Darstellung eines Ketons durch Friedel-Crafts-Acylierung. Eine anschließende Haloformreaktion ist eine präparativ nützliche Methode für die Oxidation des Methylketons zur Carbonsäure.[4]
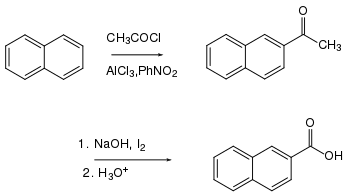
Die Herstellung der 2-Naphthoesäure durch Oxidation von 2-Methylnaphthalin ist nicht möglich, da der substituierte Ring leichter oxidierbar ist als die Seitenkette. Bei der elektrophilen Subsitution von Naphthalin ist normalerweise die α-Position bevorzugt.
Eigenschaften
Es handelt sich um einen farblosen Feststoff.
- 1H-NMR: 10,05 ppm
- 13C-NMR: 127,5; 127,8; 128,4 ppm
- Massenspektrometrie: m/z 127, 155, 172.
Verwendung
Man nutzt sie als Grundstoff bei der Herstellung von Pigmenten, Farbstoffen und Pharmazeutika.
Säurestärke (pKS-Werte) der Singulett- und Triplettzustände
Aus der pH-abhängigen Absorption und Fluoreszenz der 2-Naphtoesäure lässt sich, nach Betrachtung des thermodynamischen Gleichgewichts der undissoziierten Säure und des Säureanions, der pKS-Wert im jeweiligen Energiezustand berechnen:
| pKS0 | pKS1 | pKT1 | pKT1 |
| 4,2 | 10–12 | 4,0 | 4,2 |
Die pKS-Werte sind durch Fluoreszenz- und Phosphoreszenzmessung ermittelt worden. Dabei zeigt sich, dass der S1-Zustand stärker basisch ist als der Grundzustand S0.[5]
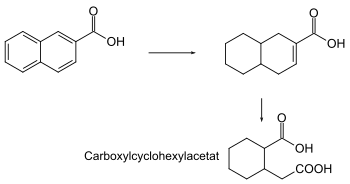
Schadstoffabbau
Der Naphthoesäureabbau erfolgt durch Reduktion mit Hilfe von Mikroorganismen unter anaeroben Bedingungen:[6]
Literatur
- A. Streitwieser, C.H. Heathcock: Organische Chemie. Wiley-VCH, Weinheim u. a. 1986, ISBN 3-527-25810-8.
- K. Peter C. Vollhardt: Organische Chemie. VCH, Weinheim u. a. 1990, ISBN 3-527-26912-6.
Einzelnachweise
- Datenblatt 2-Naphthoic acid, 98+% bei AlfaAesar, abgerufen am 27. November 2017 (PDF) (JavaScript erforderlich).
- Externe Identifikatoren von bzw. Datenbank-Links zu Tetracen-5,12-dion: CAS-Nummer: 1090-13-7, EG-Nummer: 214-127-6, ECHA-InfoCard: 100.012.843, PubChem: 14160, ChemSpider: 13534, Wikidata: Q27122531.
- Siegmund Gabriel, Ernst Leupold: Umwandlungen des Aethindiphtalids. II. In: Berichte der deutschen chemischen Gesellschaft. 31, 1898, S. 1272–1286, doi:10.1002/cber.18980310204.
- H. Meislich, H. Nechamkin, J. Sharefkin: Organische Chemie. Schaum, Mc Graw Hill Book Company 1980, ISBN 0-07-092028-2, S. 394.
- Jürgen Kiefer, J. Bensel: Ultraviolette Strahlen. W. de Gruyter, 1977, ISBN 3-11-082276-8, S. 361.
- Thomas Held: In Situ Verfahren zur Boden- und Grundwassersanierung. Wiley, ISBN 978-3-527-68183-9.
