Natriumnaphthalid
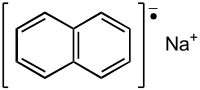
Natriumnaphthalid ist ein 1:1-Ionenpaar aus dem Natrium-Kation und dem Naphthalin-Radikalanion, das durch seine dunkelgrüne Farbe in Substanz und in Lösung charakterisiert ist. Wegen der Instabilität der Festsubstanz und seiner Unbeständigkeit gegenüber Luft und Feuchtigkeit muss Naphthalin-Natrium in einem geeigneten Lösungsmittel, wie z. B. Tetrahydrofuran THF oder Ethylenglycoldimethylether Glyme frisch hergestellt werden.[1][3] Als Radikalanion findet Naphthalin-Natrium Anwendungen als Base und Reduktionsmittel[4] und – ähnlich wie lithiumorganische Verbindungen wie z. B. Butyllithium – als Initiator für die anionische Polymerisation.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumnaphthalid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H8Na | ||||||||||||||||||
| Kurzbeschreibung |
dunkelgrüne Lösung[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 151,16 | ||||||||||||||||||
| Aggregatzustand |
flüssig (Lösung in Ethern) | ||||||||||||||||||
| Löslichkeit |
löslich in Ethern, außer in Diethylether[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
Bereits im Jahr 1914 fanden Wilhelm Schlenk und Mitarbeiter, dass der tricyclische Aromat Anthracen in Diethylether mit metallischem Natrium zu dem blauen Natriumanthracenid[5] reagiert, nicht jedoch das bicyclische Naphthalin zum entsprechenden Natriumnaphthalid.[1] Werden jedoch zu einer Lösung von Naphthalin in trockenem Ethylenglycoldimethylether unter trockener Stickstoffatmosphäre bei Temperaturen zwischen −10 und +30 °C blanke Stücke von Natrium gegeben und 2 h gerührt, dann entsteht eine dunkelgrüne Lösung von Naphthalin-Natrium.[1]
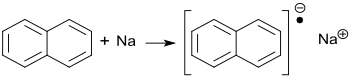
Auch in THF entsteht Natriumnaphthalid in quantitativer Ausbeute,[6] wobei Ether wie THF und Glyme das gebildete Ionenpaar solvatisieren.[7]
Eigenschaften
Natriumnaphthalid bildet in THF, Glyme und Dioxan dunkelgrüne (Absorptionsmaxima λmax bei 463 und 735 nm) und elektrisch leitende Lösungen, aus denen beim Entfernen des Lösungsmittels ein tiefgrüner Feststoff entsteht, der sich spontan in Naphthalin und metallisches Natrium zersetzt.[8] Das zusätzliche Elektron im Radikalanion C10H8•− wird in das niedrigste unbesetzte π-Molekülorbital aufgenommen und ist über alle Ringatome des Naphthalins delokalisiert.
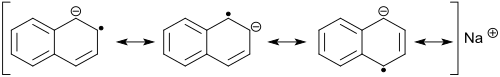
Der Radikalcharakter des Natriumnaphthalids mit einem Landé-Faktor g = 2 für reinen Spindrehimpuls zeigt sich in einem starken Elektronenspinresonanz (ESR)-Signal mit einem Redoxpotential von ca. −2,5 Volt gegenüber einer Normalwasserstoffelektrode NHE.[9]
An der Luft wird Natriumnaphthalid rasch entfärbt.[3]
Mit Wasser reagiert Natriumnaphthalid als starke Base unter Bildung von Wasserstoff zu Natriumhydroxid NaOH und dem Hydrierungsprodukt Dihydronaphthalin C10H10.
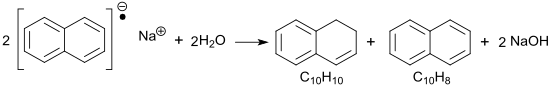
Mit anderen OH-aziden, wie z. B. Alkoholen, oder CH-aziden Verbindungen, wie z. B. Acetylen, werden analog Dihydronaphthalin und Natriumalkoholate bzw. Natriumacetylid gebildet.[1]
Daher muss Herstellung und Handhabung von Natriumnaphthalid unter striktem Sauerstoff- und Wasserausschluss stattfinden.
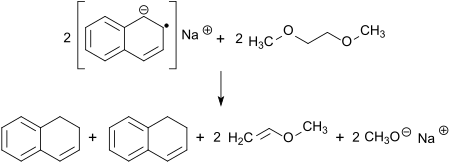
Da in Ethylenglycoldimethylether gelöstes Naphthalin-Natrium allmählich auch das Lösungsmittel unter Bildung von Dihydronaphthalin und Methylvinylether angreift, sollte die Verbindung stets frisch (am besten in THF) hergestellt werden.[1]
Anwendungen
Die ausgeprägte Basizität des Natriumnaphthalids kann zur Abstraktion von Protonen in α-Stellung CH-azider Nitrile genutzt werden, die in hoher Ausbeute mit Alkylhalogeniden alkyliert werden können.[10]
In ähnlicher Weise abstrahiert Natriumnaphthalid von 2-Mercaptobenzimidazol in der Thiolform Protonen und das Anion reagiert quantitativ mit Alkylhalogeniden, z. B. Benzylchlorid (R = Benzyl) zu 1-Benzyl-2-benzylthiobenzimidazol.[11]
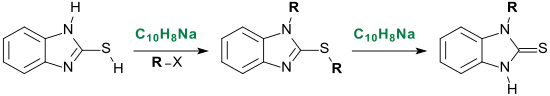
Zugabe von weiterem Natriumnaphthalid erzeugt daraus 1-Benzylbenzimidazolin-2-thion in 93%iger Ausbeute.
Die hohe Reaktivität von Natriumnaphthalid gegenüber organischen Halogenverbindungen wird durch die praktisch vollständige Dechlorierung (99,5 %) polychlorierter Biphenyle bei 22 °C innerhalb von 15–30 Minuten unter Beweis gestellt.[12]
Auch perfluorierte Oberflächen, wie z. B. von Polytetrafluorethylen PTFE (Teflon®), werden von Naphthalin-Natrium in Glymes [H3C(OCH2CH2)nOCH3 mit n = 1, 2 oder 4][13] schnell unter Braun- bis Schwarzfärbung und Ausbildung von Doppelbindungen und Sauerstofffunktionen, wie C=O- und OH-Gruppen, angegriffen bzw. angeätzt (engl. etching). Dadurch wird die Oberfläche benetzbar und lässt sich mit anderen Materialien verbinden bzw. verkleben.
Eine interessante Anwendung von Natriumnaphthalid stellt die stereoselektive Umwandlung von Geraniol in Linalool dar. Zunächst wird mittels einer Sharpless-Epoxidierung mit Vanadylacetylacetonat / tert-Butylhydroperoxid das Geraniol zum 2,3-Epoxygeraniol oxidiert[14], dann die Hydroxygruppe durch eine Mesylgruppe geschützt und anschließend der reduktiven Spaltung des Epoxids mit Eliminierung der Mesylgruppe zum Linalool unterworfen.[15]

Die Gesamtausbeute über alle drei Stufen beträgt 73 %.
Wie die Mesylgruppe können auch andere Schutzgruppen, wie z. B. die Benzylgruppe oder Tosylgruppe,[16] unter milden Bedingungen quantitativ mittels Natriumnaphthalid, z. B. aus geschütztem (−)-Menthol, entfernt werden.
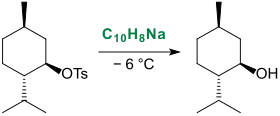
Natriumnaphthalid in THF eignet sich als Initiator für die anionische lebende Polymerisation von Vinylmonomeren wie Styrol zu Polystyrol.[17]
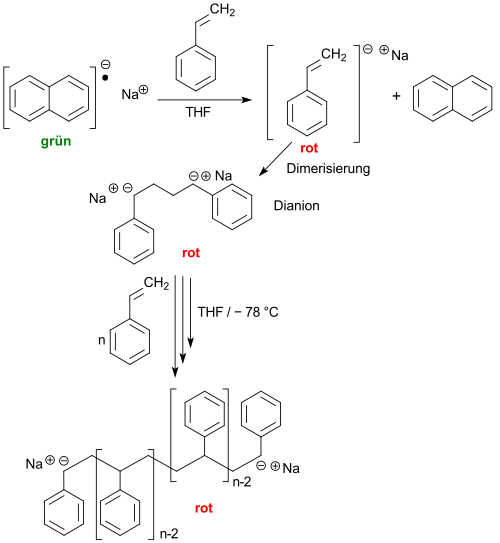
Das initial gebildete rote Styrolradikalanion dimerisiert zu einem Dianion, das durch Anlagerung weiterer Styrolmonomerer an beide Kettenenden wächst, ohne dass Kettenabbruch- oder -übertragungsreaktionen stattfinden.[18] Die erhaltenen Polymeren zeichnen sich durch eine enge Molmassenverteilung und – im Fall von Blockcopolymeren AnBm – definierte Sequenzlängen n und m aus.
Einzelnachweise
- N.D. Scott, J.F. Walker, V.S. Hansley: Sodium Naphthalene. I. A New Method for the Preparation of Addition Compounds of Alkali Metals and Polycyclic Aromatic Hydrocarbons. In: J. Am. Chem. Soc. Band 58, Nr. 12, 1936, S. 2442–2444, doi:10.1021/ja01303a022.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Vorversuch: Darstellung von Natrium-Naphthalid (NaC10H8). Universität Wuppertal, abgerufen am 8. Februar 2020.
- G.A. Molander, C.R. Harris: Sodium Naphthalenide. In: e-EROS Encyclopedia Of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rs091.
- W. Schenk, J. Appenroth, A. Michael, A. Thal: Über Metalladditionen an mehrfache Bindungen. In: Ber. dtsch. chem. Ges. Band 47, Nr. 1, 1914, S. 473–490, doi:10.1002/cber.19140470177.
- J.J. Zuckerman (Hrsg.): Inorganic Reactions and Methods, Volume 11. VCH Verlagsgesellschaft mbH, Weinheim 1988, ISBN 0-89573-250-5, S. 162.
- N.G. Connelly, W.E. Geiger: Chemical redox agents for organometallic chemistry. In: Chem. Rev. Band 96, Nr. 2, 1996, S. 877–910, doi:10.1021/cr940053x.
- H.C. Wang, G. Levin, M. Swarc: Production of hydrogen from interaction of an anion radical and water. Comment. In: J. Am. Chem. Soc. Band 100, Nr. 12, 1978, S. 3969–3969, doi:10.1021/ja00480a074.
- N.G. Connelly, W.E. Geiger: Chemical Redox Agents for Organometallic Chemistry. In: Chem. Rev. Band 96, 1996, S. 877–910, doi:10.1021/cr940053x.
- Leopold Horner, H. Güsten: Naphthalinnatrium als reaktionsfähiges Metallierungsmittel. In: Justus Liebigs Ann. Chem. Band 652, Nr. 1, 1962, S. 99–107, doi:10.1002/jlac.19626520114.
- T.R. Lee, K. Kim: A facile one pot synthesis of 1-alkylbenzimidazoline-2-thione. In: J. Heterocycl. Chem. Band 26, Nr. 3, 1989, S. 747–751, doi:10.1002/jhet.5570260344.
- J.G. Smith, G.L. Bubbar: The chemical destruction of polychlorinated biphenyls by sodium naphthalenide. In: J. Chem. Tech. Biotechnol. Band 30, Nr. 1, 1980, S. 620–625, doi:10.1002/jctb.503300181.
- FluoroEtch® Safety Solvent. Acton Technologies, Inc., 21. Juli 2016, abgerufen am 12. Februar 2020.
- Barry Sharpless, R.C. Michaelson: High stereo- and regioselectivities in the transition metal catalyzed epoxidations ob olefinic alcohols by tert-butyl hydroperoxide. In: J. Am. Chem. Soc. Band 95, Nr. 18, 1973, S. 6136–6137, doi:10.1021/ja00799a061.
- A. Yasuda, H. Yamamoto, Hitoshi Nozaki: A stereoselective 1,3-transposition of allyllic alcohols. In: Tetrahedron Lett. Band 17, Nr. 30, 1976, S. 2621–2621, doi:10.1016/S0040-4039(00)91750-7.
- W.D. Closson, P. Wriede, S. Bank: Reductive cleavage of toluenesulfonates with sodium naphthalene. In: J. Am. Chem. Soc. Band 88, Nr. 7, 1966, S. 1581–1583, doi:10.1021/ja00959a067.
- Michael Szwarc, M. Levy, R. Milkovic: Polymerization initiated by electron transfer to monomer. A new method of formation of block copolymers. In: J. Am. Chem. Soc. Band 78, Nr. 11, 1956, S. 2656–2657, doi:10.1021/ja01592a101.
- K. Matyjaszewski, A.E.H. Müller (Hrsg.): Controlled and living polymerizations: from mechanisms to applications. Wiley-VCH, Weinheim 2009, ISBN 978-3-527-32492-7.