Diastereomer
Diastereomere sind Stereoisomere (chemische Verbindungen gleicher Konstitution aber unterschiedlicher Konfiguration), welche sich – im Gegensatz zu Enantiomeren – nicht wie Bild und Spiegelbild verhalten.[1] Diastereomere können sowohl chiral als auch achiral sein. In der Regel unterscheiden sich Diastereomere in physikalischen (Schmelzpunkt, Siedepunkt, Löslichkeit, NMR-Spektrum, IR-Spektrum usw.) und chemischen Eigenschaften voneinander.
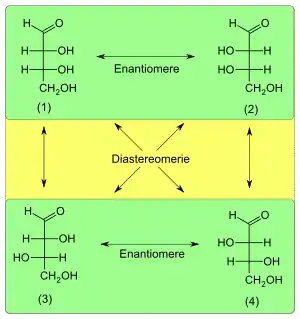
Diastereomerie aufgrund mehrerer Stereozentren

Die Mesoform ist ein Diastereomer von D- und L-Weinsäure.
Zwischen zwei molekularen Verbindungen mit gleicher Konstitution und mehreren Stereozentren liegt Diastereomerie vor, wenn sie sich in mindestens einem, jedoch nicht in allen Stereozentren unterscheiden (Beispiel: die Zucker D-Glucose und L-Galactose, die sich in drei von vier Stereozentren unterscheiden).
- Unterscheiden sich die beiden Verbindungen in genau einem Stereozentrum, wird diese Diastereomerie auch Epimerie genannt (Beispiel: D-Glucose und D-Galactose).
- Ist die Konfiguration in allen Stereozentren zwischen den Verbindungen unterschiedlich, liegt Enantiomerie vor, die nicht zur Diastereomerie gezählt wird (Beispiel: D-Glucose und L-Glucose).
Ursache der Chiralität in einem Molekül sind meist substituierte Kohlenstoff-Atome, die vier unterschiedliche Reste tragen. An einem solchen Stereozentrum sind, bedingt durch die tetraedrische Struktur des C-Atoms, jeweils zwei Konfigurationen möglich, die auch durch Drehung nicht zur Deckung gebracht werden können. Enthält eine Verbindung n derartig substituierte Kohlenstoffatome (also n Stereozentren), so können maximal 2n Konfigurationsisomere existieren. Konfigurationsisomere, bei denen sich alle asymmetrischen Kohlenstoffatome unterscheiden, sind Enantiomere, von denen es 2n/2 Paare gibt. Sind die Stereozentren in einem Molekül gleichartig, so liegt eine Spiegelebene im Molekül vor und die Zahl der Konfigurationsisomere ist kleiner, da auch meso-Verbindungen vorliegen (vgl. zweite Abbildung). Diastereomere sind meistens optisch aktiv, meso-Verbindungen jedoch achiral.
Anders als Diastereomere haben Enantiomere identische physikalische Eigenschaften, unterscheiden sich jedoch im Vorzeichen ihres Drehwerts [(+) oder (−)], in ihren chemischen Eigenschaften gegenüber anderen chiralen Molekülen und damit auch in ihren physiologischen Eigenschaften.
Diastereomerie aufgrund von Doppelbindungen
(Z)-(E)-Isomerie (auch cis-trans-Isomerie) zählt zur Diastereomerie und tritt durch die Starrheit von Doppelbindungen aufgrund von π-Bindungen auf. Doppelbindungen und damit die gebundenen Gruppen sind nicht frei drehbar. So existieren unterschiedliche räumliche Anordnungen. Beispiele sind die cis-trans-Isomerie von Alkenen.
Diastereomerie bei cyclischen Verbindungen
endo-exo-Isomerie ist eine Diastereomerie, die bei substituierten verbrückten bicyclischen Kohlenwasserstoffen auftritt.
Auch bei unverbrückten bicyclischen Kohlenwasserstoffen (z. B. bei cis- und trans-Decalin) und bei substituierten monocyclischen Verbindungen (z. B. bei 1,2-Dichlorcyclopentan) tritt Diastereomerie auf; diese beiden Fälle werden häufig als cis-trans-Isomerie betrachtet, vgl. oben den Abschnitt Diastereomerie aufgrund von Doppelbindungen.
Diastereoselektivität
Chirale Moleküle differenzieren gegenüber anderen chiralen Molekülen zwischen den möglichen Enantiomeren. Das liegt daran, dass zwei verschiedene chirale Moleküle in einem diastereomeren Verhältnis zueinander stehen. Diastereoselektivität tritt in einer chemischen Reaktion sowohl zwischen zwei chiralen Edukten (oder Reagenzien) als auch zwischen einem chiralen und einem prochiralen oder achiralen Edukt auf, so dass auf der Produktseite ein Enantiomer bevorzugt wird. Eine einmal vorhandene Chiralität setzt sich somit in Folgesystemen fort.
Bei diastereoselektiven Reaktionen haben die verschiedenen Übergangszustände von Enantiomeren auch unterschiedliche physikalische Eigenschaften, woraus sich letztlich die Selektivität ergibt. Enantioselektive Synthesen beruhen letztlich immer auf diastereoselektiven Mechanismen, weshalb der Begriff Diastereoselektive Synthese zu bevorzugen ist.
Einzelnachweise
- Eintrag zu diastereoisomerism. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.D01679 – Version: 2.3.
Literatur
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 19. völlig neu bearbeitete Auflage. S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2.
- Hans Rudolf Christen, Fritz Vögtle: Organische Chemie. Von den Grundlagen zur Forschung. 2. Band. 2. Auflage. Otto Salle Verlag u. a., Frankfurt am Main 1996, ISBN 3-7935-5398-1.
- Karl Schwister (Hrsg.): Taschenbuch der Chemie. 4. aktualisierte Auflage. Fachbuchverlag Leipzig im Carl-Hanser-Verlag, München 2010, ISBN 978-3-446-42211-7.