Schlenk-Gleichgewicht
Das Schlenk-Gleichgewicht beschreibt das Verhalten von Grignard-Verbindungen (Magnesium-organischen Verbindungen) in der Abhängigkeit vom Lösungsmittel. Es wurde nach seinem Entdecker Wilhelm Schlenk (1879–1943) benannt, welcher einer der Pioniere auf dem Gebiet der metallorganischen Chemie war.[1]
Bedeutung
„Die Struktur des Grignard-Reagens, die noch nicht in allen Einzelheiten geklärt ist, hängt hauptsächlich von Konzentration und Lösungsmittel ab.“[2] Es werden Lösungsmittel wie z. B. Diethylether oder Tetrahydrofuran benutzt. Je zwei freie Elektronenpaare von diesen Ethermolekülen sind komplex an das Magnesium gebunden und stellen das zur Stabilität notwendige Elektronenoktett her, was in der Literatur,[3] hier am Beispiel des Tetrahydrofurans, so präsentiert wird:

Eine genauere Betrachtung führt zu einem detaillierteren Bild, dem Schlenk-Gleichgewicht: Bei der Herstellung einer Magnesium-organischen Verbindung entsteht je nach dem verwendeten Lösungsmittel und in Abhängigkeit von dessen Fähigkeiten in Bezug auf Koordination und Löslichkeiten der Reaktionsprodukte verschiedene Verbindungen. Das Schlenk-Gleichgewicht beschreibt in einfacher Weise, welche Verbindungen in welchem Lösungsmittel auftreten.[4] In folgender Abbildung wird, nach der Literatur[5], das Schlenk-Gleichgewicht beschrieben. Es herrscht ein Gleichgewicht zwischen den Formen 1a und 1b. Je nach Lösungsmittel, welches die Grignard-Verbindung in einem Komplex stabilisiert, wird Form 2a oder 2b ausgebildet.
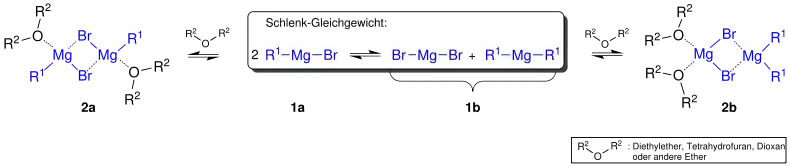
Bei geringer Konzentration des Lösungsmittels z. B. Diethylether liegt die Form 2a bevorzugt vor. Auch bei Tetrahydrofuran als Lösungsmittel wird Form 2a bevorzugt. In Triethylamin wird Form 2b vollständig ausgebildet. Im Lösungsmittel 1,4-Dioxan fällt das unlösliche Magnesiumhalogenid aus und es existiert nur das Dialkylmagnesium.[2]
Das Schlenk-Gleichgewicht wurde ebenfalls bei der Hauserbase [benannt nach Charles R. Hauser (1900–1970)] mit der Summenformel R2NMgCl beobachtet. Bei Hauserbasen handelt es sich um Grignardanaloga, bei denen der Alkylrest R− durch einen Amidsubstituenten R2N− ersetzt wurde.[6]
Einzelnachweise
- Wilhelm Schlenk, Wilhelm Schlenk jun.: Über die Konstitution der Grignardschen Magnesiumverbindungen. In: Berichte der deutschen chemischen Gesellschaft. Band 62, Nr. 4, 3. April 1929, S. 920–924, doi:10.1002/cber.19290620422 (wiley.com).
- Heinz G. O. Becker, Werner Berger, Günter Domschke, Egon Fanghänel, Jürgen Faust, Mechthild Fischer, Fritjof Gentz, Karl Gewald, Reiner Gluch, Roland Mayer, Klaus Müller, Dietrich Pavel, Hermann Schmidt, Karl Schollberg, Klaus Schwetlick, Erika Seiler, Günter Zeppenfeld: Organikum. Johann Ambrosius Barth Verlag, 1993, 19. Auflage, ISBN 3-335-00343-8, S. 563–572.
- Heinz G. O. Becker, Werner Berger, Günter Domschke, Egon Fanghänel, Jürgen Faust, Mechthild Fischer, Fritjof Gentz, Karl Gewald, Reiner Gluch, Roland Mayer, Klaus Müller, Dietrich Pavel, Hermann Schmidt, Karl Schollberg, Klaus Schwetlick, Erika Seiler, Günter Zeppenfeld: Organikum. Johann Ambrosius Barth Verlag, 1993, 19. Auflage, ISBN 3-335-00343-8, S. 564.
- Christoph Elschenbroich, Albrecht Salzer: Organometallics – A Concise Introduction. 2nd, rev. edition Auflage. Wiley-VCH, Weinheim 1995, ISBN 3-527-28164-9, S. 43–44.
- Joachim Buddrus: Grundlagen der organischen Chemie. 4., überarbeitete und aktualisierte Auflage. De Gruyter, Berlin 2011, ISBN 978-3-11-024894-4, S. 445.
- Neufeld, R.: DOSY External Calibration Curve Molecular Weight Determination as a Valuable Methodology in Characterizing Reactive Intermediates in Solution. In: eDiss, Georg-August-Universität Göttingen. 2016.