Barbier-Reaktion
Die Barbier-Reaktion,[1][2] auch Barbier-Umlagerung genannt, ist eine Namensreaktion aus dem Bereich der organischen Chemie. Sie ist benannt nach dem französischen Chemiker Philippe Antoine François Barbier (1848–1922), dem Doktorvater von Victor Grignard.[3] Sie wurde 1898, also nur zwei Jahre vor der Grignard-Reaktion, zum ersten Mal veröffentlicht.[4]
Übersicht
Die Barbier-Reaktion hat sehr weitreichende Anwendungsmöglichkeiten in der organischen Chemie, wie z. B. in der Synthese von sekundären oder tertiären Alkoholen.[4] Dabei reagiert ein mit Chlor, Brom oder Iod halogenierter organischer Rest (Alkyl-, Aryl-, Benzyl- oder Allylrest) an einer metallischen Oberfläche aus Magnesium, Lithium, Aluminium, Samarium, Antimon, Bismut, Cadmium, Gallium, Indium, Mangan, Zinn oder Zink etc. direkt in Gegenwart eines Aldehyds (R2, R3= H, Organylgruppe) oder Ketons (R2, R3= Organylgruppe) mit dessen Carbonylgruppe.[5] Die Hydrolyse führt dann zum Alkohol:

Eine aus einem Allylhalogenid frisch gebildete Grignard-Verbindung reagiert in einer Nebenreaktion mit weiterem Allylhalogenid unter Bildung von Dimeren. Die Barbier-Reaktion ist ein Weg zum Umschiffen dieses Problems:[6]

Mechanismus
Der Mechanismus wird hier exemplarisch mit Allylbromid, Propanal und metallischem Magnesium dargestellt.
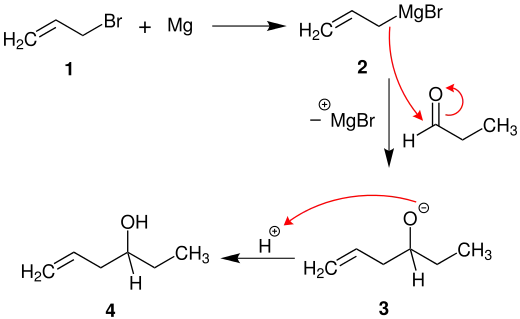
Zunächst bringt man Allylbromid (1) auf die Oberfläche des metallischen Magnesiums. Dadurch entsteht das Grignard-Reagenz Prop-1-enmagnesiumbromid (2). Dieses steht mit einer ionischen und einer radikalischen Form im Gleichgewicht (hier nicht eingezeichnet), wobei diese Formen nur einen geringen Anteil des Gleichgewichts ausmachen. Versetzt man das Grignard-Reagenz 2 nun mit Propanal, so entsteht das Hex-5-en-3-olat 3. Dieses reagiert durch sauere Aufarbeitung zu Hex-5-en-3-ol (4).
Diese Reaktion ist der Grignard-Reaktion sehr ähnlich mit dem Unterschied, dass sie eine Eintopfreaktion ist. Dies bedeutet, dass alle Reagenzien zum selben Zeitpunkt miteinander vermischt werden, man spricht auch von einer „Ein-Schritt-Reaktion“.[4] Hingegen muss bei der Grignard-Reaktion das Grignard-Reagenz zunächst in Abwesenheit des Carbonylsubstrats erzeugt werden.[7] Die Barbier-Reaktion fällt unter die Gruppe der Nukleophile Additionsreaktionen. Bei ihr kann im Gegensatz zur Grignard-Reaktion auch in wässrigen Lösungsmitteln gearbeitet werden,[4] weil die metallorganischen Zwischenstufen unempfindlich gegen protische Lösungsmittel sind. Aus diesem Grund kann man die Barbier-Reaktion der Green Chemistry zuordnen.[8] Außerdem hat sie im Gegensatz zur Grignard-Reaktion den Vorteil, dass sie mit bedeutend weniger toxischen Halogeniden dieselben Ergebnisse liefert.[9] Sie wird bevorzugt eingesetzt für die Reaktion von Allyl- oder Benzylbromiden.[4] Außerdem wird vermutet, dass sie mit einem Einzel-Elektronen-Transfer (engl. single-electron-transfer, SET) abläuft.[4]
Beispiele
Die folgenden Beispiele, soll die weiten Anwendungsmöglichkeiten der Barbier-Reaktion verdeutlichen. Die Reaktion zwischen Propargylbromid und Butanal in Gegenwart von metallischem Zink liefert ein Alkin-Derivat:[10]

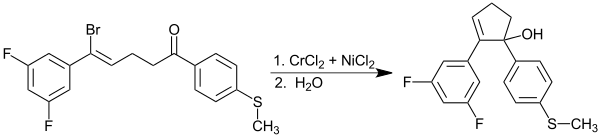
Ebenfalls kann die Barbier-Reaktion intramolekular ablaufen, wie in dem folgenden Beispiel dargestellt. Auf diese Weise können entsprechen substituierte Moleküle mit Hilfe der Barbier-Reaktion cyclisiert werden. Aus Chrom(II)-chlorid und Nickelchlorid bildet sich dabei zuvor durch eine Redoxreaktion das katalytisch aktive Nickel(0).[11]
Einzelnachweise
- George D. Bennett, Leo A. Paquette: Allylindation in Aqueous Media: Methyl 3‐(Hydroxymethyl)‐4‐Methyl‐2‐Methylenepentanoate In: Organic Syntheses. 77, 2000, S. 107, doi:10.15227/orgsyn.077.0107 (PDF).
- Gary W. Breton, John H. Shugart, Christine A. Hughey, Brian P. Conrad, Suzanne M. Perala: Use of Cyclic Allylic Bromides in the Zinc–Mediated Aqueous Barbier–Grignard Reaction. In: Molecules. 6, 2001, S. 655–662. doi:10.3390/60800655.
- J. Clayden, N. Greeves, S. Warren, P. Wothers: Organic Chemistry; Oxford University Press, Oxford 2001, 1. Edition; ISBN 978-0-19-850346-0.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, 1 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, S. 202–209, ISBN 978-0-471-70450-8.
- László Kürti, Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms. Elsevier Academic Press, 2005, ISBN 978-0-12-429785-2, S. 38–39.
- Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers: Organic Chemistry. Oxford University Press, 2001, ISBN 978-0-19-850346-0, S. 224.
- P. Barbier: Synthèse du diéthylhepténol. In: Compt. Rend.. 128, 1899, S. 110.
- Gary W. Breton, John H. Shugart, Christine A. Hughey, Brian P. Conrad, Suzanne M. Perala: Use of Cyclic Allylic Bromides in the Zinc–Mediated Aqueous Barbier–Grignard Reaction. In: Molecules. 6, 2001, S. 655–662. doi:10.3390/60800655.
- Christian Bernlind, Stefan Oscarson: Synthesis of a Branched Heptose- and Kdo-Containing Common Tetrasaccharide Core Structure of Haemophilus influenzae Lipopolysaccharides via a 1,6-Anhydro-l-glycero-β-d-manno-heptopyranose Intermediate. In: The Journal of Organic Chemistry. Band 63, Nr. 22, 1998, S. 7780–7788, doi:10.1021/jo9808573.
- Artur Jõgi, Uno Mäeorg: Zn Mediated Regioselective Barbier Reaction of Propargylic Bromides in THF/aq. NH4Cl Solution. In: Molecules. 6, 2001, S. 964–968. doi:10.3390/61200964.
- Barry M. Trost, Anthony B. Pinkerton: Enhanced geometrical control in a Ru-catalyzed three component coupling. In: Tetrahedron Letters. 41, Nr. 49, 2000, S. 9627–9631, doi:10.1016/S0040-4039(00)01735-4.