Diosgenin
Diosgenin ist ein steroides Sapogenin, welches hauptsächlich der industriellen Produktion von Steroidverbindungen, oralen Kontrazeptiva und Sexualhormonen dient.[6] Diosgenin kommt natürlich vorwiegend in den Wurzelknollen der Yams-Pflanze (Dioscorea) und den Samen des Bockshornklees (Trigonella foenum graecum) und weiteren Pflanzen vor.[7] Strukturell handelt es sich dabei um das Aglykon von Dioscin.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
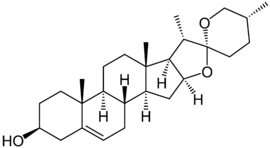 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diosgenin | ||||||||||||||||||
| Andere Namen |
(20R,25R)-Spirost-5-en-3β-ol (IUPAC) | ||||||||||||||||||
| Summenformel | C27H42O3 | ||||||||||||||||||
| Kurzbeschreibung |
weiß bis hellgelber kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 414,6 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,18 g·cm−3 (bei 120 K)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
Essigsäureethylester > Propylacetat > (Aceton, i-Propanol und Ethanol)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen

Diosgenin kommt natürlich in den Knollen vieler Dioscorea-Arten (Yams) vor, außerdem in Bockshornklee (Trigonella foenum graecum), Jericho-Tomate (Solanum incanum), Thai-Aubergine (Solanum xanthocarpum), Gemüsespargel (Asparagus officinalis) und weiße Zwiebel (Allium cepa).[7]
Dioscorea-Arten:
Geschichte
Nachdem 1951 Tadeusz Reichstein und zwei weitere Wissenschaftler für die Isolierung und strukturelle Aufklärung von Cortison den Nobelpreis für Physiologie/Medizin erhielten, investierten weltweit mehrere Firmen in die Cortison-Forschung. Während Lewis H. Sarret von Merck & Company in Rahway, New Jersey, Cortison mittels 36 Syntheseschritten aus Rindergalle synthetisierte, nahm die 1944 gegründete Firma Syntex Forschungen zur Synthese von Cortison aus Diosgenin auf. Die deutlich billigere Synthese aus der diosgeninhaltigen Yamswurzel anstelle von tierischen Abfallprodukten ließ die Cortison-Preise auf dem Weltmarkt sinken und machte Syntex zum weltweit größten Hersteller von Diosgenin. Dem Mitarbeiter Russel E. Marker gelang es in den späten 1930er und frühen 1940er Jahren, aus Diosgenin Progesteron zu synthetisieren. George Rosenkranz baute den Erfolg seines Kollegen kurze Zeit später aus, indem ihm neben Progesteron auch die Synthese von Testosteron aus Diosgenin gelang. Wenige Jahre darauf gewann George Rosenkranz zusammen mit Luis E. Miramontes und Carl Djerassi das Gestagen Norethisteron, das auch nach oraler Verabreichung wirksam war und so als Empfängnisverhütungsmittel in Frage kam. Die Geburtsstunde der Antibaby-Pille war somit gegeben.[6][12]
Synthese
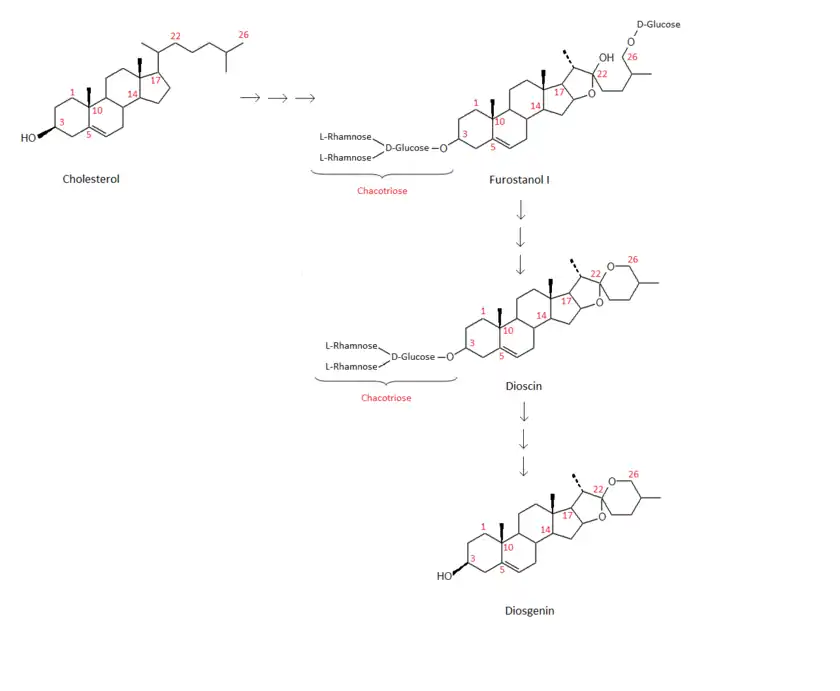
Diosgenin kann aus dem Sterol Cholesterol synthetisiert werden. Ein Zwischenprodukt dabei ist das Furostanol I (Furost-5-en-3β,22,26-triol-3β-chacotriosid-26β-D-glucopyranosid). Dieses Sapogenin kann in Pflanzen vollständig zum Diosgeninglycosid, Dioscin, umgesetzt werden, aus dem schließlich das Aglykon Diosgenin gewonnen werden kann.[11]
Verwendung
Cortison
Der Chemiker Russell Marker entwickelte eine Synthese von Cortison aus Diosgenin. Ausgehend von Diosgenin wird dabei zunächst das ∆7,9(11)-Dien gebildet und dieses anschließend in das 3β-Hydroxy-5α-pregnan-11,20-dion überführt (Weg 2). Aus diesem geht es über mehrere Stufen zum Cortison. Ein anderer Syntheseweg von Cortison aus Diosgenin erfolgt über Progesteron (Weg 1). Diosgenin wird dabei über Progesteron und 11α-Hydroxyprogesteron zum Cortison umgesetzt.[6][12]

Synthese von Diosgenin-Derivaten
Durch Modifikation des Spiroketalring können Diosgenin-Analoga synthetisiert werden. Synthesebeispiele sind Acetate, Alkohole, Aldehyde und Ketone des Diosgenins. Bedeutung gewonnen haben die Diosgenin-Analoga, besonders in der Medizinforschung. Ein Schwerpunkt ist dabei die Gewinnung von Diosgenin-Analoga, die ähnliche oder bessere, positive Eigenschaften als Diosgenin aufweisen. So hemmt das (E)-26-(3′,4′,5′-Trimethoxybenzyliden)-furost-5-en-3β-acetat Entzündungen hervorrufende Zytokine.[13]
Pharmakologische Wirkung
Diosgenin weist ein breites Spektrum an pharmakologischen Wirkungen auf.
Wirkung gegen Mikroorganismen und Viren
Die antimikrobielle Wirkung von Diosgenin konnte im Versuch mit humanpathogenen Hefen bestätigt werden. Auf Basis der minimalen Hemm-Konzentrationen (MHK) konnte gegen Candida albicans und Candida glabrata eine leichte antimikrobielle Wirkung festgestellt werden, wohingegen sich keine Wirkung gegen Candida tropicalis ergab.[14]
Eine effektive Hemmung der Replikation des subgenomischen HCV-Replikon-Systems auf mRNA- und Proteinlevel konnte bewiesen werden. Hierbei wurde die Signalübertragung blockiert.[15]
Wirkung gegen Krebs
Im Tierversuch konnte bei Ratten eine Hemmung des Zellwachstum von Dickdarmkrebszellen sowie eine Apoptose nach oraler Diosgeningabe beobachtet werden. Die Ratten wurden innerhalb der Studie vor Diosgeningabe mit Azoxymethan behandelt.[16]
Andere Wirkungen
Im Tierversuch ergab sich bei Ratten eine verminderte Thrombosebildung durch Diosgenin. Bei den Ratten wurde eine in vitro und in vivo durch Hohlvenenunterbindung verursachte Thrombose untersucht. Eine dosisabhängige Verlängerung der aktivierten partiellen Thromboplastinzeit (aPTT), der Thromboplastinzeit (PT) und der Thrombinzeit (TT) wurde beobachtet. Bei Mäusen wurde durch Diosgenin zudem eine verminderte Thrombozytenaggregation und Inhibierung von Thrombose bei einer Lungenembolie festgestellt. Eine protrahierte Blutungs- und Gerinnungszeit konnte mit einer erhöhten Schutzrate in Verbindung gebracht werden.
Diosgenin zeigte in einer Studie deutliche Hemmwirkung auf die Acetylcholinesterase. Diese wirkt an neuromuskulären Synapsen, z. B. im vegetativen Nervensystem und an der motorischen Endplatte.[7][17]
Im Tierversuch mit weiblichen Ratten konnte durch Verabreichung von Diosgenin Knochenschwund nach Entfernung der Eierstöcke vermindert werden. Andere Organe wurden dabei nicht gefährdet.[7]
Diosgenin führte bei stimuliertem Wachstum des Brustgewebsepithels über 15 Tage zu einer deutlichen Erhöhung des DNA-Gehaltes und der Anzahl an Milchgängen. Eine ergänzende Therapie von Östrogen mit Diosgenin erhöhte die Wirkung von Östrogen, speziell bei höheren Dosen von Diosgenin.[7]
Der Einfluss von Diosgenin auf das Entzündungssystem wurde unter Verwendung einer Ko-Kultur von 3T3-L1 Fettzellen und RAW 264 Makrophagen untersucht. Diese Ko-Kulturen wiesen erhöhte Gehalte an entzündungsauslösenden Substanzen auf, die durch Diosgenin inhibiert wurden.[7]
Bei Ratten, die über sechs Wochen mit cholesterol- und fettreicher Nahrung gefüttert wurden, führte die Verabreichung von Diosgenin zu einer erhöhten Aktivität der Lipoproteinlipase (LPL), der hepatischen Triglycerid-Lipase (HTGL), der Superoxiddismutase (SOD), der Glutathionperoxidase (GPX) sowie der Stickstoffmonoxidsynthase (NOS). Der Gehalt an freien Sauerstoffradikalen wurde demnach verringert und der Malondialdehyd- (MDA), Gesamtcholesterol-, Triacylglycerid- und LDL-Cholesterin-Spiegel gesenkt.[7]
Analytik
Anreicherung aus Pflanzen
Nach Entfettung wird das Glykosid Dioscin mit polaren Lösungsmitteln (z. B. Ethanol) kochend oder unter Rückfluss extrahiert. Die Hydrolyse der glykosidischen Bindung erfolgt durch Säuren, spontane Gärung oder enzymatisch. Das dabei freigesetzte Diosgenin kann mit einem unpolaren Lösungsmittel extrahiert und durch analytische Verfahren qualitativ und quantitativ bestimmt werden.[18] Neben der Isolierung von Diosgenin aus natürlichen Dioscorea-Arten und Hydrolyse des Glykosids mit anorganischen Säuren wurde auch eine effiziente und schonende Isolierung unter Verwendung von ionischen Flüssigkeiten (ionic liquids, IL) beschrieben. Mit ionischen Flüssigkeiten wie 1-Methyl-3-(3-sulfopropyl)-imidazolium Hydrogensulfat ([PSMIM]HSO4) konnte nicht nur Dioscin aus der zu untersuchenden Probe isoliert werden, sondern die ionische Flüssigkeit diente gleichzeitig als Katalysator zur Freisetzung von Diosgenin aus Dioscin.[19]
Analytische Methoden
Zur Identifizierung und quantitativen Bestimmung von Diosgenin in Dioscorea-Arten wurden verschiedene Methoden entwickelt:
- gravimetrische Methoden (Morris et al., 1958)[20]
- densitometrische DC (Brain und Hardman, 1968)[21]
- GC (Bohannon et al., 1974; Brenac und Sauvaire, 1996; Taylor et al., 1997)[22][23][24]
- spektroskopische Methoden (Sanchez et al., 1972; Chen et al., 2010)[25][26]
- TLC (Blunden et al., 1967; Provorov et al., 1996)[27][28]
- HPLC (Ortuno et al., 1998)[29]
- Enzymgekoppelter Immunadsorptionstest (Li et al., 2010)[30]
- IR (Hardman und Jefferies, 1972)[31]
- LC-MS (Zhua et al., 2010)[32]
- GC-MS (Taylor et al., 1997)[24]
Einzelnachweise
- Eintrag zu Diosgenin bei ChemicalBook, abgerufen am 24. Mai 2016.
- Oscar E. Piro, Eduardo E. Castellano, Gloria E. Tobón Zapata, Silvia Blair Trujillo, Enrique J. Baran: Low Temperature Crystal Structure of Natural Diosgenone. In: Zeitschrift für Naturforschung C. 57, 2002, S. 947–950 (PDF, freier Volltext).
- F.-X. Chen, M.-T. Zhao, B.-Z. Ren, C.-R. Zhou und F.-F. Peng: Solubility of diosgenin in different solvents. In: The Journal of Chemical Thermodynamics. Band 47, 2012, S. 341–346.
- Datenblatt Diosgenin, ≥93% bei Sigma-Aldrich, abgerufen am 5. April 2015 (PDF).
- MPbio: Sicherheitsdatenblatt Diosgenin. Abgerufen am 4. April 2015.
- C. Djerassi: Steroid research at Syntex “the pill” and cortisone In: Steroids. Bd. 57, 1992, S. 631–641.
- K. Patel, M. Gadewar, V. Tahilyani und D. K. Patel: ‘’A review on pharmacological and analytical aspects of diosgenin: a concise report’’ In: ’’ Nat. Prod. Bioprospect.’’ Bd. 2, 2012, S. 46–52.
- B. Avula, Y.-H. Wang, Z. Ali, T.J. Smillie und I.A. Khan: Chemical fingerprint analysis and quantitative determination of steroidal compounds from Dioscorea villosa, Dioscorea species and dietary supplements using UHPLC-ELSD In: Biomedical Chromatography. Bd. 28, 2014, S. 281–294.
- P. Li, Y. Mou, S. Lu, W. Sun, J. Lou, C. Yin und L. Zhou: Quantitative determination of diosgenin in Dioscorea zingiberensis cell cultures by microplate-spectrophotometry and high-performance liquid chromatography In: African Journal of Pharmacy and Pharmacology. Bd. 6 (15), 2012, S. 1186–1193.
- T. Yi, L.-L. Fan, H.-L. Chen, G.-Y. Zhu, H.-M. Suen, Y.-N. Tang, L. Zhu, C. Chu, Z.-Z. Zhao, H.-B. Chen: Comparative analysis of diosgenin in Dioscorea species and related medicinal plants by UPLC-DAD-MS In: BMC Biochemistry. Bd. 15, 2014, S. 19–24.
- B. Tal, I. Tamir, S.J. Rokem und I. Goldberg: Isolation and characterization of an intermediate steroid metabolite in diosgenin biosynthesis in suspension cultures of Dioscorea deltoidea cells In: Biochemical Journal. Bd. 219, 1984, S. 619–624.
- P. Präve, U. Faust, W. Sittig und D. Sukatsch: Handbuch der Biotechnologie. Oldenbourg, 4. Auflage, München 1994, ISBN 3-486-26223-8.
- M. Singh, A. Hamid, A.K. Maurya, O. Prakash, F. Khan, A. Kumar, O. Aiyelaagbe, A.S. Negi und D.U. Bawankule: Synthesis of diosgenin analogues as potential anti-inflammatory agents. In: Journal of Steroid Biochemistry and Molecular Biology. Bd. 143, 2014, S. 323–333.
- M. Sautour, A.-C. Mitaine-Offer, T. Miyamoto, A. Dongmo und M.-A. Lacaille-Dubois: Antifungal Steroid Saponins from Dioscorea cayenensis. In: Planta Medica. Bd. 70, 2004, S. 90–92.
- U.A. Ashfaq und S. Idress: Medicinal plants against hepatitis C virus. In: World Journal of Gastroenterology. Bd. 20, 2014, S. 2941–2946.
- J. Raju, J.M. Patlolla, V. Swamy und C.V. Rao: Diosgenin, a Steroid Saponin of Trigonella foenum graecum (Fenugreek), Inhibits Azoxymethane-Induced Aberrant Crypt Foci Formation in F344 Rats and Induces Apoptosis in HT-29 Human Colon Cancer Cells. In: Cancer Epidemiology, Biomarkers & Prevention. Bd. 13, 2004, S. 1392–1398.
- Eintrag zu Acetylcholinesterase im Flexikon, einem Wiki der Firma DocCheck, abgerufen am 2. Dezember 2014.
- M. de Lourdes Contreras-Pacheco, F. Santacruz-Ruvalcaba, J.A. Garcia-Fajardo, J. de Jesus Sanchez G., M.A. Ruiz L., M. Estarron-Espinosa und A. Castro-Castro: Diosgenin quantification, characterisation and chemical composition in a tuber collection of Dioscorea spp. in the state of Jalisco, Mexico. In: International Jornal of Food Science & Technology. Bd. 48, 2013, S. 2111–2118.
- W. Yan, L. Ji, S. Hang, Y. Shun: New ionic liquid-based preparative method for diosgenin from Rhizoma dioscoreae nipponicae. In: Pharmacognosy Magazine., Bd. 9(35), 2013, S. 250–254.
- M. Morris, B. Roark und B. Cancel: Simple precedure for the routine assay of Dioscorea tubers. In: Journal of Agricultural and Food Chemistry. Bd. 6, 1958, S. 856–858.
- K.R. Brain und R. Hardmann: An improvement method of densitometric thin layer chromatography as applied to the determination of sapogenin in Dioscorea tubers. In: Journal of Chromatography. Bd. 38, 1968, S. 355–363.
- M. Bohannon, J. Hagemann, F. Earle und A. Barclay: Screening seed of Trigonella and three related genera for diosgenin. In: Phytochemistry. Bd. 13, 1974, S. 1513–1514.
- P. Brenac und Y. Sauvaire: ‘’Chemotaxonomic value of sterols and steroidal sapogenins in the genus Trigonella’’ In: ’’Ciochem. Syst. Ecol.’’ Nr. 24, 1996, S. 157–164.
- W. Taylor, M. Zaman und Z. Mir: Analysis of steroidal sapogenins from Amber fenugreek (Trigonella foenum-graecum) by capillary gas chromatography and combined gas chromatography. In: Journal of Agricultural and Food Chemistry. Bd. 45, 1997, S. 753–759.
- G. Sanchez, J. Acevedo und R. Soto: Spectrophotometric determination of diosgenin in Dioscorea composita following thin-layer-chromatography. In: Analyst. Bd. 97, 1972, S. 973–976.
- H.-G. Chen, F.-Y. Jin, C. Zhao, X. Zhou und X.-J. Gong: Content determination of total saponins in Triganelle joenumgraecum L. Chin. In: Chinese Journal of Spectroscopy Laboratory. Bd. 27, 2010, S. 580–582.
- G. Blunden, R. Hardman und V. Morrison: Quantitative estimation of diosgenin in tubers by densitometric thin-layer chromatography. In: J. Pharm. Sci. Bd. 56, 1967, S. 948–955.
- N.A. Provorov, Y. Soskov, L. Lutova, O. Sokolova und S. Bairamov: Investigation of the fenugreek (Trigonella foenum-graecum L.) genotypes for fresh weight, seed productivity, symbiotic activity, callus formation and accumulation of steroids. In: Euphytica. Bd. 88, 1996, S. 120–138.
- A. Ortuno, R. Oncina, J. Botia und J. Del Rio: Distribution and changes of diosgenin during development of Trigonella foenum-graecum plants. Mudulation by benzylaminopruine. In: Food Chemistry. Nr. 63, 1998, S. 51–54.
- J. Li, D. Yang, K. Yu, J. He, Y. Zhang: Determination of diosgenin content in medicinal plants with enzyme-linked immunsorbent assay In: Planta Med. Bd. 76, S. 1915–1920.
- R. Hardman und T. Jefferies: A combined column-chromatographic and infrared spectrophotometric determination of diosgenin and yamogenin in fenugreek seed In: Analyst Bd. 97, 1972, S. 437–441.
- J. Zhu, X. Guoa, S. Fua, X. Zhang and X. Liang: Characterization of steroidal saponins in crude extracts from Dioscorea zingiberensis C.H. Wright by ultra-performance liquid chromatography/electrospray ionization quadrupole time-of-flight tandem mass spectrometry In: Journal of Pharmaceutical and Biomedical Analysis Bd. 53, 2010, S. 462–474.