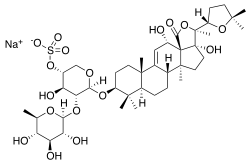
Saponine
Saponine (lateinisch sapo ‚Seife‘) sind Glycoside von Steroiden, Steroidalkaloiden (stickstoffhaltige Steroide) oder Triterpenen. Man spricht daher auch von Steroidsaponinen, Steroidalkaloidsaponinen und Triterpensaponinen (wobei allerdings beachtet werden sollte, dass die Klassifizierung von „Steroidalkaloidsaponinen“ als Saponine umstritten ist und im Zweifelsfall die Terminologie „Steroidale Glykoalkaloide“ zu bevorzugen ist). Aufgrund der Vielzahl möglicher Kohlenhydratstrukturen und der großen strukturellen Variabilität der Aglycone weist diese Stoffgruppe eine entsprechend große Strukturvielfalt und damit eine große Variabilität in den biologischen Eigenschaften auf.
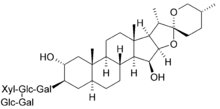
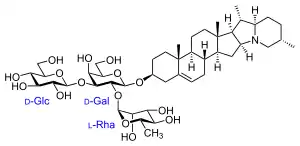
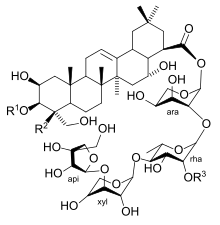
R2 = verschiedene Alkylreste
Die Bezeichnung Saponinglykosid ist ein Pleonasmus und daher nicht korrekt.
Geschichte
Seifen als solches sind schon seit dem Altertum bekannt. Jedoch definierte erst Leopold Gmelin den Begriff „Saponine“.[1]
Johann Friedrich Zittmann stellte aus den Wurzeln von verschiedenen Smilax-Arten ein Decoct her, das 1795 von Johann Christian Anton Theden als „Decoctum Zittmanni“ bezeichnet wird und gegen Syphilis verwendet wird.[1]
Tennet begann 1736 die Senega-Wurzel als Expektorans zu verwenden. W. von Schulz konnte 1896 dann das enthaltene Saponin Senegin isolieren. Während der Weltkriege wurde die Droge sehr selten und teuer, sodass man sie durch Radix Saponariae albae oder Primelwurzeln und -blüten ersetzte, welche noch heute als Expektorans verwendet werden.[2]
Eigenschaften
Saponine werden so bezeichnet, da sie beim Schütteln mit Wasser oft einen seifenartigen Schaum ergeben. Demgemäß steht auch eine allgemeine Wirkungsweise dieser Verbindungsklasse im Vordergrund, die mit der Detergenzeigenschaft zusammenhängt. Saponine bilden im Allgemeinen stabile Schäume, zeigen häufig hämolytische Aktivität, beeinflussen die Membranpermeabilität, komplexieren Cholesterin, haben mitunter einen bitteren Geschmack (Ausnahmen: Glycyrrhizin, das den süßen Geschmack der Lakritze ausmacht sowie die sehr süßen Mogroside aus der chinesischen Pflanze Siraitia grosvenori) und sind piscizid (giftig für Fische).
Vorkommen
Saponine sind in höheren Pflanzen weit verbreitet, besonders in nährstoffreichem Gewebe, wie Wurzeln, Knollen, Blättern, Blüten und Samen. Saponine wurden in über 90 Pflanzenfamilien beschrieben.[3] In einer Untersuchung von 1730 zentralasiatischen Pflanzenarten wurden in 76 % der Familien Saponine gefunden.[3] Man findet Saponine in Gemüsepflanzen, wie Sojabohnen, Kichererbsen, Erdnüssen, Mungobohnen, Saubohnen, Linsen, Erbsen, Quinoa, Spinat, Hafer, Auberginen, Spargel, Fenchel, Knoblauch, Zuckerrüben, Tomaten, grüne Paprika, Kartoffeln (Solanin), Zwiebeln, Cassava und Yams.[3] Sie sind darüber hinaus Bestandteile von Tee,[3] Ginseng oder Jiaogulan. Saponine sind Sekundäre Pflanzenstoffe.

Der Saft aus den Rhizomen des Echten Seifenkrauts wurde schon früh als Waschmittel verwendet, daher auch der botanische Gattungsname Saponaria. In hoher Konzentration treten Saponine in Kastanien und in der Rinde des südamerikanischen Seifenrindenbaumes (Quillaja saponaria) auf, letzteres auch Panamarinde genannt. Aus ökologischen Gründen haben die indischen Waschnüsse, deren Waschwirkung auf die hohe Konzentration an Saponinen zurückgeht, in jüngster Zeit ein breiteres Interesse geweckt. Ferner findet man Saponine in marinen Kleinstlebewesen und Seewalzen (Holothurine). Verschiedene weitere Pflanzen enthalten Saponine, z. B. Alpenveilchen (Cyclamen spp.), Barringtonia asiatica, Bittersüßer Nachtschatten, Cestrum auriculatum, Efeu, Guajacum, Gypsophila struthium, Jiaogulan (Gynostemma pentaphyllum), Kornrade (Agrostemma githago), Lungenkraut, Luzerne, Polygala senega, Primeln, Quinoa, (Chenopodium quinoa), Seifenwurzel, Hundsnelke, Vogelmiere (Stellaria media), Waschnussbaum und Ginseng.
Chemische Strukturen
Die strukturelle Klassifikation der Saponine erfolgt zunächst anhand der Aglycone, den sogenannten Sapogeninen, da der Saccharidteil selbst in ein und derselben natürlichen Quelle mitunter recht stark variiert und üblicherweise mehrere verschiedene Glykosylierungsmuster nebeneinander zu finden sind. Bei den Sapogeninen findet man hingegen meist eine sehr viel begrenztere Strukturvielfalt in einer Quelle. In beiden Fällen ist die Variabilität meist auf verwandte Stoffwechselwege und deren Zwischenschritte zurückzuführen, so dass regelmäßig eine ganze Reihe ähnlicher Verbindungen mit zum Teil ähnlichen, aber in ihrer biologischen Wirkung abgestuften Eigenschaften zu finden sind.
Monodesmosidische Saponine haben eine Zuckerkette, bisdesmosidische Saponine zwei Zuckerketten, die an unterschiedlichen Positionen des Aglykons gebunden sind.
- Steroidsapogenine mit C-27-Grundgerüst:
- Spirostane, bei denen die Seitenkette ein an den D-Ring anelliertes bicyclisches Spiroketal (E- und F-Ring) bildet (z. B. Digitogenin)
- Furostane, bei denen ein Teil der Seitenkette einen an den D-Ring anellierten Furanring (E-Ring) formt
- im Vergleich zum Cholestan umgelagerte C-27-Grundgerüste
- Steroidalkaloidsapogenine mit C-27-Grundgerüst und Stickstoffatom meist in der Seitenkette (auch hier findet man ähnliche Varianten, wie bei den Steroidsapogeninen)
- Triterpensapogenine mit C-30-Grundgerüst u. a.:
- Cycloartane: Tetracyclisches Cholestan-Grundgerüst und einem zusätzlichen anellierten Cyclopropanring
- Dammarane, Tirucallane und Cucurbitane: drei anellierte Sechsringe (A–C) und ein an den C-Ring anellierter Fünfring (D)
- Holothurinogenine, die sich vom Holostan ((20S)-20-Hydroxy-5α-lanostan-18-säurelacton) bzw. Lanostan ableiten. Die Gruppe besitzt drei anellierte Sechsringe (A–C) und einen an den C-Ring anellierten, doppelten Fünfring (D,E), der äußere davon ist ein Lacton; dieser Ring trägt zusätzlich einen nicht anellierten Tetrahydrofuran-Ring. Die Glycoside bilden die Gruppe der Holothurine.[4]
- Lupane (Stoffgruppe): vier anellierte Sechsringe (A–D) und ein an den D-Ring anellierter Fünfring (E)
- Oleanane (siehe Strukturformel des Ballonblumensaponins), Ursane und Taraxasterane: fünf anellierte Sechsringe (A–E), Häufig ist die Methylgruppe C-28 bei diesen Saponinen zur Säure oxidiert, z. B. in Saponinen, die sich vom Aglykon Gypsogenin ableiten.
Biologische Funktion
Saponine dienen den Pflanzen wahrscheinlich als Defensivstoffe, beispielsweise gegen Pilzbefall[5] und Insektenfraß.[6] Da Pflanzen kein aktives Immunsystem wie die Wirbeltiere haben, werden Schadorganismen oft chemisch bekämpft. Bei der Reifung von Nachtschattengewächsen wie der Tomate und der Kartoffel werden die giftigen Steroidalkaloidsaponine durch Denitrifikation (enzymatische Entfernung des Stickstoffs) in ungiftige Steroidsaponine umgewandelt.
Biosynthese
Saponine entstammen dem Phytosterolanabolismus.[7] Über den cytosolischen Mevalonatweg gebildetes DMAPP und IPP bildet dabei die Grundlage zur Bildung von 2,3-Oxidosqualen, das als letztes gemeinsames Vorläufermolekül den Scheidepunkt von Phytosterolen, Steroidsaponinen und Steroidalkaloidsaponinen auf der einen Seite und Triterpensaponinen auf der anderen Seite markiert. Sogenannte Oxidosqualencyclasen (auch: Triterpensynthasen) katalysieren Cyclisierungskaskaden von Oxidosqualen die in der Formierung von Cycloartenol im Falle ersterer oder verschiedener Triterpene wie bspw. Dammaran, Lupeol und β-Amyrin in der weiteren Biosynthese letzterer resultieren. An welchem Schritt sich Steroidsaponine bzw. Steroidalkaloidsaponine von der weiteren Phytosterolbiosynthese abspalten, ist nicht bekannt.
Die Bildung des initialen Sapogeningrundgerüstes ist oftmals gefolgt von der Modifizierung einzelner Positionen. Zumeist handelt es sich dabei in erster Instanz um die Einführung von Hydroxy-, Keto- oder Carboxygruppen. Die Mehrzahl dieser Oxidierungen wird dabei vermutlich von „Cytochrom P450“-Enzymen katalysiert. Hydroxy- und Carboxygruppen können im Anschluss als Angriffspunkt für die Verknüpfung mit Seitengruppen unterschiedlichster chemischer Herkunft, wie bspw. kleineren aliphatischen und aromatischen Säuren ober eben auch Zuckerresten dienen.
Die Glykosylierung des Aglycons, also die Verknüpfung mit Zuckerresten, ist in der Regel notwendig, um die biologische Aktivität von Saponinen zu gewährleisten. Typische Saponinzuckerseitenketten bestehen aus 2–5 Monosaccharideinheiten und sind mit der C3-Hydroxygruppe und/oder (sofern vorhanden) C28-Carboxygruppe des Sapogenins via Ether- bzw. Esterbindung verknüpft. Am häufigsten vorgefundene Zuckerreste in Saponinglykosylierungsmustern sind Glucosyl-, Galactosyl-, Glucuronyl-, Rhamnosyl-, Xylosyl- und Arabinosyl-Einheiten. Bisher identifizierte Enzyme die an der Synthese von Saponinzuckerseitenketten beteiligt sind, gehören alle zur Klasse der Familie 1 UDP-Glykosyltransferasen und katalysieren jeweils die Verknüpfung eines einzelnen Monosaccharidrestes mit dem Sapogenin oder der wachsenden Saponinzuckerseitenkette.
Analyse
Die Analyse von Saponinen erfolgt üblicherweise per LC-MS, HPLC, Gaschromatografie, teilweise auch per Dünnschichtchromatographie.[3] Ein Vorhandensein von Saponinen kann durch Aufschütteln geprüft werden, wobei sich ein Schaum bildet, der länger als 10 Minuten steht. Als Positivkontrolle dient dabei die Rinde von Entada phaseoloides.
Anwendungen
Saponine sind wirksame Bestandteile des Adjuvans QS-21. Sie verstärken die zelluläre Immunantwort.[8]
Literatur
- D. E. Fenwick, D. Oakenfull: Saponin content of food plants and some prepared foods. In: Journal of the science of food and agriculture. Band 34, Nummer 2, Februar 1983, S. 186–191, PMID 6855202.
- Lawrence A. Johnson: Soybeans. Elsevier, 2015, ISBN 978-0-12-804352-3, S. 312.
Weblinks
Einzelnachweise
- Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarb. und erw. Auflage. Wiss. Verl.-Ges, Stuttgart 2005, ISBN 978-3-8047-2113-5, S. 183.
- Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarb. und erw. Auflage. Wiss. Verl.-Ges, Stuttgart 2005, ISBN 978-3-8047-2113-5, S. 184.
- K. Hostettmann: Saponins. Cambridge University Press, 2005, ISBN 978-0-521-02017-6. S. 18.
- Eintrag zu Holothurine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. April 2012.
- K. Papadopoulou, R. E. Melton, M. Leggett, M. J. Daniels, A. E. Osbourn: Compromised disease resistance in saponin-deficient plants. In: Proceedings of the National Academy of Sciences. 96, 1999, S. 12923–12928, doi:10.1073/pnas.96.22.12923.
- Tetsuro Shinoda, Tsuneatsu Nagao, Masayoshi Nakayama, Hiroaki Serizawa, Masaji Koshioka, Hikaru Okabe, Akira Kawai: Identification of a Triterpenoid Saponin from a Crucifer, Barbarea vulgaris, as a Feeding Deterrent to the Diamondback Moth, Plutella xylostella In: Journal of Chemical Ecology. 28, 3, S. 587–599, doi:10.1023/A:1014500330510.
- Jörg M. Augustin, Vera Kuzina, Sven B. Andersen, Søren Bak: Molecular activities, biosynthesis and evolution of triterpenoid saponins. In: Phytochemistry, Vol. 72, Issue 6, April 2011, S. 435–457, doi:10.1016/j.phytochem.2011.01.015.
- H. X. Sun, Y. Xie, Y. P. Ye: Advances in saponin-based adjuvants. In: Vaccine. Band 27, Nummer 12, März 2009, S. 1787–1796, doi:10.1016/j.vaccine.2009.01.091, PMID 19208455.