Natriumdisulfid
Natriumdisulfid ist eine chemische Verbindung aus der Gruppe der Sulfide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
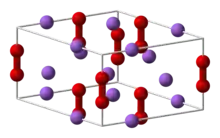 | ||||||||||||||||
| _ Na+ _ S− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumdisulfid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Na2S2 | |||||||||||||||
| Kurzbeschreibung |
gelber Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 110,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Natriumdisulfid kann durch Reaktion von Natrium mit Schwefel gewonnen werden.[1]
Möglich ist auch die Reaktion von in Alkohol gelöstem Natriumtetrasulfid mit Natrium oder Tetraphenylphosphoniumchlorid.[1]
Bei Erhitzung von Natriumtrisulfid auf 100 °C zersetzt sich dieses zu einer 1:1 Mischung aus Natriumdisulfid und Natriumtetrasulfid.[1]
Ebenfalls möglich ist die Reaktion von Natriumsulfid mit Schwefel[3]
oder Natrium mit Schwefel in flüssigem Ammoniak.[3]
Eigenschaften
Natriumdisulfid ist ein hellgelber sehr hygroskopischer Feststoff. Beim Erhitzen färbt es sich allmählich dunkler und ist bei 400 °C hellrotbraun. Oberhalb 475 °C vertieft sich die Farbe nach dunkelbraun hin, und die Substanz beginnt stark zu sintern und ab 490 °C zu einer tief dunkelbraunen Flüssigkeit zu schmelzen. Die aus einer Alkohollösung dargestellten Produkte sind nach dem Schmelzen stets olivgrün gefärbt.[3] Er tritt in zwei allotropen Formen auf, wobei unter 160 °C die α-Form und darüber irreversibel die β-Form vorliegt. Beide haben ein hexagonales Kristallsystem.[1][3]
Verwendung
Natriumdisulfid wird zur Herstellung anderer chemischer Verbindungen (z. B. Diallyldisulfid) verwendet.
Einzelnachweise
- Ralf Steudel: Elemental sulfur and sulfur-rich compounds, Band 2. 2003, ISBN 3-540-40378-7, S. 130 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 374.