Fluorchinolonantibiotikum
Fluorchinolonantibiotika (kurz auch: Fluorchinolone) sind eine Untergruppe der Chinolon-Antibiotika, mit denen sie strukturell verwandt sind. Wie diese wirken sie als sogenannte „Gyrasehemmer“ über die Hemmung der bakteriellen Topoisomerase II (Gyrase), einem Enzym, das bei der DNA-Synthese eine Rolle spielt. Gegenüber anderen Gyrasehemmern zeichnen sie sich durch ein breiteres Wirkungsspektrum aus. Da neuere Fluorchinolone nicht nur gegen die Topoisomerase vom Typ II, sondern auch gegen weitere Typen wie die Topoisomerase IV wirksam sind, ist die Bezeichnung Gyrasehemmer mittlerweile international unüblich.[1]
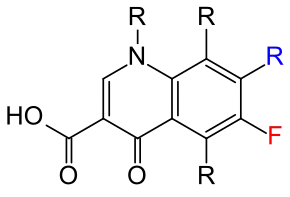
Der blau markierte Rest R ist fast immer ein Piperazinyl-Rest.
Das Fluoratom ist rot gezeichnet.
Fluorchinolone werden sowohl in der Humanmedizin als auch in der Veterinärmedizin eingesetzt. Im Jahr 2015 bekamen mehr als vier Millionen gesetzlich Krankenversicherte knapp 5,9 Millionen Arzneimittelpackungen Fluorchinolone verordnet.[2] Da sie schwere, zum Teil irreversible Schäden am Nervensystem und Bewegungsapparat hervorrufen können, sind sie seit dem 8. April 2019 in Deutschland in der systemischen Anwendung eingeschränkt.[3]
Chemisch gesehen sind die Fluorchinolone im Grundgerüst am C-6 fluoriert und weisen zusätzlich einen Piperazinsubstituenten auf.
Wirkmechanismus
Das den Bakterien eigene Enzym Gyrase bewirkt eine Überspiralisierung der DNA (Supercoiling). Die Fluorchinolone hemmen das Enzym. Die im Chromosom der Bakterien gespeicherte mechanische Energie nimmt dadurch ab und die Chromosomenlänge zu. Als Ergebnis kann die Bakterien-DNA nicht mehr korrekt repliziert werden. Zunächst stoppt das Bakteriumwachstum (bakteriostatische Wirkung), dann sterben die Zellen ab (bakterizide Wirkung). Eine Hemmung der DNA-Replikation kann den bakteriziden Effekt der Fluorchinolone jedoch nicht hinreichend erklären, weshalb weitere Wirkmechanismen angenommen werden.[4][5] Neuere Vertreter der Fluorchinolone sind auch gegen bakterielle Topoisomerase-Enzyme wirksam, die ebenfalls die Topologie der DNA-Moleküle steuern.
Fluorchinolone haben ein sehr breites Wirkungsspektrum gegenüber den meisten gramnegativen und grampositiven Bakterien, wobei einige Anaerobier und verschiedene Streptokokken eine Resistenz aufweisen. Als medizinische Indikationen gelten fast alle bakteriellen Infektionen, wobei Harnwegs- und Atemwegsinfektionen im Vordergrund stehen. Bei Harnwegsinfektionen werden sie in Regionen mit Resistenzen gegen andere Antibiotika, insbesondere Cotrimoxazol, empfohlen.[6]
Übersicht über die Arzneistoffe
Die Paul-Ehrlich-Gesellschaft für Chemotherapie hat eine Einteilung der Fluorchinolonantibiotika nach Pharmakokinetik und Wirkspektrum in folgende vier Gruppen vorgeschlagen:[1]
- Gruppe I: Orale Fluorchinolone mit Indikation Harnwegsinfekt
- Gruppe II: Systemisch anwendbare Fluorchinolone mit breiter Indikation
- Gruppe III: Fluorchinolone mit verbesserter Wirksamkeit gegen grampositive und atypische Erreger
- Gruppe IV: Fluorchinolone mit verbesserter Wirksamkeit gegen grampositive und atypische Erreger sowie gegen Anaerobier.
Die Stoffe höherer Gruppen sind im Allgemeinen auch neuere Produkte.
Humanmedizinisch verwendete Fluorchinolone
- Enoxacin (Gruppe II)
- Norfloxacin (Gruppe I)
- Ciprofloxacin (Gruppe II)
- Ofloxacin (Gruppe II)
- Levofloxacin (Gruppe III)
- Moxifloxacin (Gruppe IV)
- Nadifloxacin
- Lomefloxacin
- Delafloxacin
In Deutschland sind mit Stand 2019 nur noch die folgenden fünf zugelassen: Norfloxacin, Ciprofloxacin, Ofloxacin, Levofloxacin und Moxifloxacin.[7]
Einen Überblick über Marktrücknahmen humanmedizinischer Fluorchinolone[8] gibt die nachstehende Tabelle.
| Jahr | Freiname | Grund für die Rücknahme |
|---|---|---|
| 1992 | Temafloxacin | Leber-, Nierentoxizität, HUS, Anaphylaxie, Anämie |
| 1993 | Lomefloxacin | Phototoxizität, Lebertoxizität, ZNS-UAW |
| 1998 | Rosoxacin | Marketingentscheidung |
| 1999 | Trovafloxacin | Leberversagen, Lebertoxizität |
| 1999 | Grepafloxacin | Kardiotoxizität |
| 2000 | Pefloxacin | Marketingentscheidung, aber auch: Phototoxizität, Tendinitiden |
| 2001 | Clinafloxacin | Phototoxizität, Einfluss auf den Zuckerstoffwechsel |
| 2001 | Sparfloxacin | Phototoxizität, ZNS-UAW |
| 2004 | Fleroxacin | Phototoxizität, ZNS-UAW |
| 2004 | Gatifloxacin | Einfluss auf den Zuckerstoffwechsel |
| 2016[9] | Enoxacin | Interaktionen |
Veterinärmedizinisch verwendete Fluorchinolone
- Danofloxacin
- Enrofloxacin
- Ibafloxacin
- Marbofloxacin
- Orbifloxacin
- Pradofloxacin
Nebenwirkungen
Während einer Fluorchinolonbehandlung treten bei 4–10 % der Patienten unerwünschte Wirkungen auf. Diese sind teilweise klassenspezifisch. Jüngeren Herstellerangaben zufolge liegt die Nebenwirkungsinzidenz bei 25–30 %. Dieser Anstieg wird mit einer Intensivierung klinischer Untersuchungen zur Abschätzung des Nebenwirkungspotentials der neueren Fluorchinolone erklärt.[10] Die häufigsten Nebenwirkungen sind Störungen des Gastrointestinaltrakts wie Übelkeit und Diarrhöe sowie zentralnervöse Störungen. Seltener sind psychiatrische Störwirkungen[11] mit Suizidalität, Blutzuckerdekompensation bei Diabetikern und Sehnenentzündungen und -rupturen, wie etwa einer Achillessehnenruptur.
Die Minderung der Sehnenfestigkeit kann bei allen Gyrasehemmern auftreten, auch nach kurzfristiger Einnahme.[12][13] Eventuell ist die Häufigkeit bei Levofloxacin erhöht. Ältere Personen und Patienten, die Corticosteroide einnehmen, sind stärker gefährdet. Erklärt wird dies mit einer vermehrten Expression von Matrix-Metalloproteinasen, die die Festigkeit der Sehnen vermindern.[14] Fluorchinolone können durch Eisen-Chelation der α-Ketoglutarat-abhängigen Dioxygenase den Cofaktor Eisen entziehen. Das stört vermutlich die Kollagenreifung. Die Autoren schlagen das als eine Ursache für die Fluorchinolon-induzierten Nierenschäden und Tendopathien (Sehnenschädigungen) vor.[15] Zudem gibt es Hinweise auf direkte zytotoxische und antiproliferative (wachstumshemmende) Effekte[16][17] sowie Schädigungen der mitochondrialen DNA.[18][19][20] Histologisch sind im Zusammenhang mit Fluorchinolon-bedingten Sehnen- und Nierenschäden Nekrosen dokumentiert.[21][22][23][24] Die Häufigkeit für Sehnenschädigungen wird in einem Dokument der Arzneimittelkommission der deutschen Ärzteschaft mit 1:227 für Ciprofloxacin und 1:104 für Ofloxacin/Levofloxacin angegeben.[25]
Da alle Fluorchinolone ein phototoxisches Potential aufweisen, sollte eine Exposition von Sonnen- oder UV-Licht unterbleiben. Ein vermutetes erhöhte Risiko für eine Netzhautablösung[26] konnte in einer großen dänischen Studie nicht verifiziert werden.[27] Zwei nachfolgend veröffentlichte große Studien aus Taiwan und Frankreich konnten jedoch ein erhöhtes Risiko für rhegmatogene und exsudative Netzhautablösungen unter Einnahme von Fluorchinolonen statistisch belegen.[28][29]
Die Einnahme von Fluorchinolonen kann zur Entwicklung einer peripheren Neuropathie führen, die sowohl bei oraler als auch bei intravenöser Einnahme bereits wenige Tage nach Therapiebeginn auftreten und dann ein Jahr oder länger anhalten kann.[30] Problematisch ist hierbei, dass diese Nebenwirkung von den Ärzten oft nicht ernst genug genommen wird und der Wechsel zu einem anderen Antibiotikum deshalb verspätet erfolgt.[31] Insbesondere in Kombination mit einem nichtsteroidalen Antirheumatikum können eine Reihe an zentralnervösen Nebenwirkungen bis hin zu Krampfanfällen entstehen;[32][33] als Ursache wird der ausgeprägte selektive kompetitive Antagonismus des GABA-A-Rezeptors vermutet.[32][33]
Retrospektive klinische Studien assoziieren die Einnahme von Fluorchinolonen mit einer mehr als 2-fachen Risikoerhöhung für Aortenaneurysmen und Aortendissektionen.[34][35] Ergebnisse einer Metaanalyse zeigen, dass das Risiko für Fluorchinolon-bedingte Aortenschäden mindestens um den Faktor 2 erhöht ist, wobei in der Risikogruppe der über 65-Jährigen auf 618 Fluorchinolon-Verordnungen ein Aortenschaden entfällt.[36] Experimentelle Daten legen nahe, dass Fluorchinolon-induzierte Aortendissektionen auf einer Nekroptose (in vivo) oder Apoptose aortischer glatter Muskelzellen (in vitro) und einer Zerstörung der extrazellulären Matrix der Aortenwand beruhen und bei gleichzeitig bestehender Atherosklerose zu tödlichen Aortenrupturen führen können.[37] Das Bundesinstitut für Arzneimittel und Medizinprodukte hat am 26. Oktober 2018 aufgrund der erhöhten Risiken für Aortenaneurysmen und -dissektionen in einem Rote-Hand-Brief die Aufnahme eines entsprechenden Hinweises in die Produktinformationstexte aller systemisch und inhalativ angewendeten Fluorchinolone angeordnet[38] und am 8. April 2019 neue Anwendungsbeschränkungen veröffentlicht.[39]
Fluoroquinolone-Associated Disability
Die FDA fasste 2015 erstmals die Nebenwirkungen von Fluorchinolonen zu einer definierten Krankheit unter der Bezeichnung Fluoroquinolone-Associated Disability (FQAD) zusammen. Bei Kindern und Jugendlichen sind Chinolone mittlerweile zur Behandlung schwerer Infektionen und bei Patienten mit Mukoviszidose zugelassen. Sie sollten mit Vorsicht eingesetzt werden, da im Tierversuch Hinweise auf toxische Wirkungen auf Gelenkknorpel und Epiphysenfuge bestehen.[40]
Laut FDA überwiegen die schwerwiegenden Nebenwirkungen der Fluorchinolone die Vorteile der Behandlung von Patienten mit Sinusitis, Mittelohrentzündung, Bronchitis und unkomplizierten Harnwegsinfektionen, für die es alternative Antibiotika gibt. Bei Patienten mit diesen Erkrankungen sollen Fluorchinolone deshalb nur mehr als letztes Mittel der Wahl verwendet werden, nachdem alle alternativen Antibiotika versagt haben.[41] Die Sicherheitsüberprüfung hatte gezeigt, dass systemisch angewandte Fluorchinolone (in Form von Tabletten und Kapseln oder intravenös) zu Behinderungen und potenziell dauerhaften schweren chronischen Nebenwirkungen führen können, von denen auch mehrere gleichzeitig auftreten können. Diese Nebenwirkungen betreffen u. a. Sehnen, Muskeln, Gelenke, Nerven und das Zentralnervensystem.[41] Beispiele sind das Auftreten von Tendinitis, Tendopathie, Sehnenriss, Effekte auf das Zentralnervensystem und periphere Neuropathie. Sie können bei einem Teil der Patienten zu einer bleibenden Beeinträchtigung führen. In der Folge ordnete die amerikanischen Arzneimittelzulassungsbehörde FDA am 26. Juli 2016 eine entsprechende Aktualisierung der Packungsbeilagen an.[42] Von allen Antibiotika verursachen Fluorchinolone die meisten dauerhaften Behinderungen.[43]
Im November 2016 hatten Fluorchinolon-Geschädigte, über die der Bayerische Rundfunk sowie Der Spiegel[44] berichteten, eine Online-Petition an den Deutschen Bundestag zur Mitzeichnung erstellt und eingereicht. Sie fordern in der Petition unter anderem ein Warnsymbol auf den Arzneimittelpackungen sowie die Anwendung von Fluorchinolonen nur in lebensbedrohenden Situationen.[45][46][47]
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) stieß im Februar 2017 ein europäisches Risikobewertungsverfahren an zu den schwerwiegenden Nebenwirkungen der Fluorchinolone und Chinolone, die zu starken Einschränkungen der Lebensqualität und unter Umständen dauerhaften Beeinträchtigungen führen können.[48][49] Im Oktober 2018 empfahl der Pharmakovigilanzausschuss für Risikobewertung (Pharmacovigilance Risk Assessment Committee, PRAC) der Europäischen Arzneimittel-Agentur nach der Neubewertung des Nutzen-Risiko-Verhältnisses Anwendungseinschränkungen. Bei bestimmten leichten bis mittelschweren Infektionen sollen diese Mittel möglichst nicht mehr, und bei bestimmten Patientengruppen (z. B. älteren Patienten, Patienten mit Nierenfunktionsstörungen, Patienten nach Organtransplantation oder Patienten unter systemischer Kortikosteroidtherapie) nur noch mit Vorsicht angewendet werden.[50]
Klassenspezifische Nebenwirkungen
Vertreter der Gruppen III und IV können das QT-Intervall im EKG verlängern und so das QT-Syndrom mit ventrikulären Arrhythmien auslösen. Für Moxifloxacin und Norfloxacin wurden extrem selten (nur 8 Fälle bei mehr als 50 Mio. Patienten) hepatotoxische Effekte mit Todesfolge beschrieben.[51] Als weitere Nebenwirkungen sind Juckreiz und Kopfschmerzen beschrieben worden. Im Tierversuch traten bei wachsenden Tieren (Hunden) Knorpelschäden auf.[13]
Das Bundesinstitut für Arzneimittel und Medizinprodukte hat auf Empfehlung des Ausschusses für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) die Indikation für das Antibiotikum Levofloxacin eingeschränkt. Das CHMP hatte Levofloxacin im Mai 2012 als Reserveantibiotikum eingestuft. Die zugelassenen Indikationen sind akute bakterielle Sinusitis, akute Exazerbation einer chronischen Bronchitis, ambulant erworbene Pneumonie sowie komplizierte Haut- und Weichteilinfektionen. Der Einsatz ist hier aber künftig streng auf Situationen einzuschränken, in denen „andere Antibiotika, die für die initiale Behandlung der entsprechenden Infektionen üblicherweise empfohlen werden, als nicht indiziert erachtet werden“.[52]
Aufgrund ihrer Wirkung nicht nur auf die bakterielle, sondern auch auf die humane DNA-Gyrase mussten einige Gyrasehemmer – wie Fleroxacin, Gatifloxacin, Grepafloxacin, Sparfloxacin und Trovafloxacin – vorwiegend wegen schwerer toxischer Komplikationen und Unverträglichkeitsreaktionen, teilweise mit Todesfällen, vom Markt genommen werden.[53][8]
Geschichte
Als erstes fluoriertes Chinolon wurde Norfloxacin 1979 von dem Pharmahersteller Kyorin Seiyaku Kabushiki Kaisha patentiert.[54] und 1983 für die medizinische Verwendung zugelassen.[55] Norfloxacin hatte eine gute Bioverfügbarkeit, eine längere Halbwertszeit und trifft vor allem ein breiteres Erregerspektrum als Nalidixinsäure. Im Jahre 1981 wurde von der Firma Bayer dann Ciprofloxacin entwickelt und 1983 patentiert.[56][57] Ofloxazin und Ciprofloxacin wurden 1987 in der Schweiz zugelassen.[58] Levofloxacin wurde von Daiichi Seiyaku entwickelt[59] und kam 1993 in Japan[60] und 1998 in Deutschland auf den Markt.
US-Forscher beobachteten 1986, dass C-6-fluorierte Chinolone im Unterschied zu nichtfluorierten Chinolonen eine bis zu 126-mal stärkere antibakterielle Hemmwirkung aufweisen und das Fluoratom an Position 6 eine bis zu 17-mal stärkere Bindung an den Gyrasekomplex und eine bis zu 70-mal stärkere Zellpenetration bewirkt, wohingegen andere an Position 6 eingebrachte Substituenten eine sehr schwache Hemmwirkung begünstigen.[61] Im SOS-Chromotest zeigte sich 1996, dass C-6-fluorierte Chinolone genotoxisch wirken, wohingegen das nichtfluorierte Chinolon Nalidixinsäure nicht genotoxisch wirkt.[62] Weltweit wurden 1988–2003 über 350 Millionen Patienten mit Ciprofloxacin behandelt, über 250 Millionen mit Levofloxacin und über 13 Millionen mit Moxifloxacin.[63]
Fachliteratur
Leitlinien
- Deutsche Gesellschaft für Infektiologie: Strategien zur Sicherung rationaler Antibiotika-Anwendung im Krankenhaus. In: AWMF. Katja de With, 14. Februar 2020, abgerufen am 14. Februar 2022.
- Deutsche Gesellschaft für Pädiatrische Infektiologie: Antibiotic Stewardship - Konzeption und Umsetzung in der stationären Kinder- und Jugendmedizin. In: AWMF. Johannes Huebner, 26. Juni 2019, abgerufen am 14. Februar 2022.
Einführungen
- Stefan Pieper: Fluoroquinolone-Associated Disability FQAD: Pathogenese, Diagnostik, Therapie und Diagnosekriterien. In: essentials. 1. Auflage. Springer, 2020, ISBN 978-3-658-29841-8, ISSN 2197-6708, doi:10.1007/978-3-658-29842-5.
Einzelnachweise
- Georges Fülgraff, Björn Lemmer, Kay Brune (Hrsg.): Pharmakotherapie: Klinische Pharmakologie. 13. Auflage. Springer, 2006, ISBN 3-540-34180-3, S. 132.
- AOK-Institut kritisiert Verordnungsraten von Fluorchinolonen. (Nicht mehr online verfügbar.) Wissenschaftliches Institut der AOK, 2. Mai 2017, archiviert vom Original am 12. Juli 2017; abgerufen am 18. Juli 2017.
- Risikobewertungsverfahren des Bundesinstituts für Arzneimittelsicherheit. Abgerufen am 27. März 2020.
- David C. Hooper: Mechanisms of Action of Antimicrobials: Focus on Fluoroquinolones. In: Clinical Infectious Diseases. Band 32, Supplement 1, 15. März 2001, S. S9–S15, doi:10.1086/319370.
- Karl Drlica, Muhammad Malik, Robert J. Kerns, Xilin Zhao: Quinolone-Mediated Bacterial Death. In: Antimicrobial Agents and Chemotherapy. Band 52, Nr. 2, 1. Februar 2008, S. 385–392, doi:10.1128/aac.01617-06, PMID 17724149.
- V. Rafalsky, I. Andreeva, E. Rjabkova: Quinolones for uncomplicated acute cystitis in women. In: Cochrane Database Syst Rev. Band 3, 2006, S. CD003597, doi:10.1002/14651858.CD003597.pub2, PMID 16856014 (englisch).
- bfarm.de Schwere und langanhaltende Nebenwirkungen im Bereich Muskeln, Gelenke und Nervensystem, 8. April 2019.
- Gyrasehemmer: Anwendungseinschränkungen. In: Informationsdienst der Kassenärztlichen Vereinigung Hessen (Hrsg.): KVH aktuell Pharmakotherapie. Band 14, Nr. 1. Berlin 2009, S. 30 (dgn.de [PDF; 2,0 MB]).
- KBV-Medikationskatalog 2018, abgerufen am 28. Mai 2020.
- Peter Ball: Efficacy and safety of levofloxacin in the context of other contemporary fluoroquinolones: a review. In: Current Therapeutic Research, Clinical and Experimental. Band 64, Nr. 9, 2003, S. 646–661, doi:10.1016/j.curtheres.2003.11.003, PMID 24944413, PMC 4053061 (freier Volltext).
- Arzneiverordnung in der Praxis 2008;35(1), S. 14–17 (akdae.de. PDF; 442 kB).
- R. M. Harrell: Fluoroquinolone-Induced Tendinopathy: What Do We Know? In: South Med. J. Band 92, Nr. 6, Jun 1999, S. 622–625.
- R. Stahlmann, H. Lode: Nebenwirkungen der neueren Fluorchinolone. (Memento vom 1. August 2014 im Internet Archive) (PDF; 82 kB). In: Chemotherapie Journal 1998. 7(3), S. 107–116.
- H. Vyas, G. Krishnaswamy: Images in clinical medicine. Quinolone-associated rupture of the Achilles’ tendon. In: The New England Journal of Medicine. Band 357, Nummer 20, November 2007, S. 2067, doi:10.1056/NEJMicm061227. PMID 18003963.
- S. Badal, Y. F. Her, L. J. Maher: Non-antibiotic effects of fluoroquinolones in mammalian cells. In: The Journal of biological chemistry. (Elektronische Veröffentlichung vor dem Druck) Juli 2015, doi:10.1074/jbc.M115.671222. PMID 26205818.
- Nasim Zargar Baboldashti, Raewyn C. Poulsen, Sarah L. Franklin, Mark S. Thompson, Philippa A. Hulley: Platelet-rich plasma protects tenocytes from adverse side effects of dexamethasone and ciprofloxacin. In: The American Journal of Sports Medicine. Band 39, Nr. 9, September 2011, S. 1929–1935, doi:10.1177/0363546511407283, PMID 21632978.
- R. J. Williams, E. Attia, T. L. Wickiewicz, J. A. Hannafin: The effect of ciprofloxacin on tendon, paratenon, and capsular fibroblast metabolism. In: The American Journal of Sports Medicine. Band 28, Nr. 3, Mai 2000, S. 364–369, doi:10.1177/03635465000280031401, PMID 10843129.
- J. W. Lawrence, D. C. Claire, V. Weissig, T. C. Rowe: Delayed cytotoxicity and cleavage of mitochondrial DNA in ciprofloxacin-treated mammalian cells. In: Molecular Pharmacology. Band 50, Nr. 5, November 1996, S. 1178–1188, PMID 8913349.
- K. Bernard-Beaubois, C. Hecquet, G. Hayem, P. Rat, M. Adolphe: In vitro study of cytotoxicity of quinolones on rabbit tenocytes. In: Cell Biology and Toxicology. Band 14, Nr. 4, August 1998, S. 283–292, PMID 9733283.
- Rafał Kozieł, Krzysztof Zabłocki, Jerzy Duszyński: Calcium Signals Are Affected by Ciprofloxacin as a Consequence of Reduction of Mitochondrial DNA Content in Jurkat Cells. In: Antimicrobial Agents and Chemotherapy. Band 50, Nr. 5, 1. Mai 2006, S. 1664–1671, doi:10.1128/aac.50.5.1664-1671.2006, PMID 16641433.
- W. Petersen, H. Laprell: The “insidious” rupture of the achilles tendon after ciprofloxacin induced tendinopathy. A case report. In: Der Unfallchirurg. Band 101, Nr. 9, 1. September 1998, S. 731–734, doi:10.1007/s001130050330.
- Jc Le Huec, T. Schaeverbeke, D. Chauveaux, J. Rivel, J. Dehais: Epicondylitis after treatment with fluoroquinolone antibiotics. In: The Journal of Bone and Joint Surgery. British volume. 77-B, Nr. 2, 1. März 1995, S. 293–295, doi:10.1302/0301-620x.77b2.7706350.
- A. J. Dichiara, M. Atkinson, Z. Goodman, K. E. Sherman: Ciprofloxacin-induced acute cholestatic liver injury and associated renal failure. Case report and review. In: Minerva Gastroenterologica E Dietologica. Band 54, Nr. 3, September 2008, S. 307–315, PMID 18614979.
- Nada N. Al-Shawi: Possible Histological Changes Induced by Therapeutic Doses of Ciprofloxacin in Liver and Kidney of Juvenile Rats. In: Pharmacologia. Band 3, Nr. 9, S. 477–480, doi:10.5567/pharmacologia.2012.477.480.
- Fluorochinolone: Entzündungen und Rupturen der Achillessehne. (PDF; 183 kB) Arzneimittelkommission der deutschen Ärzteschaft, abgerufen am 18. Juli 2017.
- Farzin Forooghian: Oral Fluoroquinolones and the Risk of Retinal Detachment. In: JAMA. 307, 2012, S. 1414, doi:10.1001/jama.2012.383.
- Björn Pasternak, Henrik Svanström, Mads Melbye, Anders Hviid: Association Between Oral Fluoroquinolone Use and Retinal Detachment. In: JAMA. 310, 2013, S. 2184, doi:10.1001/jama.2013.280500.
- Shu-Chen Kuo, Yung-Tai Chen, Yi-Tzu Lee, Nai-Wen Fan, Shih-Jen Chen: Association Between Recent Use of Fluoroquinolones and Rhegmatogenous Retinal Detachment: A Population-Based Cohort Study. In: Clinical Infectious Diseases. Band 58, Nr. 2, 15. Januar 2014, S. 197–203, doi:10.1093/cid/cit708.
- Fanny Raguideau, Magali Lemaitre, Rosemary Dray-Spira, Mahmoud Zureik: Association Between Oral Fluoroquinolone Use and Retinal Detachment. In: JAMA Ophthalmology. Band 134, Nr. 4, 1. April 2016, doi:10.1001/jamaophthalmol.2015.6205.
- FDA Drug Safety Communication: FDA requires label changes to warn of risk for possibly permanent nerve damage from antibacterial fluoroquinolone drugs taken by mouth or by injection. 15. August 2013 (fda.gov).
- Dauerhafte Nervenschäden durch Fluorochinolone. In: Deutsches Ärzteblatt. 16. August 2013 (aerzteblatt.de).
- M. A. Green, R. F. Halliwell: Selective antagonism of the GABAA receptor by ciprofloxacin and biphenylacetic acid. In: British Journal of Pharmacology. Band 122, Nr. 3, Oktober 1997, ISSN 0007-1188, S. 584–590, doi:10.1038/sj.bjp.0701411, PMID 9351519, PMC 1564969 (freier Volltext).
- Stefan Pieper: Fluoroquinolone-Associated Disability FQAD: Pathogenese, Diagnostik, Therapie und Diagnosekriterien. In: essentials. 1. Auflage. Springer, 2020, ISBN 978-3-658-29841-8, ISSN 2197-6708, S. 18–21, doi:10.1007/978-3-658-29842-5.
- Nick Daneman, Hong Lu, Donald A. Redelmeier: Fluoroquinolones and collagen associated severe adverse events: a longitudinal cohort study. In: BMJ Open. Band 5, Nr. 11, 1. November 2015, S. e010077, doi:10.1136/bmjopen-2015-010077, PMID 26582407.
- Chien-Chang Lee, Meng-tse Gabriel Lee, Yueh-Sheng Chen, Shih-Hao Lee, Yih-Sharng Chen: Risk of Aortic Dissection and Aortic Aneurysm in Patients Taking Oral Fluoroquinolone. In: JAMA Internal Medicine. Band 175, Nr. 11, 1. November 2015, S. 1839–1847, doi:10.1001/jamainternmed.2015.5389.
- Sonal Singh, Amit Nautiyal: Aortic Dissection and Aortic Aneurysms Associated with Fluoroquinolones: A Systematic Review and Meta-Analysis. In: The American Journal of Medicine. Band 130, Nr. 12, Dezember 2017, S. 1449–1457.e9, doi:10.1016/j.amjmed.2017.06.029.
- Scott A. LeMaire, Lin Zhang, Wei Luo, Pingping Ren, Chris Guardado: Abstract 15910: Ciprofloxacin Increases Susceptibility to Aortic Dissection and Rupture in Mice. In: Circulation. Band 136, Suppl 1, 14. November 2017, S. A15910 (circ.ahajournals.org [abgerufen am 21. Februar 2018]).
- Rote-Hand-Brief zu systemisch und inhalativ angewendeten Fluorchinolonen: Risiko für Aortenaneurysmen und Aortendissektionen. In: bfarm.de. Bundesinstitut für Arzneimittel und Medizinprodukte, 26. Oktober 2018, abgerufen am 26. Oktober 2018.
- Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM): Warnhinweise zu fluorchinolonhaltigen Antibiotika: Rote-Hand-Brief informiert über schwerwiegende und lang anhaltende Nebenwirkungen sowie neue Anwendungsbeschränkungen Pressemitteilung 2/19. Abgerufen am 8. April 2019.
- Martin Whling: Klinische Pharmakologie. Thieme, 2005, S. 528.
- FDA Drug Safety Communication: FDA advises restricting fluoroquinolone antibiotic use for certain uncomplicated infections; warns about disabling side effects that can occur together. (fda.gov), 12. Mai 2016.
- Informationen zu Nebenwirkungen der in den USA verfügbaren Fluorchinolonpräparate (fda.gov).
- FDA: Fluoroquinolone Safety Labeling Changes. (PDF) In: FDA. FDA, April 2017, abgerufen am 19. Januar 2019 (englisch).
- Veronika Hackenbroch: Medizin: Zwei Tabletten Schmerz. In: Der Spiegel. Nr. 7, 2017, S. 104–105 (online).
- Arzneimittelwesen – Beschlussfassung über Fluorchinolon-Antibiotika – Online-Petition. Abgerufen am 18. April 2017.
- Moritz Pompl, Carola Brand, Bayerischer Rundfunk: Nebenwirkungen von Medikamenten: Bürokratie gefährdet Gesundheit. (Nicht mehr online verfügbar.) 4. April 2017, archiviert vom Original am 20. Mai 2017; abgerufen am 18. April 2017.
- Betroffene von Fluorchinolon Nebenwirkungen: Petition an den Bundestag Nov.2016. (Nicht mehr online verfügbar.) November 2016, archiviert vom Original am 17. Januar 2018; abgerufen am 19. Juli 2017.
- BfArM – Presse – Fluorchinolone und Chinolone: BfArM stößt europäisches Risikobewertungsverfahren an. Abgerufen am 18. April 2017.
- Quinolone- and fluoroquinolone-containing medicinal products. EMA, 10. Februar 2017.
- Fluorchinolone: Schwere und langanhaltende Nebenwirkungen im Bereich Muskeln, Gelenke und Nervensystem. 5. Oktober 2018, abgerufen am 23. Oktober 2018.
- D. Adam, K.-F. Bodmann, W. Elies, C. Lebert, K. G. Naber, K. Simons, A. Pross: Orale Antibiotika in Klinik und Praxis: Praxisorientierte Empfehlungen zur Antibiotika-therapie leichter bis mittelschwerer bakterieller Infektionen bei Erwachsenen im ambulanten und stationären Bereich. Springer, 2009, ISBN 978-3-642-00521-3, S. 24.
- Levofloxacin: Indikationseinschränkungen wegen schwerer Nebenwirkungen. In: Deutsches Ärzteblatt. 4. September 2012 (aerzteblatt.de).
- Wolfgang Forth, Franz Hofmann, Ulrich Förstermann: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. Elsevier, Urban & Fischer Verlag, 2008, ISBN 978-3-437-44490-6, S. 831.
- Patent US4146719A: Piperazinyl derivates of quinoline carboxylic acids. Angemeldet am 16. Februar 1978, veröffentlicht am 27. März 1979, Anmelder: Kyorin Seiyaku KK, Erfinder: Tsutomu Irikura.
- J. Fischer, C.R. Ganellin (Hrsg.): Analogue-based Drug Discovery. John Wiley & Sons, 2006. S. 500.
- Patent DE3142854A1: 1-Cyclopropyl-6-fluor-1,4-dihydro-4-oxo-7-piperazino-chinolin-3-carbonsäuren, Verfahren zu ihrer Herstellung sowie diese enthaltende antibakterielle Mittel. Angemeldet am 9. Oktober 1981, veröffentlicht am 11. Mai 1983, Anmelder: Bayer AG, Erfinder: Klaus Grohe, Hans-Joachim Zeiler, Karl Georg Metzger.
- Patentanmeldung DE3033157A1: 7-Amino-1-cyclopropyl-4-oxo-1,4-dihydro-naphthyridin-3-carbonsäuren, Verfahren zu ihrer Herstellung sowie diese enthaltende antibakterielle Mittel. Angemeldet am 3. September 1980, veröffentlicht am 1. April 1982, Anmelder: Bayer AG, Erfinder: Klaus Grohe, Hans-Joachim Zeiler, Karl Georg Metzger.
- Swissmedic: Erweiterte Liste zugelassene Humanarzneimittel, Stand 21. August 2021.
- Walter Sneader: Drug Discovery. A History. John Wiley & Sons, 2005, ISBN 978-0-470-01552-0 (eingeschränkte Vorschau in der Google-Buchsuche).
- History of Daiichi – About Us. In: DaiichiSankyo.com. Abgerufen am 25. Februar 2017 (englisch).
- John M. Domagala, Lori Doyle Hanna, Carl L. Heifetz, Marland P. Hutt, Thomas F. Mich, Joseph P. Sanchez, Marjorie Solomon: New structure-activity relationships of the quinolone antibacterials using the target enzyme. The development and application of a DNA gyrase assay. In: Journal of Medicinal Chemistry. 29, 1986, S. 394, doi:10.1021/jm00153a015.
- L. Majtánová, V. Majtán: Quinolone effects in the SOS chromotest and the synthesis of biomacromolecules. In: Folia Microbiologica. Band 41, Nr. 3, 1996, PMID 9449772.
- Peter Ball: Efficacy and safety of levofloxacin in the context of other contemporary fluoroquinolones: A review. In: Current Therapeutic Research, Clinical and Experimental. Band 64, Nr. 9, 2003, PMID 24944413.