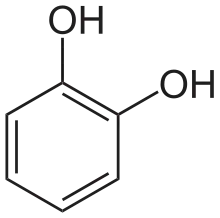
Brenzcatechin
Brenzcatechin (1,2-Dihydroxybenzol) ist ein zweiwertiges Phenol. Es besitzt zwei benachbarte, sich in sogenannter ortho-Position befindende Hydroxygruppen an einem Benzolring.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Brenzcatechin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C6H6O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 110,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,34 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
245 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 5 ml·m−3 bzw. 23 mg·m−3[4] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Die englische Bezeichnung ist Catechol (Kurzform von Pyrocatechol), nach IUPAC wird es auch 1,2-Dihydroxybenzen oder Benzen-1,2-diol genannt.
Außer Brenzcatechin (1,2-Dihydroxybenzol) existieren zwei weitere stellungsisomere Formen, nämlich das Resorcin (1,3-Dihydroxybenzol) und das Hydrochinon (1,4-Dihydroxybenzol).
Geschichte und Vorkommen
Der Trivialname der chemischen Verbindung geht auf die Gerber-Akazie (Acacia catechu) zurück. Aus deren Pflanzensaft, der Catechin enthält, wurde sie erstmals 1839 von dem Chemiker K. Reinsch durch trockene Destillation, sogenanntes Brenzen (altertümliche Bezeichnung für Pyrolyse), isoliert. Außerdem sind für Brenzcatechin die Bezeichnungen Pyrocatechin und Pyrocatechol geläufig.
Brenzcatechin ist im Pflanzenreich verbreitet und kann durch Pyrolyse (Brenzreaktion) natürlicher Rohstoffe wie Holz, Kohle und Lignin erhalten werden. Es ist mehrheitlich in Baumharz und Buchenholzteer enthalten. Früher wurde es auch aus den Schwelwässern der Braunkohle gewonnen.[6]
Außerdem ist Brenzcatechin in signifikanten Mengen auch in Tabakrauch zu finden (je nach Marke 20–500 µg pro Zigarette).[7][8] Dort wird Brenzcatechin auch eine Mitwirkung an der tumorpromovierenden Wirkung des Tabakrauchs zugewiesen. Als mögliche Mechanismen wurden unter anderen die Translokation der PKC und die Bildung von 8-Hydroxydeoxyguanosin vorgeschlagen.[9][10]
Gewinnung und Darstellung
Brenzcatechin lässt sich mit Hilfe einer Alkalischmelze[11] von o-Chlorphenol oder o-Phenolsulfonsäure darstellen.
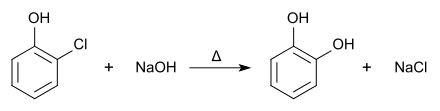
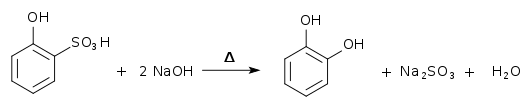
Auch durch Hydrolyse von 2-Chlorphenol mit Natronlauge bei höherer Temperatur in Gegenwart von Kupfersulfat, auch in Gegenwart von Bariumhydroxid und Kupfer(I)-chlorid[6] oder durch den oxidativen Abbau von Salicylaldehyd mit Wasserstoffperoxid und Natronlauge (Dakin-Reaktion).[12] Ebenso ist eine Etherspaltung von Guajacol mit Bromwasserstoff möglich.
Eigenschaften
Brenzcatechin bildet farblose Kristalle, die mit Wasserdampf leicht flüchtig sind. An der Luft und bei Lichteinfall wird es instabil und oxidiert zu 1,2-Benzochinon (Autoxidation).
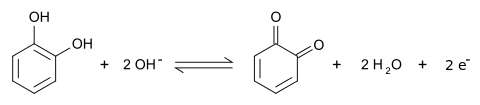
Die wässrige Lösung ist farblos, wird aber bei pH-Werten über 7 in Gegenwart von Sauerstoff schnell durch Oxidation braun. In neutraler Lösung ergibt die Kombination mit Eisen(III)-chlorid eine Grünfärbung. Diese Reaktion kann zur Unterscheidung der Dihydroxybenzole dienen: Resorcin gibt eine violette Färbung, Hydrochinon eine Blaufärbung, die nach kurzer Zeit wieder verschwindet, da das Hydrochinon vom Eisen(III)-chlorid zum p-Benzochinon oxidiert wird, das keine Farbreaktion zeigt.[13] Mit Blei(II)-acetat bildet sich dagegen ein farbloser Niederschlag. Eine blaugrüne Färbung gibt die Reaktion von Brenzcatechin mit „Vanadinschwefelsäure“ → Mandelin-Reagenz.[14][15] Ebenfalls eine blaugrüne Färbung gibt die Reaktion mit Chlorkalk.[15] Brenzcatechin ist ein starkes Reduktionsmittel, das Fehlingsche Lösung, Benedicts Reagenz und ammoniakalische Silbernitratlösung zu reduzieren vermag.
Verwendung
Die Verwendungsmöglichkeiten von Brenzcatechin liegen in der Fototechnik als Entwickler. Zum Einsatz kommt es als Antioxidations- und Desinfektionsmittel. In der organischen Synthese spielt es eine Rolle als Ausgangsmaterial für Farbstoffe, Riechstoffe und Arzneimittel sowie als Schutzgruppe für Carbonylverbindungen. Etwa 50 % des synthetischen hergestellten Brenzcatechins wird zur Herstellung von Pestiziden verwendet, wobei der Rest als Vorstufe zu Chemikalien zur Herstellung von Parfüms und Arzneimitteln dient.[16]
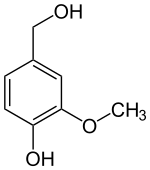
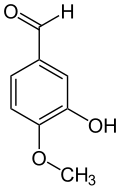
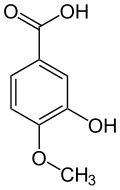
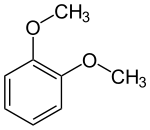
Das Hydroborierungsmittel Catecholboran[17] ist ein Derivat von Brenzcatechin. Methylierungen ergeben Guajacol (Monomethylether) und Veratrol (Dimethylether):
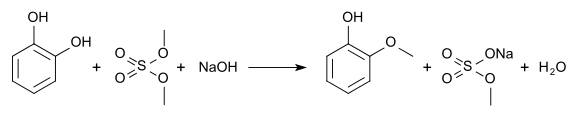
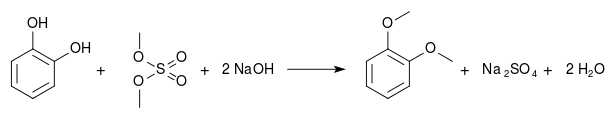
Naturstoffe
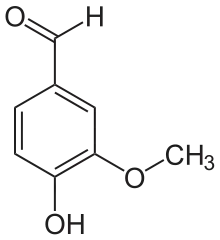
Vom Brenzcatechin und seinen Methylethern Guajacol und Veratrol leiten sich zahlreiche Naturstoffe ab, darunter das bekannte Vanillin. Die vorgenannten drei Basisverbindungen entstehen durch Decarboxylierung aus den entsprechenden Säuren: z. B. Veratrol aus Veratrumsäure. Veratrumaldehyd wird wiederum aus Veratrol mittels Vilsmeier-Formylierung dargestellt.[18]
Nachweis
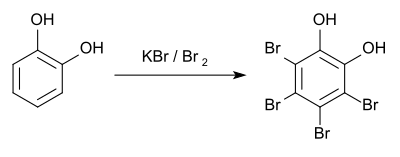
Zum qualitativ-analytischen Nachweis entsteht bei der Bromierung mit Kaliumbromid und Brom[19] das Tetrabromderivat mit einem Schmelzpunkt von 192 °C.[20]
Sicherheitshinweise
Die Dihydroxybenzole reizen Augen, Haut und Atemwege. Sie sind gesundheitsschädlich bei Berührung mit der Haut und beim Verschlucken. Brenzcatechin ist giftig für Wasserorganismen und daher als umweltgefährlich in Wassergefährdungsklasse 2 eingestuft.[1] Auf Vorschlag der französischen Chemikalienbehörde wurde 2015 und 2016 die chemikalienrechtliche Einstufung von Brenzcatechin überarbeitet. Der Ausschuss für Risikobewertung (RAC) der Europäischen Chemikalienagentur (ECHA) hat am 16. September 2016 die Einstufung für Brenzcatechin wie folgt entschieden: Brenzcatechin wird als krebserzeugend Carc 1B, Muta 2 sowie Acute Tox 3 für orale und dermale Gabe eingestuft. Die Warnhinweise wurden festgelegt auf H301, H311, H341 und H350. Die Einstufungen als Skin Irrit 2 und Eye Irrit 2 wurden mit den entsprechenden Warnhinweisen H315 und H319 beibehalten.[21] Diese Einstufung des RAC muss noch von der EU-Kommission in geltendes Recht umgesetzt werden, aber sie stellt mit der Veröffentlichung den Stand des Wissens dar, der von Unternehmen und Behörden berücksichtigt werden muss.
Toxikologie
Wie andere Dihydroxybenzene auch, wird Catechol im Gastrointestinaltrakt absorbiert und im Urin frei, als Monosulfat oder als Monoglucorinid ausgeschieden.[22] Außerdem wurde eine Absorption durch die Haut beobachtet.[23] Im Metabolismus entstehen als Zwischenprodukte unter anderen 1,4-Benzochinon, Trihydroxybenzene, aber auch bestimmte Semichinone.[23]
Bei einer Aufnahme von Catechol durch die Haut sind die beobachteten Symptome ähnlich zu denen einer Phenolvergiftung.[23] Außerdem kam es in Einzelfällen zu einer Kontaktdermatitis.[24] In bestimmten Zelllinien induzierte Catechol die Apoptose von Zellen.[25] In Erythrozyten kann Catechol Hämolyse verursachen.[26]
Auf einer molekularen Ebene, wird vermutet, dass Catechol durch die Bildung von Quinone und anderen Radikalen[27], in Kombination mit einer Depletion von Antioxidanzien, wie Glutathion, insgesamt ein Absinken der antioxidativen Kapazität verursacht und so zu oxidativem Stress führt.[28] Dieser könnte ursächlich für die Induktion von DNA-Schäden sein.[29] Außerdem kann Catechol mit Cysteinresten interagieren und so eventuell zur Aggregation von Proteinen oder zur Bildung von Disulfidbrücken führen.[30]
Einzelnachweise
- Eintrag zu Brenzcatechin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. November 2019. (JavaScript erforderlich)
- Eintrag zu Brenzcatechin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Dezember 2014.
- Eintrag zu Pyrocatechol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 15. November 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 120-80-9 bzw. Brenzcatechin), abgerufen am 2. November 2015.
- Eintrag zu Brenzcatechin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. August 2018.
- Hans R. Schweizer: Künstliche Organische Farbstoffe und Ihre Zwischenprodukte. Springer-Verlag, 13. März 2013, ISBN 978-3-642-87245-7, S. 142.
- J. D. Mold, M. P. Peyton, R. E. Means, T. B. Walker: Determination of catechol in cigarette smoke. In: Analyst. Band 91, Nr. 1080, 1. Januar 1966, ISSN 1364-5528, S. 189–194, doi:10.1039/AN9669100189.
- Klaus D. Brunnemann, Herng-Cherng Lee, Dietrich Hoffmann: Chemical Studies on Tobacco Smoke. XLVII. On the Quantitative Analysis of Catechols and Their Reduction. In: Analytical Letters. Band 9, Nr. 10, Oktober 1976, ISSN 0003-2719, S. 939–955, doi:10.1080/00032717608059158.
- R. Gopalakrishna, Z. H. Chen, U. Gundimeda: Tobacco smoke tumor promoters, catechol and hydroquinone, induce oxidative regulation of protein kinase C and influence invasion and metastasis of lung carcinoma cells. In: Proceedings of the National Academy of Sciences. Band 91, Nr. 25, 6. Dezember 1994, ISSN 0027-8424, S. 12233–12237, doi:10.1073/pnas.91.25.12233, PMID 7991611, PMC 45411 (freier Volltext).
- Per Leanderson, Christer Tagesson: Cigarette smoke-induced DNA-damage: Role of hydroquinone and catechol in the formation of the oxidative DNA-adduct, 8-hydroxydeoxyguanosine. In: Chemico-Biological Interactions. Band 75, Nr. 1, 1990, S. 71–81, doi:10.1016/0009-2797(90)90023-G.
- Alkalischmelze auf spektrum.de, abgerufen 1. August 2016.
- Brenzcatechin auf spektrum.de, abgerufen 1. August 2016.
- Uni Regensburg: Versuchsanleitung zum Nachweis von Dihydroxybenzolen (Peter Keusch).
- K. F. Mandelin, St. Petersburg: Über Vanadinschwefelsäure, ein neues Reagens für Alkoloide. E. Wienecke, 1883.
- Joseph Schomacker: Beitrag zum forensisch-chemischen Nachweise des Resorcin und Brenzcatechin im Thierkörper (PDF; 1,3 MB), Dissertation, 1886, Universität Dorpat.
- Fiegel, Helmut u. a.: Phenol Derivatives. In: Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 15 Juni 2000, doi:10.1002/14356007.a19_313.
- Externe Identifikatoren von bzw. Datenbank-Links zu Catecholboran: CAS-Nummer: 274-07-7, EG-Nummer: 205-991-5, ECHA-InfoCard: 100.005.447, PubChem: 67506, ChemSpider: 10617125, Wikidata: Q730606.
- Autorengemeinschaft: Organikum. 19. Auflage. Johann Ambrosius Barth, Leipzig / Berlin / Heidelberg 1993, ISBN 3-335-00343-8, S. 345.
- Autorengemeinschaft: Organikum. 19. Auflage. Johann Ambrosius Barth, Leipzig / Berlin / Heidelberg 1993, ISBN 3-335-00343-8, S. 331.
- Autorengemeinschaft: Organikum. 19. Auflage. Johann Ambrosius Barth, Leipzig / Berlin / Heidelberg 1993, ISBN 3-335-00343-8, S. 653.
- RAC-Entscheidung vom 16. September 2016.
- G. A. Garton, R. T. Williams: Studies in detoxication. 17. The fate of catechol in the rabbit and the characterization of catechol monoglucuronide. In: Biochemical Journal. Band 43, Nr. 2, 1. Januar 1948, ISSN 0006-2936, S. 206–211, doi:10.1042/bj0430206.
- International Agency for Research on Cancer.: Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide. World Health Organization, International Agency for Research on Cancer, [Lyon] 1999, ISBN 978-92-832-1271-3.
- Some fumigants, the herbicides 2,4-D and 2,4,5-T, chlorinated dibenzodioxins and miscellaneous industrial chemicals. In: IARC monographs on the evaluation of the carcinogenic risk of chemicals to man. Band 15, August 1977, S. 1–354, PMID 330387 (Review).
- J. L. Moran, D. Siegel, X. M. Sun, D. Ross: Induction of apoptosis by benzene metabolites in HL60 and CD34+ human bone marrow progenitor cells. In: Molecular pharmacology. Band 50, Nummer 3, September 1996, S. 610–615, PMID 8794901.
- B. Bukowska, S. Kowalska: Phenol and catechol induce prehemolytic and hemolytic changes in human erythrocytes. In: Toxicology letters. Band 152, Nummer 1, August 2004, S. 73–84, doi:10.1016/j.toxlet.2004.03.025, PMID 15294349.
- George Barreto, Diego Madureira, Francisco Capani, Laura Aon-Bertolino, Ezequiel Saraceno: The role of catechols and free radicals in benzene toxicity: An oxidative DNA damage pathway. In: Environmental and Molecular Mutagenesis. Band 50, Nr. 9, Dezember 2009, S. 771–780, doi:10.1002/em.20500.
- U. Stenius, M. Warholm, A. Rannug, S. Walles, I. Lundberg, J. Högberg: The role of GSH depletion and toxicity in hydroquinone-induced development of enzyme-altered foci. In: Carcinogenesis. Band 10, Nummer 3, März 1989, S. 593–599, doi:10.1093/carcin/10.3.593, PMID 2564322.
- S. Oikawa: Site specificity and mechanism of oxidative DNA damage induced by carcinogenic catechol. In: Carcinogenesis. Band 22, Nr. 8, 1. August 2001, S. 1239–1245, doi:10.1093/carcin/22.8.1239.
- Nina Schweigert, Alexander J. B. Zehnder, Rik I. L. Eggen: Chemical properties of catechols and their molecular modes of toxic action in cells, from microorganisms to mammals. Minireview. In: Environmental Microbiology. Band 3, Nr. 2, Februar 2001, ISSN 1462-2912, S. 81–91, doi:10.1046/j.1462-2920.2001.00176.x.