Dicyandiamid
Dicyandiamid (kurz DCD) ist eine vielseitig als Zwischenprodukt eingesetzte chemische Verbindung aus der Gruppe der Cyanamide. Es gehört chemisch zu den Cyanamid- und den Guanidinderivaten.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
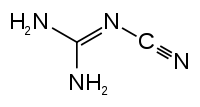 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dicyandiamid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2H4N4 | |||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 84,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
252 °C (Zersetzung)[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Dicyandiamid entsteht beim Abbau von Kalkstickstoff im Boden. Industriell wird es aus Cyanamid, technisch aus Calciumcyanamid (Kalkstickstoff) durch Umsetzung mit Kohlendioxid in wässrigem Medium in Gegenwart von Alkalien hergestellt.[4]
Einer der weltweit wichtigsten Produzenten außerhalb Chinas ist die AlzChem AG mit einer jährlichen Produktionsmenge von 20.000 Tonnen Dicyandiamid an ihrem Standort Schalchen.[5]
Im Labor erfolgt die Darstellung durch Dimerisierung einer warmen Cyanamid-Lösung mittels konzentrierter Ammoniak-Lösung:[6]
Eigenschaften
Dicyandiamid ist ein weißer kristalliner Feststoff, der bei 214 °C mit einer Schmelzenthalpie von 22,96 kJ·mol−1 schmilzt. Oberhalb des Schmelzpunktes erfolgt eine exotherme Zersetzung.[7] In fester Phase treten zwei polymorphe Kristallformen auf. Die Tieftemperaturkristallform wandelt sich bei −3,7 °C mit einer Umwandlungswärme von 2,98 kJ·mol−1 in die Hochtemperaturkristallform um.[7] Die Löslichkeit in Wasser wird mit 4,3 % bei 25 °C[3] und mit 36,6 g·l−1 bei 20 °C[1] angegeben.
Die Verbindung tritt in zwei tautomeren Formen auf.[4] Einige Quellen geben an, dass es laut Spektrum im festen Zustand nur in der Dicyandiamid-Form vorliegt.[8]
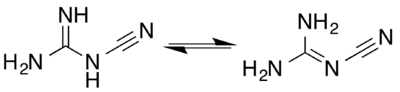
Die Verbindung ist brennbar, gilt aber als schwer entzündbar.[1]
Verwendung
Dicyandiamid wird als Synthesebaustein zur Herstellung von Kunststoffen, Düngemitteln, Pharmazeutika und technischen Chemikalien verwendet. Weiterhin dient es als Härter für heißhärtende Epoxidharzklebstoffe. Ebenso ist es ein Rohstoff für vorwärtsintegrierte Zwischenprodukte zur Herstellung verschiedener Guanidinsalze, Guanamine und Polykondensationsprodukte zum Einsatz in den Bereichen Wasserbehandlung, Textil und Leder, Flammschutz und Papier.[2][9]
Dicyandiamid wurde früher in Verbindung mit starken Oxidationsmitteln als Sprengstoff verwendet.[10]
Biologische Bedeutung
Dicyandiamid verzögert die Nitrifikation von Ammoniumverbindungen zu Nitrat durch Nitrosomonas und Nitrobacter[11] und wird aus diesem Grund als Nitrifikationshemmer in der Landwirtschaft verwendet. Letztendlich wird auch Cyanguanidin im Boden zu Harnstoff abgebaut, kann jedoch vorher über Weidevieh in Milch- und Milchprodukte gelangen.[4]
In der Umwelt ist Dicyandiamid persistent und mobil.[12]
Einzelnachweise
- Eintrag zu Dicyandiamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. September 2021. (JavaScript erforderlich)
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Guanidine, cyano-, abgerufen am 4. November 2014.
- Claudia Synowietz (Hrsg.): Taschenbuch für Chemiker und Physiker. begründet von Jean d’Ans, Ellen Lax. 4. Auflage. Band II: Organische Verbindungen. Springer, Berlin 1983, ISBN 3-540-12263-X.
- Eintrag zu Cyanguanidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Oktober 2016.
- innsalzach24.de: Jubiläum für ein bewährtes Produkt: 1.000.000 Tonnen Dicyandiamid, abgerufen am 16. September 2016.
- L. A. Pinck: Dicyanodiamide (Cyanoguanidine). In: Ludwig F. Audrieth (Hrsg.): Inorganic Syntheses. Band 3. McGraw-Hill, Inc., 1950, S. 43–45 (englisch).
- Ji-Biao Zhang; Zhi-Cheng Tan; Shuang-He Meng; Shao-Hui Li; Li-Ming Zhang: Heat capacity and thermal decomposition of dicyandiamide in Thermochim. Acta 307 (1997) 11–15, doi:10.1016/S0040-6031(97)00323-7.
- W. Jeremy Jones, W. J. Orville-Thomas: The infra-red spectrum and structure of dicyandiamide. In: Transactions of the Faraday Society. 55, 1959, S. 193, doi:10.1039/TF9595500193.
- Dicyandiamid. In: alzchem.com. Abgerufen am 29. Juni 2017.
- Datenblatt Dicyandiamid (PDF; 127 kB) bei gischem.de.
- Wirkung. In: alzchem.com. Abgerufen am 29. Juni 2017.
- Isabelle Neuwald, Matthias Muschket, Daniel Zahn, Urs Berger, Bettina Seiwert: Filling the knowledge gap: A suspect screening study for 1310 potentially persistent and mobile chemicals with SFC- and HILIC-HRMS in two German river systems. In: Water Research. Band 204, Oktober 2021, S. 117645, doi:10.1016/j.watres.2021.117645.