Aminophenazon
Aminophenazon ist der Trivialname und Freiname (INN) einer chemischen Verbindung aus der Gruppe der Stickstoffheterocyclen, die eine Weiterentwicklung des Phenazons darstellt. Beides sind synthetische Pyrazolon-Derivate, die wegen ihrer fiebersenkenden (antipyretischen) und schmerzdämpfenden (analgetischen) Wirkung bereits im 19. Jahrhundert in Arzneimitteln der Farbwerke Hoechst (unter den Handelsnamen Pyramidon® bzw. Antipyrin®) erfolgreich vermarktet wurden.
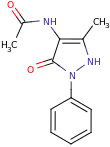
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-1%252C5-dimethyl-2-phenyl-1H-pyrazol-3(2H)-one_200.svg.png.webp) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Aminophenazon | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C13H17N3O | |||||||||||||||||||||
| Kurzbeschreibung |
lichtempfindliches, brennbares,[1] weißes bis fast weißes kristallines Pulver oder farblose Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N02BB03 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 231,30 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Im Unterschied zum Phenazon trägt Aminophenazon in 4-Position des Pyrazolon-Heterocyclus eine Dimethylamino-Gruppe (tertiäres Amin), weshalb es treffender auch Dimethylaminophenazon genannt wird.
Geschichte
Friedrich Stolz und Ludwig Knorr gelten als Erfinder des Wirkstoffs Aminophenazon, der 1897 in dem Medikament Pyramidon® durch die Farbwerke vorm. Meister, Lucius & Brüning AG in Höchst am Main auf den Markt gebracht wurde.
Gewinnung und Darstellung

Aminophenazon kann aus Phenazon durch Nitrosierung, anschließende Reduktion des 4-Nitrosophenazons und Eschweiler-Clarke-Methylierung gewonnen werden.[3][4]
Verwendung
Aminophenazon ist ein Pyrazolon (Pyrazolin-3-on) mit fiebersenkenden, entzündungshemmenden und analgetischen Eigenschaften. Es ist als Nichtopioid-Analgetikum eine Weiterentwicklung von Phenazon und dreimal stärker wirksam als dieses, jedoch mit dem Risiko einer Agranulozytose. Aminophenazon darf aufgrund des kanzerogenen Metaboliten Dimethylnitrosamin nur noch veterinär verwendet werden (in frühen Stadien des septischen Schockes bei Hund und Katze und in Kombination mit Phenylbutazon)[5] und wird in Kombinationspräparaten seit 1977 durch Propyphenazon ersetzt.[6]
Ein Atemtest mit 13C-markiertem Aminopyrin wurde zur nicht-invasiven Messung der Cytochrom P-450 Aktivität in der Leber verwendet.[7]
Pharmakokinetik
Nach peroraler Gabe wird Aminophenazon rasch resorbiert.[9] Es liegt eine geringe Plasmaproteinbindung vor.[10] Bei Ratten konnte 30 Minuten nach der Gabe eine erhöhte Konzentration in der Nasenschleimhaut und in der Leber nachgewiesen werden.[11]
Im Urin wurde 4-Acetylamino-3-methyl-1-phenylpyrazolon nachgewiesen. Das lässt auf eine oxidative N-Dealkylierung durch das MFO-System[12] (Cytochrom P450-haltige Monooxygenasen oder mischfunktionelle Oxygenasen) in der Leber und anschließender Acetylierung der freien, primären Aminogruppe schließen.[8] Ein analoger Mechanismus wird beim Metabolismus des strukturell sehr ähnlichen Metamizol-Metaboliten 4-Methylaminophenazon nach dessen Resorption beobachtet.[13] Die Metabolisierungsgeschwindigkeit durch das Cytochrom P450-System ist bei Ratten tageszeitenabhängig.[14] Renal kann Aminophenazon unverändert, glucuronidiert oder sulfatiert ausgeschieden werden;[9] nach hohen Dosen kann Rubazonsäure im Harn auftreten,[15] und dessen Rotfärbung bewirken.[13]
Siehe auch
Einzelnachweise
- Eintrag zu Aminophenazon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Februar 2017. (JavaScript erforderlich)
- Europäisches Arzneibuch 6.2
- Beyer-Walter, Lehrbuch der Organischen Chemie, 21. Aufl. Hirzel, Stuttgart 1988, S. 739.
- Pharmazeutische Chemie - Teil 6 - Nichtopioide Analgetika (PDF; 529 kB).
- Eintrag zu Aminophenazon bei Vetpharm, abgerufen am 23. Juni 2012.
- J. Gasteiger, A. Schunk, Universität Erlangen: Heterocyclen als Arzneimittel.
- A. Rocco, G. de Nucci, G. Valente, D. Compare, A. D'Arienzo, L. Cimino, F. Perri, G. Nardone: 13C-aminopyrine breath test accurately predicts long-term outcome of chronic hepatitis C. In: Journal of hepatology. Band 56, Nummer 4, April 2012, S. 782–787, doi:10.1016/j.jhep.2011.10.015. PMID 22173159.
- D. E. Hathway: Foreign compound metabolism in mammals, volume 2. The Chemical Society, Burlington House, London, WIV OBN, England, 1972. xv + 513 pp. 14.5 In: Journal of Pharmaceutical Sciences. 62, 1973, S. 186, doi:10.1002/jps.2600620954.
- Jones, L.M., et al. Veterinary Pharmacology & Therapeutics. 4th ed. Ames: Iowa State University Press, 1977., S. 363.
- Goodman, L.S., and A. Gilman. (eds.) The Pharmacological Basis of Therapeutics. 5th ed. New York: Macmillan Publishing Co., Inc., 1975., S. 347.
- E. B. Brittebo: N-Demethylation of Aminopyrine by the Nasal Mucosa in Mice and Rats. In: Acta Pharmacol Toxicol. Band 51, Nr. 3, S. 227–232, doi:10.1111/j.1600-0773.1982.tb01018.x.
- Sullivan, J.B. Jr., G.R. Krieger (eds.). Hazardous Materials Toxicology-Clinical Principles of Environmental Health. Baltimore, MD: Williams and Wilkins, 1992., S. 119.
- Mutschler Arzneimittelwirkungen, 9. Auflage, Wissenschaftl. Verlagsgesellschaft mbH Stuttgart, S. 251 f., ISBN 978-3-8047-1952-1.
- Doull, J., C.D. Klaassen, and M. D. Amdur (eds.). Casarett and Doull's Toxicology. 2nd ed. New York: Macmillan Publishing Co., 1980., S. 67.
- H. Oelschläger: Drug Metabolism: Chemical and Biochemical Aspects von B. Testa und P. Jenner, 700 S., Marcel Dekker, Inc., New York 1976. In: Archiv der Pharmazie. 311, 1978, S. 165, doi:10.1002/ardp.19783110215.