Stereoselektivität
Stereoselektivität ist ein Begriff der stereochemischen Dynamik. Eine Reaktion verläuft stereoselektiv, wenn von mehreren möglichen Stereoisomeren eines überwiegend oder ausschließlich entsteht.[1]
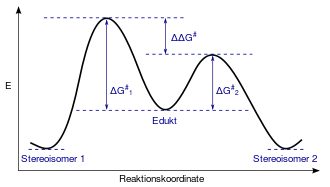
Übergangszustände
Die Erklärung der Stereoselektivität erfolgt aus der Theorie der Übergangszustände. Der Reaktionsweg mit der niedrigsten Aktivierungsenergie wird bevorzugt durchlaufen, so dass ein Stereoisomer bevorzugt gebildet wird. Ein einfaches Beispiel ist die nukleophile Substitution nach SN2-Mechanismus mit Walden-Umkehr.
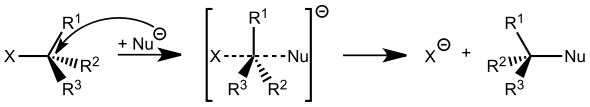
Auch bei der Eliminierung von Chlorwasserstoff aus 2-Chlorbutan können das cis- und das trans-Isomere von 2-Buten stereoselektiv entstehen:
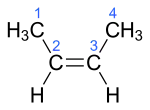 cis-2-Buten
cis-2-Buten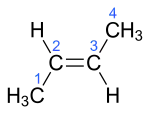 trans-2-Buten
trans-2-Buten
Das Ausmaß der Stereoselektivität hängt von der energetischen Differenz der Übergangszustände und der Reaktionstemperatur ab. Der Übergangszustand kann unter anderem von der stereochemischen Struktur eines eingesetzten Katalysators und dem verwendeten Lösungsmittel beeinflusst werden.
Bei enantioselektiven Reaktionen spricht man dann von diastereotopen Übergangszuständen. Diastereotope Übergangszustände können sich nur dann entwickeln, wenn wenigstens einer der Reaktionspartner chiral ist (induzierte Stereoselektivität). Enzyme wirken als stereoselektive Katalysatoren, indem sie gezielt die Energie eines spezifischen Übergangszustands absenken. Ein Beispiel für eine stereoselektive Reaktion der organischen Synthesechemie ist die Sharpless-Epoxidierung.
Sind theoretisch mehrere Stereoisomere als Reaktionsprodukte denkbar, wird aber ausschließlich ein Übergangszustand durchlaufen, nennt man die Reaktion stereospezifisch. Ein theoretisches Modell der Ausbeuteberechnung von stereoselektiven Reaktionen wurde von Ernst Ruch und Ivar Ugi entwickelt.[2]
Für spezielle Reaktionstypen bestehen Regeln, die die Bildung des bevorzugten Stereoisomers voraussagen. So erlaubt die Cramsche Regel eine qualitative Voraussage des stereochemischen Verlaufs einer diastereoselektiven nucleophilen Addition von metallorganischen Verbindungen an eine Kohlenstoff-Sauerstoff-Doppelbindung, die in α-Position ein Chiralitätszentrum mit drei Substituenten unterschiedlicher Raumerfüllung aufweist.[3]
Siehe auch
Einzelnachweise
- Ernest L. Eliel: Stereochemie der Kohlenstoffverbindungen, Weinheim, Verlag Chemie, (1966).
- Ernst Ruch, Ivar Ugi: Das stereochemische Strukturmodell, ein mathematisches Modell zur gruppentheoretischen Behandlung der dynamischen Stereochemie, in: Theoret. Chim. Acta, 1966, 4, 287–304, doi:10.1007/BF00528481.
- Donald J. Cram, Fathy Ahmed Abd Elhafez: Studies in Stereochemistry. X. The Rule of "Steric Control of Asymmetric Induction" in the Syntheses of Acyclic Systems. In: J. Am. Chem. Soc.; 1952; 74(23); 5828–5835, doi:10.1021/ja01143a007.
Literatur
- Lewis N. Mander: Stereoselektive Synthese. Wiley-VCH, 1998, ISBN 978-3-527-29566-1 (Online)